Describir y analizar, según la vía diagnóstica, las características de los tumores de cáncer de mama. Se analizan los efectos adversos de los tratamientos recibidos y la utilización de terapias no convencionales para paliarlos.
MétodoDiseño descriptivo anidado en cohorte mixta (Cohorte DAMA). La variable dependiente fue la vía diagnóstica del cáncer de mama. Las variables independientes fueron la edad, el índice de masa corporal, la clase social, con renta familiar disponible, el tipo de tumor, el grado histológico, el estadio tumoral, las recidivas, el tratamiento, los efectos adversos de los tratamientos y las terapias no convencionales. Se realizaron análisis descriptivos bivariados y se ajustaron modelos de regresión univariados y multivariados, y se hicieron representaciones gráficas de la frecuentación de terapias no convencionales.
ResultadosExisten diferencias en las características de los tumores y en el impacto de los efectos adversos derivados de los tratamientos. Las pacientes diagnosticadas por cribado fueron de mayor edad y de clase social alta, presentaron un mayor porcentaje de tumores de grado I histológico, estadios iniciales, menos recidivas y efectos adversos debidos al tratamiento, aunque este no fuera distinto en el grupo de cribado respecto al resto. También hubo un menor uso de terapias no convencionales.
ConclusionesLos resultados indican que la implantación de programas de cribado aumenta la posibilidad de detectar tumores en etapas iniciales y con terapias con menos efectos adversos; en consecuencia, con menor necesidad de recurrir a terapias no convencionales.
To describe and analyze the characteristics of breast cancer tumours according to the diagnostic pathway. We analyse the adverse effects of the treatments and the use of unconventional therapies in order to alleviate them.
MethodDescriptive design nested in a mixed cohort (Cohort DAMA). The dependent variable was the route to diagnosis of breast cancer. The independent variables were age, body mass index, social class, disposable family income, type of tumour, histological degree, tumour stage, recurrences, treatment, adverse effects derived from treatments and unconventional therapies. Bivariate descriptive analyses were performed and univariate and multivariate regression models were adjusted; and graphic representations of the unconventional therapies.
ResultsThere are differences in the characteristics of the tumours, and the impact of the adverse effects derived from the treatments. The patients diagnosed by screening were older, from a high social class, had a higher percentage of tumours of grade I differentiation, initial stages, fewer recurrences and fewer adverse effects due to treatment, although this was not different in the screening group compared to the rest. There was also less use of unconventional therapies.
ConclusionsThe results indicate that the implementation of screening programmes increases the possibility of detecting tumours in initial stages and with therapies with fewer adverse effects. As a result, there is less need to resort to unconventional therapies.
El cáncer de mama es la enfermedad oncológica más frecuente en las mujeres de todo el mundo. En España, cada año se diagnostican 26.000 nuevos casos, que constituyen el 30% de todos los tumores en las mujeres1.
Entre los años 1960 y 1980 se realizaron ensayos clínicos que demostraron que la detección precoz de estos tumores mediante mamografía se asociaba a una disminución de la mortalidad de un 15-20%2,3. A partir de estos resultados se recomendaron los programas de cribado3, que en nuestro entorno son poblacionales. No obstante, todavía se diagnostican cánceres en la práctica asistencial4.
Mediante los programas de cribado se detectan tumores más pequeños y con menor afectación regional, lo que permite optar por tratamientos menos agresivos5,6, disminuyendo los efectos adversos y mejorando el pronóstico. Los cánceres diagnosticados cuando ya presentan clínica, incluyendo los cánceres de intervalo7, son tumores que se encuentran en fases más avanzadas, lo cual suele implicar un mayor tamaño y que la axila esté afectada, por lo que requieren tratamientos más agresivos5,6.
Las características y el estadio de los tumores determinarán el tipo de tratamiento. Para los estadios I y II, el tratamiento con cirugía conservadora y radioterapia ha sustituido a las cirugías radicales con idéntica supervivencia. La quimioterapia adyuvante mejora las tasas de supervivencia independientemente de la edad, la afectación ganglionar y la sensibilidad hormonal8. La radioterapia complementaria reduce el porcentaje de recidivas locorregionales y mejora la supervivencia. Finalmente, la hormonoterapia es eficaz en todas las pacientes con tumores con receptores hormonales positivos8 y se está utilizando de forma neoadyuvante en mujeres posmenopáusicas9.
Los efectos secundarios o adversos de la quimioterapia dependen del tipo, la dosis y la duración del tratamiento. La caída del cabello, las alteraciones ungueales, las náuseas y los vómitos son algunos de ellos, pero estos dos últimos son los síntomas más frecuentes derivados de la quimioterapia. Además, la leucocitopenia hace aumentar la incidencia de infecciones y la afectación de las células del sistema digestivo causa diarreas10,11. Normalmente estos efectos adversos desaparecen una vez finalizado el tratamiento. La radioterapia puede provocar disfagia, tos irritativa y eritema (este último con más frecuencia), o bien efectos crónicos como pigmentación de la piel y fibrosis pulmonar8. Aunque cabe mencionar que los efectos adversos de la radioterapia varían considerablemente según el tipo de tratamiento y los tejidos tratados, la dermitis aguda es el efecto más frecuente e importante en los tumores de mama12. Los efectos adversos de la hormonoterapia dependen en gran parte del tipo de tratamiento administrado, pero los más comunes son los sofocos, los sudores nocturnos y la sequedad vaginal13.
Entendemos como terapias no convencionales aquellos cuidados para la salud, prácticas o productos que no pertenecen a la atención sanitaria habitual. Cuando se usan junto con el tratamiento convencional se las considera complementarias, y cuando lo sustituyen, alternativas14. En las personas con cáncer suelen usarse para ayudar a paliar los efectos adversos de los tratamientos. Por otro lado, también se utilizan terapias de autoayuda, entendidas como la práctica de técnicas para aumentar la calidad de vida, como por ejemplo la meditación y el Tai Chi. Las terapias no convencionales y de autoayuda más frecuentes en nuestro medio son la acupuntura, la fitoterapia o herbolario, la homeopatía, las terapias psicosomáticas, los masajes, las terapias nutricionales (toma de vitaminas o de suplementos nutricionales), el Reiki y la reflexología15,16. En Alemania se han observado un creciente interés y una mayor utilización de estas terapias en pacientes con cáncer de mama avanzado17. En general, sobre todo en los países occidentales, no hay evidencia sobre la eficacia de muchos de estos tratamientos y se desconocen sus efectos adversos.
Este estudio tiene por objetivo describir y analizar las características de las mujeres y de los tumores en la cohorte DAMA según hayan sido diagnosticados en un programa de cribado poblacional o por síntomas. A su vez, se analizan los efectos adversos de los tratamientos recibidos y la utilización de terapias no convencionales.
MétodoDiseño descriptivo anidado en un estudio de cohortes mixto retrospectivo-prospectivo de la Cohorte DAMA, compuesta por 2235 mujeres diagnosticadas de cáncer de mama en cuatro hospitales universitarios públicos de Barcelona (Hospital Clínic, Hospital Universitari Vall d’Hebron, Hospital de la Santa Creu i Sant Pau y Parc de Salut Mar). Las mujeres se identificaron a partir del Conjunto Mínimo Básico de Datos y se incluyeron todas las mayores de 18 años que tuvieran un diagnóstico principal codificado entre los códigos CIE-9 174.0 y 179.9 del 1 de enero de 2003 al 31 de diciembre de 2013. Se excluyeron las mujeres diagnosticadas de cáncer de mama que no estaban en edad de cribado, así como las diagnosticadas anteriormente de otro tipo de cáncer y las residentes fuera de Cataluña18.
Una vez aceptado y firmado el consentimiento informado, se realizó una encuesta telefónica en la que se recogieron datos sociodemográficos de las mujeres. Posteriormente se realizó, on-line o en papel, un cuestionario autoadministrado sobre el estado de salud en el que, entre otros, se incluían la vía diagnóstica del cáncer, datos sobre el cáncer de mama, su tratamiento y complicaciones, y uso de terapias no convencionales. Por último, se revisaron las historias clínicas de las pacientes y se recogieron datos clínicos relevantes relacionados con el diagnóstico y las características del cáncer de mama, los tratamientos, las recaídas y las visitas de seguimiento.
La variable dependiente fue la vía de diagnóstico del cáncer de mama, agrupada en: 1) programa poblacional de detección precoz del cáncer de mama (PDPCM) o 2) revisión médica habitual, tras notarse un bulto, por seguimiento clínico de factores de riesgo o por otros signos o síntomas (no-PDPCM). Las variables explicativas fueron la edad (agrupada en 50-54, 55-59, 60-64 y 65-69 años), el índice de masa corporal (IMC) distinguiendo bajo peso (IMC<18,5), normopeso (IMC 18,5-24,9), sobrepeso (IMC 25-29,9) y obesidad (IMC ≥30)18, la clase social basada en la ocupación de la mujer o del sustentador principal del hogar según la Clasificación Nacional de Ocupaciones (CON-201) y clasificada en tres categorías según la adaptación española de la British Registrar General Classification en alta (I y II), media (III) y baja (IV y V), y la renta familiar disponible agrupada en cuartiles como baja (<76,1), media-baja (76,1-89,6), media-alta (89,6-109,5) y alta (≥109,5). La renta familiar disponible es un índice compuesto por cinco indicadores socio-económicos: tasa de titulados superiores en la población, situación laboral entendida como el ratio entre desempleados y población en edad de trabajar, número de coches en relación con la población, potencia de los nuevos coches adquiridos por los residentes del área y precios del mercado residencial de segunda mano.
Como variables explicativas clínicas se establecieron el tipo de tumor (in situ o invasivo), el grado histológico (I, II, III o no aplicable), el estadio del tumor en el momento del diagnóstico (in situ, I, II, III o IV) y la presencia o no de recidivas.
Para cada tipo de tratamiento recibido se estudiaron los efectos adversos. Los derivados de la quimioterapia fueron caída del cabello, vómitos, alteraciones en el ritmo deposicional (diarrea o estreñimiento), alteraciones en el sentido del gusto, úlceras en la cavidad oral, alteraciones ungueales y disminución de la actividad del sistema inmunitario. En relación con la radioterapia, los efectos adversos considerados fueron descamación de la piel y cansancio referido como mayor de lo habitual. Finalmente, los efectos derivados del tratamiento hormonal fueron aumento de peso, sofocos, dolores articulares, osteoporosis y cambios en la menstruación.
Respecto a las terapias no convencionales, se distinguió entre terapias y técnicas de autoayuda. Se preguntó a las mujeres si acudieron al quiropráctico, al osteópata, al homeópata, al acupuntor, al herborista o al médico naturista o naturópata, y se analizaron concretamente las de manipulación. En referencia a la autoayuda, se consideraron la meditación, el yoga, el Qigong, el Tai Chi, el Reiki, las técnicas de relajación, la visualización y la sanación espiritual.
Análisis estadísticosSe utilizaron descriptivos bivariados de las diferentes variables del estudio en función de la variable dependiente vía de diagnóstico, analizando la existencia de diferencias estadísticamente significativas con p<0,05, mediante la prueba de ji al cuadrado o el test exacto de Fisher. Se ajustaron modelos de regresión logística univariados y multivariados para obtener odds ratio crudas (ORc) y ajustadas (ORa) con sus intervalos de confianza del 95% (IC95%). Las variables de ajuste se seleccionaron de acuerdo con las hipótesis del estudio independientemente de que fueran o no significativas en los modelos. Se realizaron también modelos de regresión logística crudos para cada una de las complicaciones y efectos adversos de los tratamientos recibidos, así como para las terapias de autoayuda.
Por último, se representaron en gráficas la frecuentación de profesionales de terapias no convencionales y la frecuentación de la realización de estos tratamientos. También se representó gráficamente la frecuentación del uso de terapias de autoayuda según la vía de diagnóstico.
Para el análisis estadístico se usaron los programas R versión 3.2.4 y SPSS versión 23.
ResultadosDe las 2235 mujeres de la Cohorte DAMA se excluyeron 41 del estudio por no disponer de información sobre la vía de diagnóstico y 928 por no estar dentro del rango de edad de cribado (50-69 años). Aproximadamente un 40% de los cánceres fueron diagnosticados mediante cribado (tabla 1).
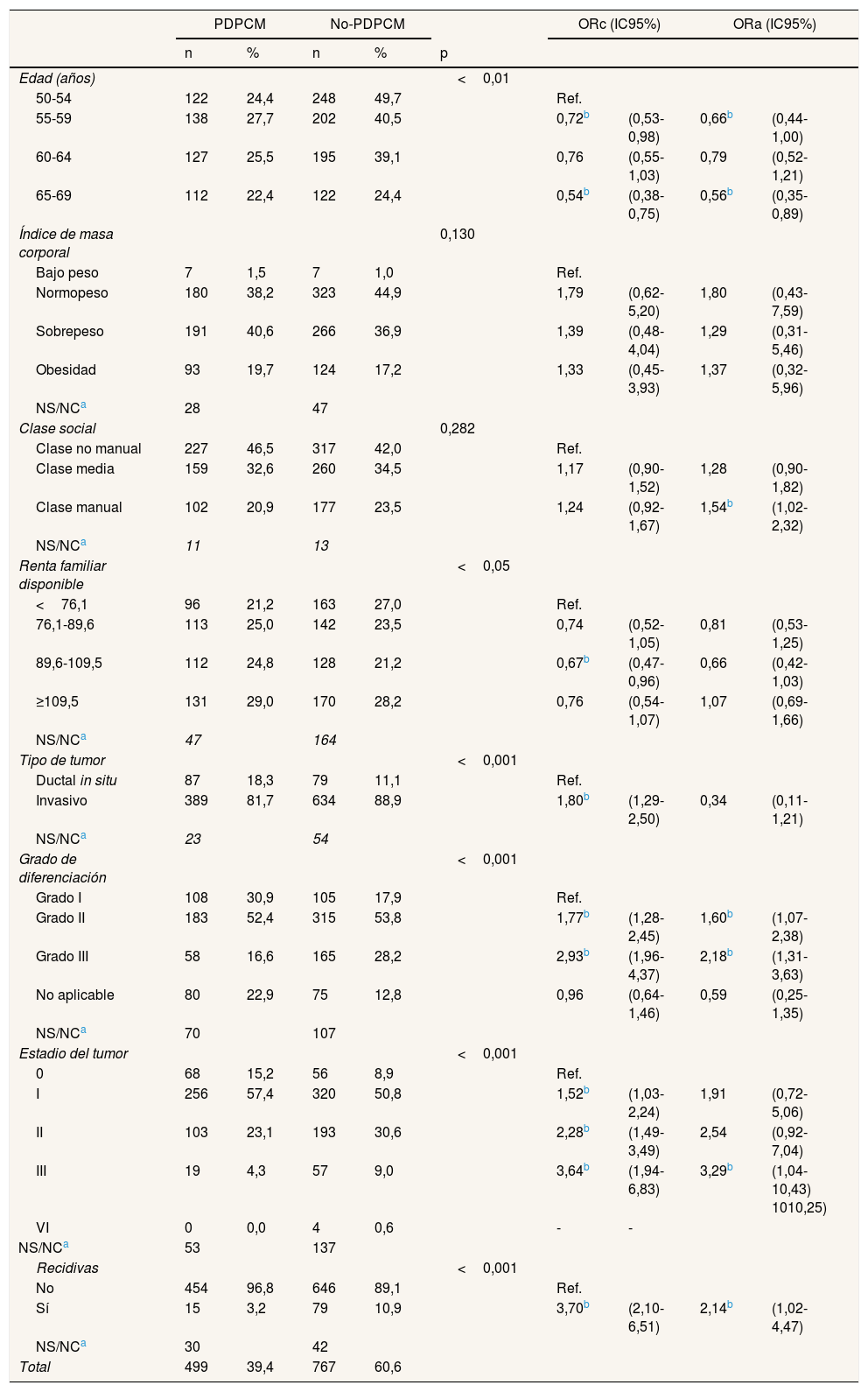
Descripción de las variables sociodemográficas y las características de los tumores, y análisis de regresión logística univariado y multivariado de las diferentes vías de diagnóstico
| PDPCM | No-PDPCM | ORc (IC95%) | ORa (IC95%) | ||||||
|---|---|---|---|---|---|---|---|---|---|
| n | % | n | % | p | |||||
| Edad (años) | <0,01 | ||||||||
| 50-54 | 122 | 24,4 | 248 | 49,7 | Ref. | ||||
| 55-59 | 138 | 27,7 | 202 | 40,5 | 0,72b | (0,53-0,98) | 0,66b | (0,44-1,00) | |
| 60-64 | 127 | 25,5 | 195 | 39,1 | 0,76 | (0,55-1,03) | 0,79 | (0,52-1,21) | |
| 65-69 | 112 | 22,4 | 122 | 24,4 | 0,54b | (0,38-0,75) | 0,56b | (0,35-0,89) | |
| Índice de masa corporal | 0,130 | ||||||||
| Bajo peso | 7 | 1,5 | 7 | 1,0 | Ref. | ||||
| Normopeso | 180 | 38,2 | 323 | 44,9 | 1,79 | (0,62-5,20) | 1,80 | (0,43-7,59) | |
| Sobrepeso | 191 | 40,6 | 266 | 36,9 | 1,39 | (0,48-4,04) | 1,29 | (0,31-5,46) | |
| Obesidad | 93 | 19,7 | 124 | 17,2 | 1,33 | (0,45-3,93) | 1,37 | (0,32-5,96) | |
| NS/NCa | 28 | 47 | |||||||
| Clase social | 0,282 | ||||||||
| Clase no manual | 227 | 46,5 | 317 | 42,0 | Ref. | ||||
| Clase media | 159 | 32,6 | 260 | 34,5 | 1,17 | (0,90-1,52) | 1,28 | (0,90-1,82) | |
| Clase manual | 102 | 20,9 | 177 | 23,5 | 1,24 | (0,92-1,67) | 1,54b | (1,02-2,32) | |
| NS/NCa | 11 | 13 | |||||||
| Renta familiar disponible | <0,05 | ||||||||
| <76,1 | 96 | 21,2 | 163 | 27,0 | Ref. | ||||
| 76,1-89,6 | 113 | 25,0 | 142 | 23,5 | 0,74 | (0,52-1,05) | 0,81 | (0,53-1,25) | |
| 89,6-109,5 | 112 | 24,8 | 128 | 21,2 | 0,67b | (0,47-0,96) | 0,66 | (0,42-1,03) | |
| ≥109,5 | 131 | 29,0 | 170 | 28,2 | 0,76 | (0,54-1,07) | 1,07 | (0,69-1,66) | |
| NS/NCa | 47 | 164 | |||||||
| Tipo de tumor | <0,001 | ||||||||
| Ductal in situ | 87 | 18,3 | 79 | 11,1 | Ref. | ||||
| Invasivo | 389 | 81,7 | 634 | 88,9 | 1,80b | (1,29-2,50) | 0,34 | (0,11-1,21) | |
| NS/NCa | 23 | 54 | |||||||
| Grado de diferenciación | <0,001 | ||||||||
| Grado I | 108 | 30,9 | 105 | 17,9 | Ref. | ||||
| Grado II | 183 | 52,4 | 315 | 53,8 | 1,77b | (1,28-2,45) | 1,60b | (1,07-2,38) | |
| Grado III | 58 | 16,6 | 165 | 28,2 | 2,93b | (1,96-4,37) | 2,18b | (1,31-3,63) | |
| No aplicable | 80 | 22,9 | 75 | 12,8 | 0,96 | (0,64-1,46) | 0,59 | (0,25-1,35) | |
| NS/NCa | 70 | 107 | |||||||
| Estadio del tumor | <0,001 | ||||||||
| 0 | 68 | 15,2 | 56 | 8,9 | Ref. | ||||
| I | 256 | 57,4 | 320 | 50,8 | 1,52b | (1,03-2,24) | 1,91 | (0,72-5,06) | |
| II | 103 | 23,1 | 193 | 30,6 | 2,28b | (1,49-3,49) | 2,54 | (0,92-7,04) | |
| III | 19 | 4,3 | 57 | 9,0 | 3,64b | (1,94-6,83) | 3,29b | (1,04-10,43) 1010,25) | |
| VI | 0 | 0,0 | 4 | 0,6 | - | - | |||
| NS/NCa | 53 | 137 | |||||||
| Recidivas | <0,001 | ||||||||
| No | 454 | 96,8 | 646 | 89,1 | Ref. | ||||
| Sí | 15 | 3,2 | 79 | 10,9 | 3,70b | (2,10-6,51) | 2,14b | (1,02-4,47) | |
| NS/NCa | 30 | 42 | |||||||
| Total | 499 | 39,4 | 767 | 60,6 | |||||
IC95%: intervalo de confianza del 95%; No-PDPCM: revisión habitual por su médico, por acudir tras notarse un bulto, por seguimiento clínico de factores de riesgo, u otras formas de diagnóstico por signos o síntomas; NS/NC: no sabe/No contesta; ORa: odds ratio ajustada; ORc: odds ratio cruda; PDPCM: programa de detección precoz de cáncer de mama.
Se encontraron diferencias significativas en la edad y la renta familiar disponible. En la vía diagnóstica PDPCM predominaron los grupos de edad centrales (27,7% en 55-59 años y 25,5% en 60-64 años), mientras que en no-PDPCM predominaron las mujeres más jóvenes (32,3% en 55-59 años y 26,3% en 60-64 años). En relación a la renta familiar disponible, el grupo de mayor renta fue el más frecuente en las dos vías de diagnóstico (29,0% en PDPCM y 28,2% en no-PDPCM). En relación con el IMC, en PDPCM predominan las mujeres con sobrepeso (40,6%), mientras que en no-PDPCM predominan las mujeres con normopeso (44,9%), sin que la diferencia llegue a ser significativa (p=0,130). La mayoría de las mujeres fueron de clase social alta (46,5% en PDPCM y 42,0% en no-PDPCM), sin encontrar significación estadística en la comparación (p=0,282) (tabla 1).
En el descriptivo de las variables relacionadas con los tumores se hallaron diferencias significativas en las cuatro variables estudiadas (tabla 1). El tumor invasivo fue el más frecuente en los dos grupos (81,7% en PDPCM y 88,9% en no-PDPCM). Respecto al grado histológico, en ambas vías de diagnóstico la mitad de las mujeres presentaron grado II (52,4% en PDPCM y 53,8% en no-PDPCM), seguido del grado I en PDPCM (30,9%) y del grado III en no-PDPCM (28,2%). La mayoría de los tumores se encontraban en estadios poco avanzados (PDPCM: 57,4% y 23,1% en estadios I y II, respectivamente; no-PDPCM: 50,8% y 30,6% en estadios I y II, respectivamente). Las mujeres diagnosticadas mediante PDPCM presentaron menos recidivas que las diagnosticadas por no-PDPCM (3,2% y 10,9%, respectivamente).
En la tabla 1 también se muestran los resultados de las asociaciones crudas y ajustadas según la vía diagnóstica. En el análisis bivariado se observa más riesgo de ser diagnosticadas por PDPCM en las mujeres de menor y mayor edad (ORc: 0,72, IC95%: 0,53-0,98, en 50-54 años; ORc: 0,54, IC95%: 0,38-0,75, en 65-69 años), y en las de renta familiar disponible media-alta (ORc: 0,67, IC95%: 0,47-0,96). En el modelo ajustado se mantiene el riesgo en los grupos de menor y mayor edad (ORa: 0,66, IC95%: 0,44-1,00, en 50-54 años; ORa: 0,35, IC95%: 0,35-0,89, en 65-69 años), y las mujeres de clase social baja presentan mayor riesgo de ser diagnosticadas por no-PDPCM (ORa:1,54; IC95%: 1,02-2,32). En cuanto a las características de los tumores, en el análisis bivariado se observó que los cánceres invasivos, los de mayor grado histológico, los de estadio más avanzado y los recidivantes tienen más probabilidades de ser diagnosticados por no-PDPCM que los cánceres in situ (ORc: 1,80; IC95%:1,29-2,50), los de grado histológico I (ORc: 1,77; IC95%: 1,28-2,45) y III (ORc: 2,93; IC95%: 1,96-4,37), los de estadio 0 (estadio I, ORc: 1,52, IC95%: 1,03-2,24; estadio II, ORc: 2,28, IC95%:1,49-3,49; estadio III, ORc: 3,64, IC95%: 1,94-6,83) y los no recidivantes (ORc: 3,64; IC95%: 1,94-6,83). En el análisis multivariante, el incremento del riesgo se concentra en los grados histológicos II (ORa: 1,60; IC95%: 1,07-2,38) y III (ORa: 2,18; IC95%: 1,31-3,63), el estadio III (ORa: 3,29; IC95%: 1,04-10,43) y la presencia de recidivas (ORa: 2,14; IC95%: 1,02-4,47).
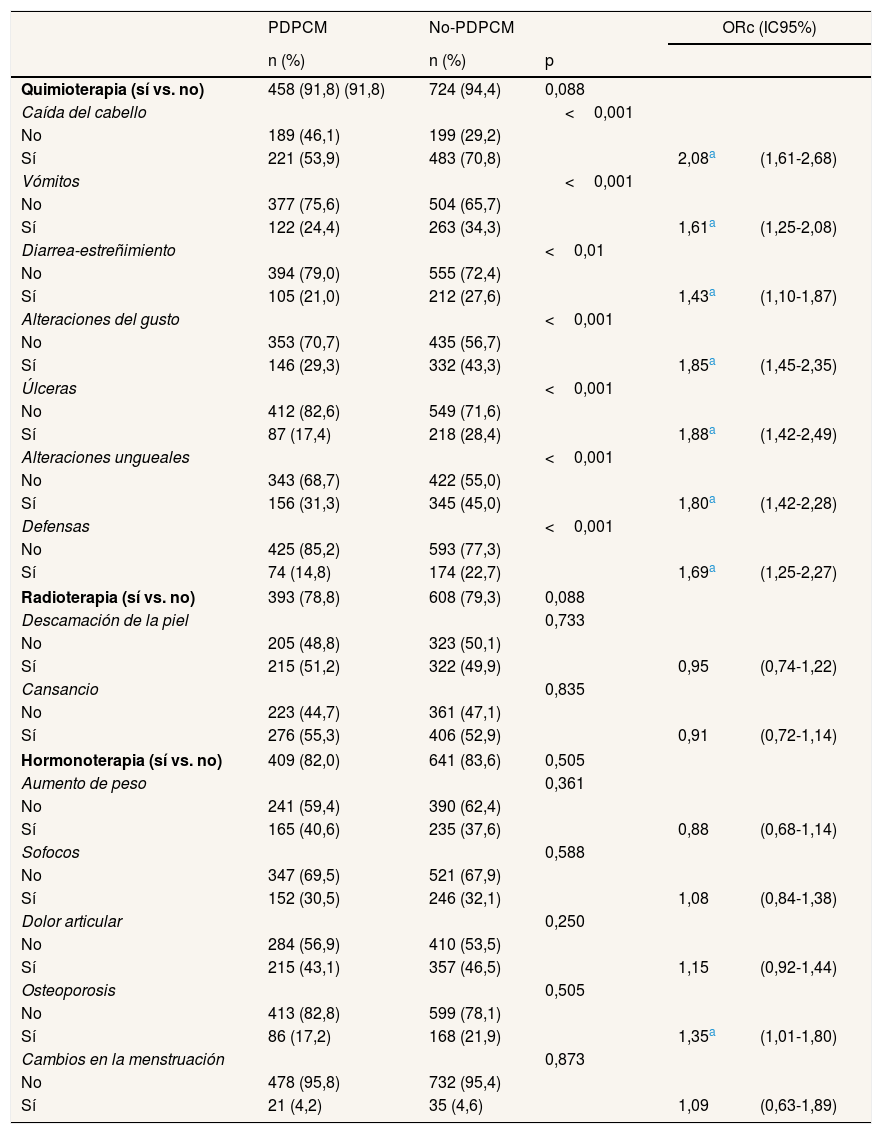
La tabla 2 muestra los efectos adversos de los tratamientos. Recibieron quimioterapia en algún momento a lo largo del proceso de tratamiento el 91,8% de las mujeres PDPCM y el 94,4% de las no-PDPCM. Se observaron diferencias en todos los efectos adversos estudiados, que siempre fueron más frecuentes en el grupo de mujeres no-PDPCM. Destaca la caída del cabello (70,8% en no-PDPCM vs. 53,9% en PDPCM), seguida de las alteraciones ungueales (45,0% vs. 31,3%) y las alteraciones en el sentido del gusto (43,3% vs. 29,3%). En el análisis bivariado se observó un mayor riesgo de presentar efectos adversos en el grupo no-PDPCM que en el grupo PDPCM. Los efectos adversos que presentaron mayor riesgo fueron la caída del cabello (ORc: 2,08; IC95%: 1,61-2,68), las úlceras en la cavidad oral (ORc: 1,88; IC95%: 1,42-2,49), las alteraciones en el sentido del gusto (ORc: 1,85; IC95%: 1,45-2,35) y las alteraciones ungueales (ORc: 1,80; IC95%: 1,42-2,28). En cuanto a la radioterapia, la recibieron 393 (78,8%) mujeres del grupo PDPCM y 608 (79,3%) mujeres del grupo no-PDPCM, y no se encontraron diferencias en las alteraciones cutáneas ni en el cansancio. Finalmente, recibieron hormonoterapia 409 (82,0%) mujeres del grupo PDPCM y 641 (83,6%) mujeres del grupo no-PDPCM, y el único efecto que mostró diferencias en el modelo univariado fue la presencia de osteoporosis en las mujeres no-PDPCM (ORc: 1,35; IC95%: 1,01-1,80).
Descripción y análisis de regresión logística univariado de las complicaciones y los efectos adversos de los tratamientos según el tipo de tratamiento y la vía de diagnóstico
| PDPCM | No-PDPCM | ORc (IC95%) | |||
|---|---|---|---|---|---|
| n (%) | n (%) | p | |||
| Quimioterapia (sí vs. no) | 458 (91,8) (91,8) | 724 (94,4) | 0,088 | ||
| Caída del cabello | <0,001 | ||||
| No | 189 (46,1) | 199 (29,2) | |||
| Sí | 221 (53,9) | 483 (70,8) | 2,08a | (1,61-2,68) | |
| Vómitos | <0,001 | ||||
| No | 377 (75,6) | 504 (65,7) | |||
| Sí | 122 (24,4) | 263 (34,3) | 1,61a | (1,25-2,08) | |
| Diarrea-estreñimiento | <0,01 | ||||
| No | 394 (79,0) | 555 (72,4) | |||
| Sí | 105 (21,0) | 212 (27,6) | 1,43a | (1,10-1,87) | |
| Alteraciones del gusto | <0,001 | ||||
| No | 353 (70,7) | 435 (56,7) | |||
| Sí | 146 (29,3) | 332 (43,3) | 1,85a | (1,45-2,35) | |
| Úlceras | <0,001 | ||||
| No | 412 (82,6) | 549 (71,6) | |||
| Sí | 87 (17,4) | 218 (28,4) | 1,88a | (1,42-2,49) | |
| Alteraciones ungueales | <0,001 | ||||
| No | 343 (68,7) | 422 (55,0) | |||
| Sí | 156 (31,3) | 345 (45,0) | 1,80a | (1,42-2,28) | |
| Defensas | <0,001 | ||||
| No | 425 (85,2) | 593 (77,3) | |||
| Sí | 74 (14,8) | 174 (22,7) | 1,69a | (1,25-2,27) | |
| Radioterapia (sí vs. no) | 393 (78,8) | 608 (79,3) | 0,088 | ||
| Descamación de la piel | 0,733 | ||||
| No | 205 (48,8) | 323 (50,1) | |||
| Sí | 215 (51,2) | 322 (49,9) | 0,95 | (0,74-1,22) | |
| Cansancio | 0,835 | ||||
| No | 223 (44,7) | 361 (47,1) | |||
| Sí | 276 (55,3) | 406 (52,9) | 0,91 | (0,72-1,14) | |
| Hormonoterapia (sí vs. no) | 409 (82,0) | 641 (83,6) | 0,505 | ||
| Aumento de peso | 0,361 | ||||
| No | 241 (59,4) | 390 (62,4) | |||
| Sí | 165 (40,6) | 235 (37,6) | 0,88 | (0,68-1,14) | |
| Sofocos | 0,588 | ||||
| No | 347 (69,5) | 521 (67,9) | |||
| Sí | 152 (30,5) | 246 (32,1) | 1,08 | (0,84-1,38) | |
| Dolor articular | 0,250 | ||||
| No | 284 (56,9) | 410 (53,5) | |||
| Sí | 215 (43,1) | 357 (46,5) | 1,15 | (0,92-1,44) | |
| Osteoporosis | 0,505 | ||||
| No | 413 (82,8) | 599 (78,1) | |||
| Sí | 86 (17,2) | 168 (21,9) | 1,35a | (1,01-1,80) | |
| Cambios en la menstruación | 0,873 | ||||
| No | 478 (95,8) | 732 (95,4) | |||
| Sí | 21 (4,2) | 35 (4,6) | 1,09 | (0,63-1,89) | |
IC95%: intervalo de confianza del 95%; No-PDPCM: revisión habitual por su médico, por acudir tras notarse un bulto, por seguimiento clínico de factores de riesgo, u otras formas de diagnóstico por signos o síntomas; ORc: odds ratio cruda; PDPCM: programa de detección precoz de cáncer de mama.
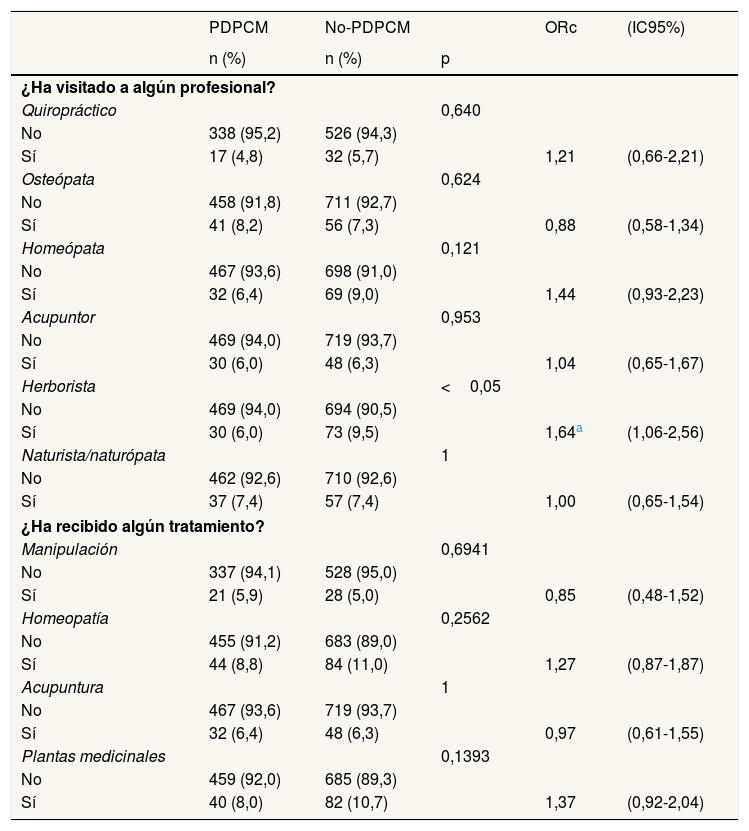
Respecto a las terapias no convencionales, las mujeres del grupo no-PDPCM visitaron con mayor frecuencia al herborista (9,5%) y al homeópata (9,0%), con diferencias significativas para el herborista (ORc: 1,64; IC95%: 1,06-2,56). En cuanto al tipo de terapias no convencionales, no se observan diferencias en ninguna de ellas, pero la más frecuente en ambos grupos es la homeopatía (8,8% en PDPCM y 11,0% en no-PDPCM), seguida por las plantas medicinales (8,0% y 10,7%, respectivamente) referidas a la herbolaria en general (tabla 3).
Descripción y análisis de regresión logística multivariado de las terapias no convencionales y de su realización según la vía de diagnóstico
| PDPCM | No-PDPCM | ORc | (IC95%) | ||
|---|---|---|---|---|---|
| n (%) | n (%) | p | |||
| ¿Ha visitado a algún profesional? | |||||
| Quiropráctico | 0,640 | ||||
| No | 338 (95,2) | 526 (94,3) | |||
| Sí | 17 (4,8) | 32 (5,7) | 1,21 | (0,66-2,21) | |
| Osteópata | 0,624 | ||||
| No | 458 (91,8) | 711 (92,7) | |||
| Sí | 41 (8,2) | 56 (7,3) | 0,88 | (0,58-1,34) | |
| Homeópata | 0,121 | ||||
| No | 467 (93,6) | 698 (91,0) | |||
| Sí | 32 (6,4) | 69 (9,0) | 1,44 | (0,93-2,23) | |
| Acupuntor | 0,953 | ||||
| No | 469 (94,0) | 719 (93,7) | |||
| Sí | 30 (6,0) | 48 (6,3) | 1,04 | (0,65-1,67) | |
| Herborista | <0,05 | ||||
| No | 469 (94,0) | 694 (90,5) | |||
| Sí | 30 (6,0) | 73 (9,5) | 1,64a | (1,06-2,56) | |
| Naturista/naturópata | 1 | ||||
| No | 462 (92,6) | 710 (92,6) | |||
| Sí | 37 (7,4) | 57 (7,4) | 1,00 | (0,65-1,54) | |
| ¿Ha recibido algún tratamiento? | |||||
| Manipulación | 0,6941 | ||||
| No | 337 (94,1) | 528 (95,0) | |||
| Sí | 21 (5,9) | 28 (5,0) | 0,85 | (0,48-1,52) | |
| Homeopatía | 0,2562 | ||||
| No | 455 (91,2) | 683 (89,0) | |||
| Sí | 44 (8,8) | 84 (11,0) | 1,27 | (0,87-1,87) | |
| Acupuntura | 1 | ||||
| No | 467 (93,6) | 719 (93,7) | |||
| Sí | 32 (6,4) | 48 (6,3) | 0,97 | (0,61-1,55) | |
| Plantas medicinales | 0,1393 | ||||
| No | 459 (92,0) | 685 (89,3) | |||
| Sí | 40 (8,0) | 82 (10,7) | 1,37 | (0,92-2,04) | |
IC95%: intervalo de confianza del 95%; No-PDPCM: revisión habitual por su médico, por acudir tras notarse un bulto, por seguimiento clínico de factores de riesgo, u otras formas de diagnóstico por signos o síntomas; ORc: odds ratio cruda; PDPCM: programa de detección precoz de cáncer de mama.
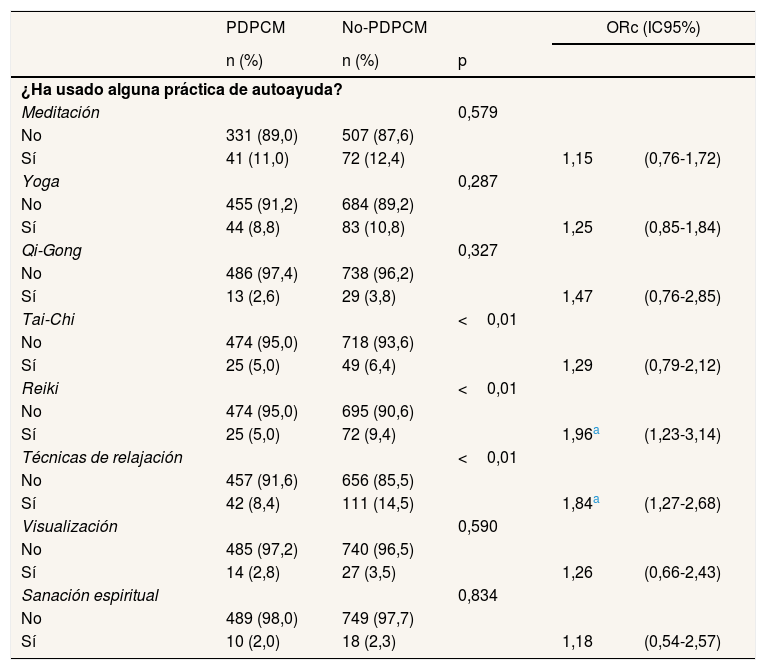
En cuanto a la autoayuda, se observaron diferencias en Tai Chi, Reiki y las técnicas de relajación, siendo las mujeres del grupo no-PDPCM las que más las utilizaron. En el análisis bivariado, esta relación es significativa para el Reiki (ORc: 1,96; IC95%: 1,23-3,14) y las técnicas de relajación (ORc: 1,84; IC95%: 1,27-2,68) (tabla 4).
Descripción y análisis de regresión logística multivariado del uso de terapias de autoayuda según la vía de diagnóstico
| PDPCM | No-PDPCM | ORc (IC95%) | |||
|---|---|---|---|---|---|
| n (%) | n (%) | p | |||
| ¿Ha usado alguna práctica de autoayuda? | |||||
| Meditación | 0,579 | ||||
| No | 331 (89,0) | 507 (87,6) | |||
| Sí | 41 (11,0) | 72 (12,4) | 1,15 | (0,76-1,72) | |
| Yoga | 0,287 | ||||
| No | 455 (91,2) | 684 (89,2) | |||
| Sí | 44 (8,8) | 83 (10,8) | 1,25 | (0,85-1,84) | |
| Qi-Gong | 0,327 | ||||
| No | 486 (97,4) | 738 (96,2) | |||
| Sí | 13 (2,6) | 29 (3,8) | 1,47 | (0,76-2,85) | |
| Tai-Chi | <0,01 | ||||
| No | 474 (95,0) | 718 (93,6) | |||
| Sí | 25 (5,0) | 49 (6,4) | 1,29 | (0,79-2,12) | |
| Reiki | <0,01 | ||||
| No | 474 (95,0) | 695 (90,6) | |||
| Sí | 25 (5,0) | 72 (9,4) | 1,96a | (1,23-3,14) | |
| Técnicas de relajación | <0,01 | ||||
| No | 457 (91,6) | 656 (85,5) | |||
| Sí | 42 (8,4) | 111 (14,5) | 1,84a | (1,27-2,68) | |
| Visualización | 0,590 | ||||
| No | 485 (97,2) | 740 (96,5) | |||
| Sí | 14 (2,8) | 27 (3,5) | 1,26 | (0,66-2,43) | |
| Sanación espiritual | 0,834 | ||||
| No | 489 (98,0) | 749 (97,7) | |||
| Sí | 10 (2,0) | 18 (2,3) | 1,18 | (0,54-2,57) | |
IC95%: intervalo de confianza del 95%; No-PDPCM: revisión habitual por su médico, por acudir tras notarse un bulto, por seguimiento clínico de factores de riesgo, u otras formas de diagnóstico por signos o síntomas; ORc: odds ratio cruda; PDPCM: programa de detección precoz de cáncer de mama.
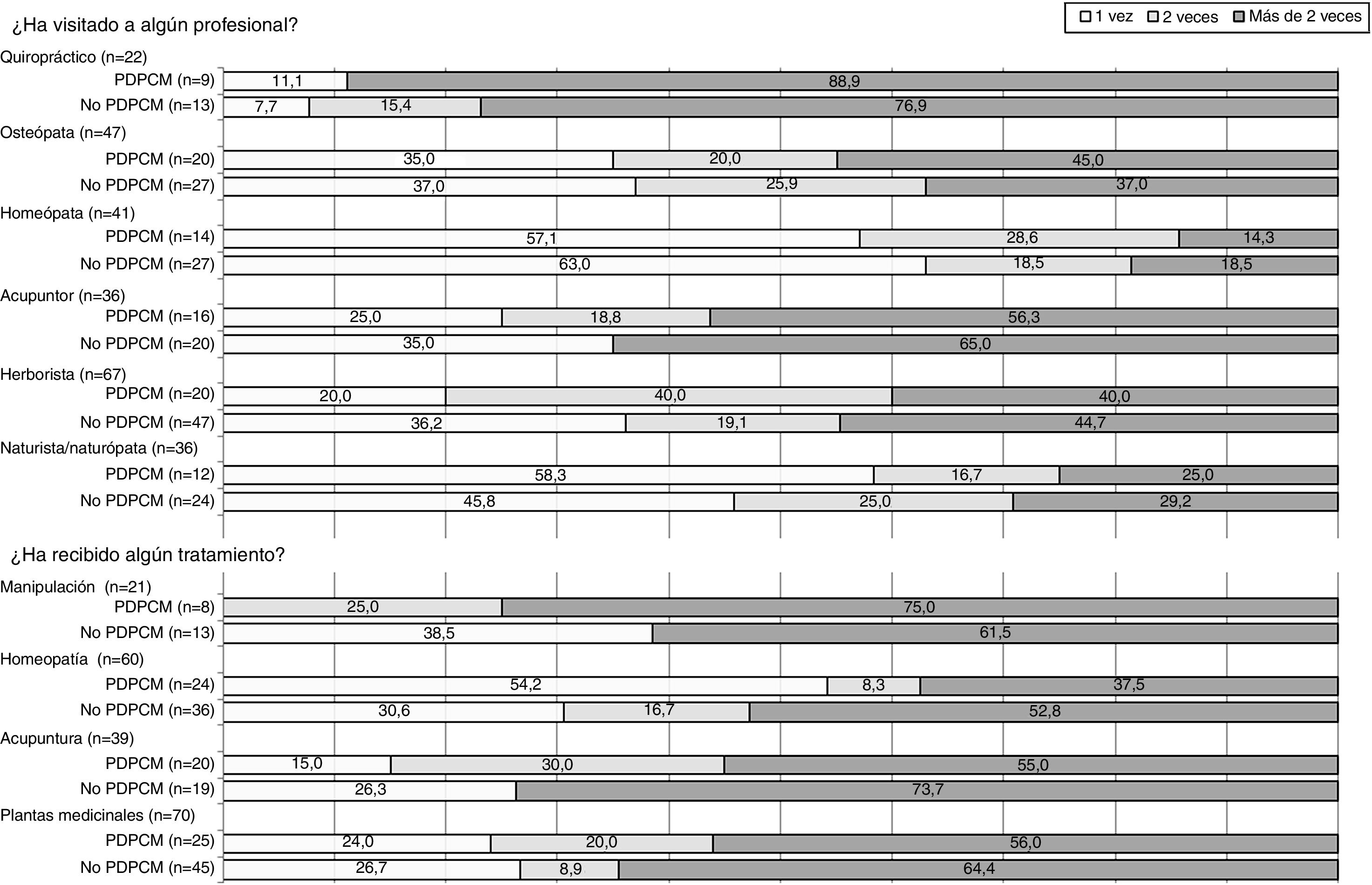
En la figura 1 se representa gráficamente la frecuentación de profesionales de terapias no convencionales y los tratamientos recibidos según la vía de diagnóstico. El profesional con mayor frecuentación fue el herborista (n=67), mientras que los que muestran más reiteración de visitas son los quiroprácticos, seguidos de los acupuntores.
Representación gráfica de la frecuentación de visitas de profesionales y de la realización de terapias no convencionales según la vía de diagnóstico del cáncer de mama. No-PDPCM: revisión habitual por su médico, por acudir tras notarse un bulto, por seguimiento clínico de factores de riesgo, u otras formas de diagnóstico por signos o síntomas; PDPCM: programa de detección precoz de cáncer de mama.
En cuanto a la frecuentación, más del 50% de las mujeres que usaron terapias no convencionales lo hicieron más de dos veces.
Como puede observarse en la figura 2, las terapias de autoayuda suelen presentar una frecuentación alta, y destacan la meditación, el Qui-gong, el Tai-chi y el yoga. Se observan pequeñas diferencias según el método diagnóstico: el grupo PDPCM frecuenta más la meditación y el Qui-gong, mientras que en el grupo no-PDPCM predomina el Tai-chi.
Representación gráfica de la frecuentación de uso de terapias de autoayuda según la vía de diagnóstico del cáncer de mama. No-PDPCM: revisión habitual por su médico, por acudir tras notarse un bulto, por seguimiento clínico de factores de riesgo, u otras formas de diagnóstico por signos o síntomas; PDPCM: programa de detección precoz de cáncer de mama.
El principal hallazgo de este estudio es que las mujeres de la Cohorte DAMA diagnosticadas en los PDPCM presentan tumores más diferenciados y en estadios menos evolucionados. Por otro lado, los tratamientos asociados a las mujeres diagnosticadas en los PDPCM presentan menos efectos adversos, y las mujeres recurren menos a terapias no convencionales.
Los PDPCM invitan a todas las mujeres y favorecen la equidad. Las mujeres se controlan más19 y se contribuye a la disminución de las desigualdades20,21. Factores como el nivel de conocimientos en salud, la presión del tiempo para acudir a la mamografía, los problemas de transporte o la incomodidad para interactuar con los profesionales sanitarios pueden explicar las diferencias entre el nivel socioeconómico y la participación22,23. No obstante, las mujeres de estatus socioeconómico más alto siguen siendo las que más se controlan de manera regular. En nuestro estudio se demuestra que el menor estatus socioeconómico es un factor de riesgo para el cáncer de mama, independientemente de la vía diagnóstica.
Los resultados obtenidos respecto al grado de diferenciación de los tumores coinciden con los publicados por Salvadó et al.24 en que los detectados mediante PDPCM son bien diferenciados. De la misma forma, presentan más ductales in situ y en estadios iniciales, con un menor porcentaje de recidivas24,25. Detectar tumores no invasivos se considera un factor predictivo de la supervivencia, probablemente determinado por el grado de agresividad biológica del tumor. Por otra parte, la detección en un estadio inicial, calculado mediante la clasificación TNM, es un indicador de probabilidad de recidiva a largo plazo y de supervivencia26,27.
Una de las aportaciones de los PDPCM es un manejo menos agresivo en estadios precoces28. La cirugía conservadora asociada a tratamientos locales con radioterapia, y a tratamientos sistémicos con quimioterapia y hormonoterapia dependiendo de las características del tumor, está sustituyendo a la cirugía radical. El mayor porcentaje observado de radioterapia en las mujeres diagnosticadas en PDPCM corresponde a la realizada después de la cirugía conservadora en los estadios I y II. Esta asociación ha demostrado una reducción del riesgo de recaída locorregional y de enfermedad a distancia, y un aumento de la supervivencia global29,30.
La correlación entre el estadio del tumor, el tipo de cirugía y los efectos adversos se observa en nuestro estudio y también en la bibliografía consultada. El grupo PDPCM, probablemente debido a la menor agresividad de los tratamientos, presentó menos efectos adversos de la quimioterapia y menos osteoporosis derivada de la hormonoterapia.
Aunque las cifras reportadas por un estudio que incluyó 11 países de Europa indican una prevalencia del uso de terapias no convencionales en las mujeres con cáncer de mama del 44,7%31, otros estudios más recientes muestran prevalencias que van del 62,9% en Alemania32 al 86,1% en los Estados Unidos33, siendo especialmente frecuente en los tumores en estadio avanzado34. Analizando nuestros resultados vemos que también existe correlación entre la agresividad del tumor y la frecuentación de los diferentes profesionales de terapias no convencionales, especialmente de los herboristas.
En cuanto al tratamiento ofrecido por los herboristas, los principales motivos de consulta son para que se les recomienden plantas para reforzar el sistema inmunitario, inhibir el crecimiento de tumores o combatir el cansancio35. Resulta lógico pensar que sean las mujeres diagnosticadas fuera de los PDPCM, que presentan estadios más avanzados y más efectos adversos, las que más utilizan las terapias no convencionales.
Respecto a las limitaciones del estudio, cabe mencionar un sesgo de selección debido a que las mujeres fueron reclutadas de hospitales públicos y no es posible garantizar la representatividad de la muestra. Aun así, los hospitales participantes son los más importantes de Barcelona y los que atienden la mayor proporción de casos. La información de la cohorte fue en su mayoría autorreportada, con la posible presencia de un sesgo de información. Y una última limitación es que los datos presentados corresponden a un corte transversal, por lo que no permiten establecer causalidad.
En conclusión, la implantación de los PDPCM ha demostrado tener un impacto significativo en la detección de tumores en estadios iniciales, lo que proporciona a las pacientes mayores posibilidades de acceder a tratamientos más conservadores y, por lo tanto, con efectos adversos de menor impacto en su vida, lo que se traduce en una menor necesidad de recurrir a terapias no convencionales en comparación con las mujeres que presentan tumores más agresivos.
Las principales vías diagnósticas son los programas de detección precoz y la asistencia sanitaria habitual. Los tratamientos a las pacientes con cáncer de mama causan efectos adversos, que dependerán del tipo, la dosis y la duración de la terapia. No hay evidencia de la eficacia y se desconocen los peligros de las medicinas no convencionales, pero se utilizan cada vez más para paliar los efectos adversos de los tratamientos.
¿Qué añade el estudio realizado a la literatura?El 40% de los cánceres de mama se diagnostican en programas de detección precoz. Las pacientes son de mayor edad y de clase social más alta, y los cánceres son más diferenciados. Los tratamientos son más conservadores y presentan menos efectos adversos. Existe una correlación entre los efectos adversos y la frecuentación a las medicinas no convencionales, en especial de herbolario. La proliferación y la aceptación de las medicinas no convencionales, junto con la escasa evidencia en el mundo occidental sobre sus efectos, hacen necesarios más estudios sobre las medicinas y las prácticas no convencionales utilizadas por las mujeres con cáncer de mama.
Mercedes Carrasco Portiño.
Declaración de transparenciaLa autora principal (garante responsable del manuscrito) afirma que este manuscrito es un reporte honesto, preciso y transparente del estudio que se remite a Gaceta Sanitaria, que no se han omitido aspectos importantes del estudio, y que las discrepancias del estudio según lo previsto (y, si son relevantes, registradas) se han explicado.
Contribuciones de autoríaJ. Grau, investigador de la Cohorte DAMA y coordinador de los programas de detección precoz del Hospital Clínic, diseñó el estudio. I. Torá, estadística y data manager de los programas de detección precoz, junto con B. Oliver, estudiante de último curso del grado de Medicina, han trabajado activamente en el análisis de los datos. Los tres participaron en la búsqueda bibliográfica, el análisis de los resultados y la redacción de los distintos borradores del manuscrito. X. Bargalló es investigador de la Cohorte DAMA y responsable del cribado de cáncer de mama por la parte del diagnóstico por la imagen; ha contribuido en la redacción del manuscrito y la selección de las variables de estudio en cuanto a las terapias no convencionales. M. Aldea es la responsable del programa de cribado de cáncer de mama del Hospital Clínic; ha revisado y contribuido en la redacción del manuscrito. R. Puigpinós-Riera es la investigadora principal del Proyecto DAMA; ha revisado y contribuido en las distintas versiones del manuscrito, y participó en la selección de las variables necesarias para llevar a cabo el estudio. Los miembros del Grupo de trabajo Cohorte DAMA participan aportando los datos de sus respectivos hospitales y con lecturas críticas de los manuscritos y trabajos diversos que emanan de los resultados obtenidos del estudio.
AgradecimientosAl Grupo Cohorte DAMA: Xavier Bargalló (Hospital Clínic de Barcelona), Montserrat Domènech (Asociación de Mujeres con Cáncer de Mama [Ágata]), Martín Espinosa-Bravo (Hospital Universitari Vall d’Hebron), Jaume Grau (Hospital Clínic de Barcelona), Francesc Macià (Parc de Salut Mar, Institut Municipal d’Investigacions Mèdiques [IMIM]), Rafael Manzanera (MC Mutual Mèdica), Margarida Pla (Universitat de Barcelona), Rosa Puigpinós-Riera (Agència de Salut Pública de Barcelona, CIBER de Epidemiología y Salud Pública [CIBERESP]), Institut de Recerca Sant Pau [IIB Sant Pau]); M. Jesús Quintana (CIBERESP; IIB Saint. Pau; Hospital de la Sta. Creu i Sant Pau), Maria Sala (IMIM; Universitat Autònoma de Barcelona; Red de Investigación en Servicios de Salud); y Eulàlia Vidal (Facultat de Ciències de la Salut Blanquerna - Universitat Ramón Llull).
FinanciaciónMinisterio de Sanidad, Instituto de Salud Carlos III - Subdirección General de Evaluación y Fomento de la Investigación, Plan Estatal de Investigación Científica y Técnica y de Innovación 2013-2016, cofinanciado por el Fondo Europeo de Desarrollo Regional (FEDER), número de proyecto PI13/01977.
Conflicto de interesesNinguno.