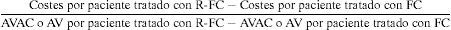Evaluar el coste-efectividad del esquema de rituximab, fludarabina y ciclofosfamida (R-FC) en comparación con el de fludarabina y ciclofosfamida (FC) en dos tipos de pacientes con leucemia linfática crónica (LLC): no tratados previamente o bien en recidiva/resistentes al tratamiento previo.
MétodosDos modelos de Markov, utilizando los resultados publicados de superviviencia libre de progresión (SLP) de pacientes con LLC tratados con R-FC o FC en primera o segunda línea, las tasas de progresión de la enfermedad y las tasas de mortalidad en España. A los estados de SLP y progresión se les asignaron utilidades obtenidas en un estudio sobre LLC. Los costes de los medicamentos y de los tratamientos de soporte, así como los años de vida ajustados por calidad (AVAC), se estimaron para un periodo de 10 años. Se efectuaron análisis de sensibilidad univariados y probabilísticos (Monte Carlo).
ResultadosLa adición de rituximab a la quimioterapia con FC aumentó los años de vida ganados (AVG) y los AVAC tanto en primera como en segunda línea de tratamiento. La razón de coste-eficacia incremental fue de 20.703 € por AVG y de 19.343 € por AVAC con la primera línea de tratamiento, y de 23.183 € por AVG y 24.781 € por AVAC con la segunda línea de tratamiento.
ConclusionesEn los pacientes con LLC no tratados previamente y en aquellos en recaída o resistentes al tratamiento previo, la adición de rituximab al esquema FC aumentó la esperanza de vida y los AVAC, y en ambos casos resultó ser un tratamiento coste-efectivo.
We evaluated the cost-effectiveness of rituximab added to the chemotherapy regimen of fludarabine plus cyclophosphamide (R-FC) versus fludarabine plus cyclophosphamide (FC) for the treatment of patients with previously untreated or relapsed/refractory chronic lymphocytic leukemia (CLL).
MethodsTwo Markov models were built, using published results on progression-free survival (PFS) in patients receiving first- or second-line therapy with R-FC vs FC, rates of disease progression and mortality rates in Spain. Patient-elicited utilities were applied to PFS and progressed health states. The cost of drugs, supportive care, and quality-adjusted life years (QALY) were estimated over a 10-year period. Univariate and probabilistic (Monte Carlo) sensitivity analyses were performed.
ResultsThe addition of rituximab to chemotherapy in first- and second-line therapy increased life-years gained (LYG) and QALYs compared with chemotherapy. The incremental cost per LYG and QALY gained was €20,703 and €19,343 for first-line treatment and was €23,183 and €24,781 for second-line treatment.
ConclusionIn patients with previously untreated or relapsed/refractory CLL, the addition of rituximab to the FC regimen increased life expectancy and quality-adjusted life expectancy. In both types of patient, the treatment was cost-effective.
La leucemia linfática crónica (LLC) es la forma más frecuente de leucemia en España. Según el Registro Español de Leucemias, la LLC constituye el 25,6% de todos los diagnósticos de leucemia1 y tiene una incidencia de 4,2 (intervalo de confianza del 95% [IC 95%]: 3,3-5,1) y 3,1 (IC 95%: 2,3-3,8) casos por 100.000 habitantes y año, en hombres y mujeres, respectivamente2. La edad media de los enfermos en el momento del diagnóstico es de 72 años3. La LLC es rara en los menores de 50 años (15% a 20% de todos los casos de LLC)4.
El curso clínico de los pacientes con LLC se caracteriza por una secuencia continua de respuestas al tratamiento y recaídas, con un acortamiento de la supervivencia libre de progresión (SLP) a lo largo de los ciclos. El pronóstico de los pacientes con fracaso de los tratamientos más activos es bastante pobre, con una mediana de supervivencia de 10 meses5.
De acuerdo con las recientes recomendaciones de la Asociación Andaluza de Hematología y Hemoterapia (AAHH)6, en los estadios iniciales de la enfermedad, o con enfermedad avanzada pero sin criterios de LLC activa, el tratamiento estándar consiste en la estrategia de «ver y esperar», realizando controles sanguíneos y exploraciones clínicas periódicas. El tratamiento farmacológico se recomienda sólo en los pacientes con enfermedad activa, definida por los criterios del National Cancer Institute, independientemente del estadio de la enfermedad. En estos casos se recomienda como tratamiento estándar de primera línea el esquema R-FC (combinación de fludarabina, ciclofosfamida y rituximab) en los pacientes menores de 70 años, sin deleción/mutación de p53 y con comorbilidad, o bien fludarabina en monoterapia o en combinación con ciclofosfamida (FC) en los mayores de 70 años, sin comorbilidad. Respecto al tratamiento de segunda línea, el esquema R-FC se recomienda en los casos de recaída precoz (antes de 12 meses)6.
Durante los últimos años, la introducción de una nueva opción terapéutica, la inmunoterapia con anticuerpos monoclonales, ha permitido aumentar la especificidad del tratamiento, reducir la toxicidad y además conseguir sinergia con la quimioterapia convencional debido a su distinto mecanismo de acción7.
El rituximab está indicado en combinación con quimioterapia en el tratamiento de los pacientes con LLC que no hayan sido tratados previamente o que estén en recidiva o sean resistentes a un tratamiento previo8.
El objetivo de este estudio fue evaluar el coste-efectividad del rituximab en combinación con FC (R-FC) frente a FC como tratamiento de primera línea (pacientes no tratados previamente) y de segunda línea (en recidiva o resistentes a un tratamiento previo) en pacientes con LLC, desde la perspectiva del Sistema Nacional de Salud (SNS).
MétodosModelo farmacoeconómicoEl estudio consistió en dos modelos farmacoeconómicos similares, que permiten la evaluación del coste-efectividad del rituximab en combinación con FC (R-FC) frente a FC en el tratamiento de primera y segunda línea en pacientes con LLC. Estos modelos se entienden como esquemas teóricos que permiten hacer simulaciones de procesos sanitarios complejos relacionados con medicamentos, y que se elaboran mediante estimaciones a partir de los datos disponibles de eficacia, toxicidad y costes de las opciones comparadas9. Para ello se adaptaron al entorno sanitario español dos modelos de Markov10,11, con una estructura que se representa en la figura 1 y que se describe en detalle más adelante, con modelos desarrollados en Excel®10,11.
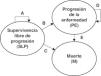
Modelo de Markov de la leucemia linfática crónica con tres estados. Transiciones entre los estados durante un ciclo de Markov: A) probabilidad de permanecer en el estado de SLP (obtenida a partir de una curva de Weibull); B) probabilidad de transitar al estado de PE (= 1 – A − C); C) probabilidad de morir por todas las causas (obtenida de las tablas de mortalidad en España, así como de la mortalidad observada en el ensayo clínico a partir de SLP); D) probabilidad de permanecer en el estado de PE (= 1 − E); E) probabilidad de morir (por el aumento de la mortalidad debido a la progresión) una vez el paciente ha transitado al estado de PE (obtenida del ensayo clínico). M: muerte; PE: progresión de la enfermedad; SLP: supervivencia libre de progresión.
En los modelos se consideraron, según la evolución de la LLC, los siguientes estados de salud (figura 1): dos estados «transitorios» (supervivencia libre de progresión [SLP] y progresión de la enfermedad [PE]) en los cuales los pacientes podrían permanecer varios ciclos de Markov de 1 mes de duración, y el denominado estado «absorbente» (la muerte [M] de los pacientes).
Todos los pacientes de una cohorte teórica estarían inicialmente libres de progresión. A lo largo de los ciclos mensuales, los pacientes pueden seguir en ese estado (SLP) o bien transitar a los otros dos (PE y M); una vez se produce la progresión, el paciente puede permanecer en ese estado (PE) o morir (M).
El objetivo de ambos modelos fue estimar las diferencias entre las opciones terapéuticas (R-FC o FC) comparadas, en cuanto a: 1) los años de vida ajustados por calidad (AVAC) ganados con el tratamiento más efectivo; 2) los años de vida sin ajustar por calidad ganados (AVG) con el tratamiento más efectivo; 3) los costes asociados a los estados SLP y PE con uno u otro esquema de tratamiento; y 4) el coste de ganar un AVAC o un AVG con el tratamiento más efectivo. No se consideraron los costes debidos a la muerte (M).
El modelo de Markov del tratamiento de primera línea es del tipo denominado «área bajo la curva»12, ya que utilizó los datos de supervivencia global (con diferencias estadísticamente significativas entre ambos esquemas)13 y de SLP.
Premisas y asunciones de los modelosEn ambos modelos se asumió una serie de premisas sobre las características de los pacientes, los esquemas de tratamiento y la utilización de los recursos sanitarios, que se resumen en la tabla 1.
Principales premisas y asunciones tomadas en el análisis farmacoeconómico, realizado mediante un modelo de Markov
| Ítem | Ref. |
| 1. Estados de salud del modelo: SLP, PE, M (figura 1) | 10,11 |
| 2. Pacientes con LLC que inicien tratamiento de primera o segunda línea (en recaída o resistentes) | - |
| 3. Pauta de R-FC: ciclo 1, 375 mg/m2 de R en infusión i.v., el día 1; 25 mg/m2 de F i.v. y 250 mg/m2 de C i.v. los días 2-4.Ciclos 2-6, 500 mg/m2 de R en infusión i.v., el día 1; 25 mg/m2 de F i.v. y 250 mg/m2 de C i.v. los días 1-3. Ciclos cada 28 días. | 12,13 |
| 4. Pauta de FC: ciclos 1-6, 25 mg/m2 de F i.v. y 250 mg/m2 de C i.v. los días 1-3. Ciclos cada 28 días. | 12,13 |
| 5. Resultados del ensayo clínico ML17102 (CLL-8) (mediana de seguimiento: 3 años) por intención de tratar: | 12 |
| Ítem | R-FC (N=408) | FC (N=409) |
| SLP (%) | 65% | 45% |
| Mediana de SLP (meses) | 51,8 | 32,8 |
| p (Log-rank test) | <0,0001 | |
| Hazard ratio (IC 95%) | 0,56 (0,46-0,69) | |
| SG (%) | 87% | 83% |
| Hazard ratio (IC 95%) | 0,67 (0,48-0,92) | |
| p | 0,012 | |
| 6. Resultados del ensayo clínico BO17072 (REACH) (mediana de seguimiento: 25,3 meses) por intención de tratar | 13 |
| Ítem | R-FC (N=276) | FC (N=276) |
| Media de SLP (meses) | 32,93 (± 1,38) | 25,03 (± 1,21) |
| Mediana de SLP (meses) | 29,8 | 20,6 |
| p (Log-rank test) | 0,0002 | |
| Hazard ratio (IC 95%) | 0,673 (0,528-0,857) | |
| Pacientes analizados para supervivenciaMedia de SG (meses) | 276 (77,54%)41,58 (± 1,05) | 276 (75,36%)40,45 (± 1,16) |
| p (Log-rank test) | 0,2874 |
| 7. Duración del ciclo de transición: mensual, con corrección de medio ciclo | 10,11 |
| 8. Horizonte temporal del análisis: 10 años, según la mediana de supervivencia (5-15 años)a | 3 |
| 9. Modelo de Weibull para la extrapolación de la permanencia en SLP o la transición a PE o M,en el horizonte temporal (cálculo de las probabilidades de transición) | 14 |
| 10. Mortalidad por todas las causas en España (año 2006, http://www.mortality.org) | - |
| 11. Modelo de Kaplan-Meier para estimar la mortalidad a largo plazo desde el estado de PE | 10 |
| 12. Utilidades de los estados: SLP: 0,80; PE: 0,60 (ambos: distribución beta) | 15 |
| 13. Perspectiva del análisis: Sistema Nacional de Salud | - |
| 14. Coste de la administración: proporcional a la duración de la infusión i.v. en el hospital de día | - |
| 15. Coste de los efectos adversos de los tratamientos: según la frecuencia observada en los ensayos clínicos | 12,13 |
| 16. Seguimiento del paciente en el estado SLP: un análisis de sangre completo, con recuento; una exploración de ganglios, hígado y bazo | 6 |
| 17. Coste del tratamiento posterior a la progresión, de las transfusiones sanguíneas y de los trasplantes de médula ósea:según lo observado en los ensayos clínicos | 12,13,22 |
| 18. Tasas anuales de descuento para costes y utilidades: 3,5% (1,5-6,0%)a | 23 |
FC: fludarabina y ciclofosfamida; IC 95%: intervalo de confianza del 95%; LLC: leucemia linfática crónica; M: muerte; N: número de pacientes; PE: progresión de la enfermedad; R-FC: rituximab, fludarabina y ciclofosfamida; SG: supervivencia global; SLP: supervivencia libre de progresión.
Representa el conjunto hipotético de pacientes en quienes se realiza el análisis teórico, y por tanto la población a la cual pueden aplicarse los resultados del estudio. La población diana fueron, en un caso, aquellos pacientes de ambos sexos con diagnóstico de LLC que inician un tratamiento de primera línea, y en el otro caso los que han sido tratados previamente e inician un tratamiento de segunda línea.
Tipo de análisisLos datos clínicos del modelo proceden de dos ensayos diferentes en función de la línea de tratamiento evaluada. Para la primera línea de tratamiento se utilizaron los datos del ensayo clínico de fase III (ML17102 o CLL-8)13 que comparó los esquemas R-FC y FC en pacientes con LLC no tratados previamente. En este estudio se observó que el esquema R-FC aumenta la supervivencia libre de progresión, con un hazard ratio (HR) de 0,56 (IC 95%: 0,46-0,69) (tabla 1). Por otra parte, los datos clínicos de los pacientes tratados en segunda línea (en recaída/resistencia) incluidos en el modelo proceden del estudio BO17072 o REACH14, cuyo objetivo primario también evalúa la SLP. En este estudio se observa que el tratamiento con R-FC produce un incremento significativo de la SLP respecto a FC, con un HR de 0,673 (IC 95%: 0,528-0,857) (tabla 1). Las diferencias constatadas en ambos estudios podrían repercutir tanto en la cantidad como en la calidad de vida, y por tanto en los AVAC, por lo cual se hizo un análisis de coste-utilidad.
Horizonte temporal y probabilidades de transiciónEl horizonte temporal (la duración de la simulación) del caso base fue de 10 años, tanto para el modelo de primera línea de tratamiento como para el de segunda línea; en ambos casos dicho horizonte corresponde a la mediana de supervivencia de la LLC4.
Las probabilidades de transición entre los estados de Markov son dinámicas (cambian en cada ciclo de Markov) y están basadas en los resultados de ambos ensayos clínicos13,14. La mediana del seguimiento de los pacientes del ensayo clínico en primera línea fue de 3 años13 y en el de segunda línea de 25 meses14. Por este motivo, para extrapolar los resultados de SLP del ensayo clínico hasta el horizonte temporal fijado se utilizó una función de Weibull15.
Presentación de los resultadosLa comparación de los resultados incrementales de coste-utilidad se efectuó aplicando la fórmula siguiente:
Los resultados se presentan como costes incrementales, como AVAC ganado y como AVG, como coste por AVAC ganado (coste-utilidad) y como coste por AVG con el esquema con R-FC, en comparación con FC.
Estimación de las utilidadesEl tiempo que cada paciente permanece en uno u otro estado de Markov fue valorado en términos de utilidades para calcular la calidad de vida del paciente y estimar los AVAC, siendo un AVAC un año de vida multiplicado por un factor de ponderación que indica la calidad de vida de la persona durante ese año. El «peso» o factor de ponderación de la calidad de un año de vida puede ir desde el valor 0 (la muerte o un estado equivalente) hasta el valor 1 (que indica la salud perfecta). Las utilidades empleadas en el modelo para los estados SLP y PE (tabla 1) se tomaron de un informe de evaluación de la LLC realizado en Reino Unido16.
Perspectiva del análisisEl estudio se hizo desde la perspectiva del SNS, considerando únicamente los costes directos sanitarios hospitalarios relacionados con la enfermedad.
Estimación de los costesSe estimaron los costes medios para un paciente tipo con LLC que recibe tratamiento de primera línea y para un paciente que ha sido tratado previamente (segunda línea). Los costes de los recursos sanitarios utilizados en el modelo se presentan en euros (€) del año 2010 (tabla 2).
Costes unitarios de los recursos sanitarios (euros de 2010) empleados en el modelo farmacoeconómico
| Recurso (cantidad) | Coste (€) | Ref. |
| Fármacosa | ||
| Rituximab (2 viales de 100mg) | 579,83 | 16 |
| Rituximab (1 vial de 500mg) | 1.355,03 | 16 |
| Ciclofosfamida (1 vial de 200mg) | 2,44 | 16 |
| Fludarabina (1 vial de 50mg) | 106,95 | 16 |
| Epoetina alfa humana (6 jeringas con 60.000 UI) | 580,86 | 16 |
| Otros recursos sanitarios | ||
| Trasplante de médula ósea (1) | 39.238 | 22 |
| Transfusión de sangre (1) | 273,37 | 22 |
| Hospital de día (1 día) | 205,58 | 18 |
Precio de venta al público más 4% de IVA (PVP IVA); el precio de venta del laboratorio (PVL) se calculó de la forma siguiente: presentaciones con PVL ≤ 91,63 €, PVP IVA=PVL×1,561083; presentaciones con PVL entre > 91,63 euros y ≤ 200 euros, PVP IVA=(PVL+45,91)×1,04; presentaciones con PVL entre > 200 euros y ≤ 500 euros, PVP IVA=(PVL+50,91)×1,04; presentaciones con PVL > 500 euros, PVP IVA=(PVL+55,91)×1,04.
Se analizaron cinco tipos de costes para los esquemas con y sin rituximab: 1) de adquisición de los tratamientos (rituximab, fludarabina, ciclofosfamida); 2) de su administración intravenosa en el hospital de día; 3) del seguimiento del estado SLP; 4) del seguimiento del estado PE; y 5) de los acontecimientos adversos (tabla 1).
Para calcular los costes de adquisición se utilizaron los precios de venta del laboratorio (PVL)17. Se consideró una superficie corporal media de 1,7 m2, de acuerdo con los datos estadísticos del Ministerio de Sanidad y Consumo sobre la talla y el peso de los españoles18 como promedio de los resultados obtenidos con varias fórmulas ad hoc19. La posología fue la recomendada en la ficha técnica de rituximab8 y en los ensayos clínicos13,14 (tabla 1).
Para calcular los costes de la administración intravenosa de rituximab y de la quimioterapia se consideró que se administran en el hospital de día. Se estimó que el coste máximo del hospital de día es de 205,58 €20, y que este coste equivale a una perfusión de 191 minutos, ajustando los costes de los esquemas a las duraciones estimadas para el primero y los siguientes ciclos, conforme a las recomendaciones de las fichas técnicas de los fármacos. Se estimó que en el primer ciclo se dedica al paciente más tiempo (un 25% más) que en los ciclos siguientes.
Los costes del seguimiento de los estados SLP y PE se obtuvieron de las recomendaciones de la European Society for Medical Oncology (ESMO), tanto para los pacientes que reciben tratamiento de primera línea como para los que ya han sido tratados previamente21. Para el seguimiento del paciente asintomático con LLC deben hacerse, cada 3 meses, un análisis de sangre completo con recuento y una exploración de ganglios linfáticos, hígado y bazo en una consulta externa de oncohematología. En el caso del paciente con PE se contabilizaron, además, los tratamientos de soporte y de tercera línea (incluidos los trasplantes de médula ósea), y las transfusiones sanguíneas observadas en ambos ensayos clínicos13,14. A este respecto es de interés destacar que tanto en el estudio ML17102 (CLL-8) como en el BO17072 (REACH) participaron hospitales españoles (Madrid, Málaga, Murcia, Toledo, Salamanca, Valencia y Zaragoza)22,23.
Finalmente, el coste de los acontecimientos adversos de grado 3 o 4 de la Organización Mundial de la Salud se estimó a partir de la tasa de aparición de efectos adversos observada en los datos crudos de los ensayos clínicos13,14.
Los costes unitarios de los recursos sanitarios se obtuvieron de varias fuentes (tabla 2): los de adquisición de los medicamentos, de la Base de Datos de Medicamentos del Consejo General de Colegios Oficiales de Farmacéuticos17; los del hospital de día, de la tarifa de una comunidad autónoma20; los del trasplante de médula ósea, de la transfusión sanguínea y de la unidad de sangre, se obtuvieron de una base de datos de costes sanitarios españoles24; y finalmente, los de los acontecimientos adversos se tomaron de los costes españoles de los Grupos Relacionados por el Diagnóstico (GRD) o del coste por proceso24.
Tanto los costes (en euros) como los efectos (AVG o AVAC ganados) se descontaron a razón del 3,5% anual, conforme a la recomendación del National Institute for Health and Clinical Excellence (NICE) de Reino Unido25.
Análisis de sensibilidadEl caso base del análisis se hizo tanto de manera determinística (tomando los valores medios de la utilización de los recursos, de los costes unitarios y de las utilidades) como probabilística, mediante una simulación de Monte Carlo en 1000 o 2000 pacientes teóricos25. Para comprobar la estabilidad de los resultados y la consistencia de las estimaciones efectuadas, además del análisis probabilístico se hicieron análisis simples unifactoriales para valores extremos de las siguientes variables: ± 20% de los valores de utilidad de los estados SLP y PE; a diferencia del caso base, considerando la reutilización del fármaco sobrante; ± 20% del coste del tratamiento de soporte en SLP y PE; ± 20% del coste de los trasplantes de médula ósea; ± 20% del coste de la administración de rituximab; ± 20% del coste de los acontecimientos adversos; tasa de descuento anual de costes y utilidades: en lugar del 3,5% se aplicaron el 1,5% y el 6,0%; el horizonte temporal (10 años en el caso base) se varió a un mínimo de 5 años y un máximo de 15 años, y también se modificó para encontrar el umbral a partir del cual el resultado estaría por encima de los 30.000 € por AVAC ganado; y finalmente se utilizaron otras funciones (distintas de Weibull) para estimar las probabilidades de transición desde el estado SLP: Log-logística, Log-Normal, Gompertz y exponencial15.
ResultadosAnálisis de costesEn el caso base del análisis determinístico, el coste promedio por paciente tratado en primera línea con R-FC fue de 38.121 €, y de 26.631 € en el grupo de FC, con un coste incremental con R-FC de 11.490 €, mientras que el coste promedio por paciente tratado en segunda línea fue de 28.477 € y de 16.607 €, respectivamente. En ambas líneas de tratamiento, en el grupo de R-FC hubo mayores y menores costes que con FC en los estados SLP y PE, respectivamente. A pesar de que el coste del estado de PE es similar para ambos esquemas de tratamiento, el coste de la PE es mayor con el esquema FC que con R-FC debido a que el primero es menos eficaz (tiene una mayor tasa de progresión o recaída), y por consiguiente los pacientes progresan antes y consumen más recursos asociados a la progresión (tablas 3 y 4).
Resultados por paciente del caso basea: análisis determinístico y probabilístico (euros de 2010), en primera línea de tratamiento
| Ítem | Determinístico | Probabilístico | ||||
| R-FC | FC | Diferencia | R-FC (IC 95%) | FC (IC 95%) | Diferencia | |
| Años de vida | ||||||
| En SLP | 4,430 | 3,124 | 1,306 | 4,753 (4,34 - 5,19) | 3,181 (2,91 - 3,44) | 1,572 (1,10-2,05) |
| En PE | 2,203 | 2,954 | −0,751 | 4,329 (3,22 - 5,40) | 4,628 (3,68 - 5,56) | −0,299 (-1,50-−0,98) |
| En total | 6,633 | 6,078 | 0,555 | 9,082 (8,13 - 9,96) | 7,809 (6,89 - 8,68) | 1,273 (0,31-2,40) |
| AVAC | ||||||
| En SLP | 3,544 | 2,499 | 1,045 | 3,800 (344 - 4,16) | 2,543 (2,31 - 2,77) | 1,257 (0,88-1,63) |
| En PE | 1,322 | 1,772 | −0,451 | 2,602 (1,89 - 3,25) | 2,781 (2,17 - 3,41) | −0,179 (−0,88 - −0,56) |
| En total | 4,866 | 4,271 | 0,594 | 6,401 (5,79 - 6,97) | 5,324 (4,74 - 5,90) | 1,077 (0,51-1,74) |
| Costes totales | 38.121 | 26.631 | 11.490 | 46.457 | 34.643 | 11.814 |
| Coste por AVG | 20.703 | 9.280 | ||||
| Coste de ganar un AVAC | 19.343 | 10.969 | ||||
| Beneficio neto monetario | 5.151 | 26.381 | ||||
AVAC: año de vida ajustado por calidad; AVG: año de vida ganado; FC: fludarabina y ciclofosfamida; IC 95%: intervalo de confianza del 95%; PE: progresión de la enfermedad; R-FC: rituximab, flufarabina y ciclofosfamida; SLP: supervivencia libre de progresión.
Resultados por paciente del caso basea: análisis determinístico y probabilístico (euros de 2010), en segunda línea de tratamiento
| Ítem | Determinístico | Probabilístico | ||||
| R-FC | FC | Diferencia | R-FC (IC 95%) | FC (IC 95%) | Diferencia | |
| Años de vida | ||||||
| En SLP | 3,052 | 2,191 | 0,861 | 3,059 (2,67 - 3,45) | 2,196 (1,93 - 2,49) | 0,863 (0,40-1,31) |
| En PE | 1,801 | 2,151 | −0,350 | 1,798 (1,62 - 1,97) | 2,149 (2,03 - 2,26) | −0,351 (-0,54-−0,16) |
| En total | 4,853 | 4,342 | 0,512 | 4,856 (4,63 - 5,07) | 4,345 (4,18 - 4,53) | 0,512 (0,25-0,77) |
| AVAC | ||||||
| En SLP | 2,442 | 1,753 | 0,689 | 2,445 (2,13 - 2,76) | 1,756 (1,54 - 2,00) | 0,690 (0,32-1,05) |
| En PE | 1,081 | 1,290 | −0,210 | 1,078 (0,96 - 1,20) | 1,289 (1,19 - 1,38) | −0,210 (−0,33-−0,09) |
| En total | 3,522 | 3,043 | 0,479 | 3,524 (3,29 - 3,75) | 3,045 (2,87 - 3,23) | 0,479 (0,23-0,73) |
| Costes totales | 28.477 | 16.607 | 11.870 | 28.798 | 17.013 | 11.785 |
| Coste por AVG | 23.183 | 23.017 | ||||
| Coste de ganar un AVAC | 24.781 | 24.603 | ||||
| Beneficio neto monetario | 3.482 | 3.573 | ||||
AVAC: año de vida ajustado por calidad; AVG: año de vida ganado; FC: fludarabina y ciclofosfamida; IC 95%: intervalo de confianza del 95%; PE: progresión de la enfermedad; R-FC: rituximab, fludarabina y ciclofosfamida; SLP: supervivencia libre de progresión.
En el análisis probabilístico, la diferencia de costes entre ambos esquemas fue de 11.814 € en el tratamiento de primera línea y de 11.785 € en el de segunda línea (tablas 3 y 4).
Análisis de beneficiosEn ambas líneas de tratamiento, en el caso base la supervivencia fue más prolongada con R-FC que con FC. En el tratamiento de primera línea, en el análisis determinístico, 0,555 AVG y 0,594 AVAC ganados. En la simulación de Monte Carlo, 1,273 (IC 95%: 0,31-2,40) AVG y 1,077 (IC 95%: 0,51-1,74) AVAC ganados (tabla 3). En el tratamiento de segunda línea, en el análisis determinístico 0,512 AVG y 0,479 AVAC ganados. En la simulación de Monte Carlo, 0,512 (IC 95%: 0,25-0,77) AVG y 0,479 (IC 95%: 0,23-0,73) AVAC ganados (tabla 4).
Coste-utilidad incrementalEn el tratamiento de primera línea, en el caso base determinístico el coste por AVG y por AVAC ganado fue de 20.703 € y de 19.343 €, respectivamente, mientras que en el tratamiento de segunda línea el coste por AVG y AVAC ganado fue de 23.183 € y de 24.781 €, respectivamente. La simulación de Monte Carlo también dio lugar a resultados coste-efectivos tanto en primera línea (9.820 € y 10.969 €) como en segunda línea (23.017 € y 24.603 €). Como puede comprobarse en las figuras 2 y 3, el esquema R-FC fue más coste-efectivo que la quimioterapia sola en la mayoría de las simulaciones.
Análisis de sensibilidad probabilístico de la primera línea de tratamiento. Distribución del coste-utilidad incremental (coste por AVAC ganado) obtenida mediante una simulación de Monte Carlo en 1000 pacientes, en relación con un coste por AVAC umbral de 30.000 €. El coste por AVAC ganado con el esquema R-FC estuvo por debajo de los 30.000 € y 36.000 €, en comparación con el esquema FC, en el 99,6% y el 100% de las simulaciones, respectivamente.
Análisis de sensibilidad probabilístico de la segunda línea de tratamiento. Distribución del coste-utilidad incremental (coste por AVAC ganado) obtenida mediante una simulación de Monte Carlo en 2000 pacientes, en relación con un coste por AVAC umbral de 30.000 €. El coste por AVAC ganado con el esquema R-FC estuvo por debajo de los 30.000 € y 36.000 €, en comparación con el esquema FC, en el 74,2% y el 85,5% de las simulaciones, respectivamente.
Los análisis de sensibilidad univariados confirmaron la estabilidad de los resultados (tablas 5 y 6) y la variable más sensible fue el horizonte temporal, con un valor umbral de 8 años, a partir del cual el esquema R-FC es coste-efectivo en comparación con FC.
Análisis de sensibilidad del modelo de Markov (euros de 2010), análisis determinístico en primera línea
| Escenario | Asunciones | Coste por AVG (€) | Coste por AVAC ganado (€) |
| Caso básico | - | 20.703 | 19.343 |
| Análisis de sensibilidad (supuestos del caso base) | |||
| Utilidad de los estados de salud SLP/PE (promedio) | −20% | 20.703 | 24.178 |
| +20% | 20.703 | 16.119 | |
| Con reutilización del fármaco sobrante (sin reutilización) | - | 22.101 | 20.638 |
| Coste del tratamiento de soporte (SLP/PE) | −20% | 22.321 | 20.843 |
| +20% | 19.043 | 17.783 | |
| Coste de los trasplantes de médula ósea (promedio) | −20% | 20.400 | 19.050 |
| +20% | 21.027 | 19.635 | |
| Costes de administración de rituximab(241,85 € y 223,48 €, ciclo 1 y siguientes, respectivamente) | −20% | 20.270 | 18.928 |
| +20% | 21.157 | 19.757 | |
| Costes de los acontecimientos adversos (promedio) | −20% | 20.398 | 19.048 |
| +20% | 21.029 | 19.637 | |
| Tasa de descuento anual para costes y utilidades (3,5%) | 1,5% | 17.791 | 16.765 |
| 6,0% | 24.744 | 22.849 | |
| Horizonte temporal del modelo (10 años) | 5 años | 72.418 | 54.547 |
| 15 años | 13.459 | 14.521 | |
| Umbral: 8 años | 29.418 | 25.370 | |
| Otras funciones para estimar las probabilidades de transición (Weibull) | Log-Logística | 22.885 | 21.412 |
| Log-normal | 25.576 | 22.806 | |
| Gompertz | 20.591 | 20.325 | |
| Exponencial | 20.562 | 18.562 |
AVAC: año de vida ajustado por calidad; AVG: año de vida ganado; PE: progresión de la enfermedad; SLP: supervivencia libre de progresión.
Análisis de sensibilidad del modelo de Markov (euros de 2010), análisis determinístico en segunda línea
| Escenario | Asunciones | Coste por AVG (€) | Coste por AVAC ganado (€) |
| Caso básico | - | 23.183 | 24.781 |
| Análisis de sensibilidad (supuestos del caso base) | |||
| Utilidad de los estados de salud SLP/PE (promedio) | −20% | 23.183 | 30.956 |
| +20% | 23.183 | 20.637 | |
| Con reutilización del fármaco sobrante (sin reutilización) | - | 24.277 | 25.919 |
| Coste del tratamiento de soporte (SLP/PE) | −20% | 23.640 | 25.239 |
| +20% | 22.751 | 24.290 | |
| Coste de los trasplantes de médula ósea (promedio) | −20% | 23.251 | 24.824 |
| +20% | 23.140 | 24.705 | |
| Costes mensuales de administración de rituximab (262,90 € y 242,93 €, ciclo 1 y siguientes, respectivamente) | −20% | 22.713 | 24.249 |
| +20% | 23.678 | 25.279 | |
| Costes de los acontecimientos adversos (promedio) | −20% | 22.909 | 24.458 |
| +20% | 23.482 | 25.071 | |
| Tasa de descuento anual para costes y utilidades (3,5%) | 1,5% | 20.696 | 22.350 |
| 6,0% | 26.610 | 28.005 | |
| Horizonte temporal del modelo (10 años) | 5 años | 58.623 | 49.719 |
| 15 años | 19.309 | 21.776 | |
| Umbral: 8 años | 28.480 | 28.796 | |
| Otras funciones para estimar las probabilidades de transición (Weibull) | Log-Logística | 27.255 | 28.883 |
| Log-Normal | 26.524 | 27.883 | |
| Gompertz | 24.126 | 26.011 | |
| Exponencial | 21.848 | 23.013 |
AVAC: año de vida ajustado por calidad; AVG: año de vida ganado; PE: progresión de la enfermedad; SLP: supervivencia libre de progresión.
De acuerdo con los resultados del modelo, el tratamiento con el esquema R-FC es coste-efectivo en los pacientes con LLC en comparación con el esquema de quimioterapia sin rituximab, con independencia de la línea de tratamiento en que se utilice. En la valoración de estos resultados debemos considerar, en primer lugar, que se trata de un modelo teórico (que es, por definición, una simulación simplificada de la realidad). Ambos modelos, no obstante, están basados en los resultados de dos ensayos clínicos aleatorizados multinacionales, en los cuales participaron hospitales de varias ciudades españolas13,14.
La estimación de los costes se hizo a partir de fuentes españolas y según las recomendaciones de la AAHH, lo que justifica la aplicabilidad de los resultados al entorno sanitario español.
En el modelo económico se consideró que el esquema FC se administra por vía intravenosa, aunque es posible su administración por vía oral6, ya que esa fue la vía utilizada en los dos ensayos clínicos de eficacia13,14.
Debido a la ausencia de datos españoles, algunas asunciones del modelo tuvieron que basarse en datos de Reino Unido. Es el caso de las utilidades empleadas en el modelo, que se tomaron de una revisión sobre la LLC publicada por la Universidad de Birmingham16. Igualmente debe señalarse que a pesar de que las preferencias por los estados de salud pueden variar entre países, debido a factores culturales26, este riesgo es menor cuando se comparan países de similar nivel socioeconómico. A este respecto, cabe comentar que en un estudio basado en 83.000 evaluaciones de 44 estados de salud de EuroQol (EQ-5D), realizado en seis países europeos incluyendo España, se constató una mayor variabilidad entre individuos que entre países27.
Para intentar minimizar las limitaciones del modelo, en el caso base se tomaron premisas conservadoras y valores promedio, y se hicieron análisis de sensibilidad simples unifactoriales y simulaciones de Monte Carlo, que en todos los casos confirmaron la estabilidad de los resultados del caso base. No obstante, hay que tener en cuenta que el horizonte umbral (a partir del cual el coste por AVAC ganado sería menor de 30.000 €) es de 8 años (tablas 3 y 4). Considerando que la esperanza de vida de los pacientes con LLC se sitúa en torno a los 10 años10,11, los resultados del caso base serían aplicables a la mayoría de los pacientes de la población diana.
Los resultados del presente estudio coinciden con los de dos estudios llevados a cabo en Reino Unido10,11, en los cuales el coste de ganar un AVAC con el esquema R-FC, en comparación con FC tanto en primera como en segunda línea de tratamiento, también sería coste-efectivo.
A la hora de interpretar los resultados de ambos modelos hay que tener en cuenta que el mayor coste por AVAC adicional observado en el tratamiento de segunda línea respecto al de primera línea (24.781 € y 19.343 €, respectivamente) es coherente con el curso clínico de la LLC, ya que los pacientes que reciben tratamiento de segunda línea tienen un peor pronóstico que aquellos que lo reciben de primera línea, y por tanto la respuesta al tratamiento va siendo progresivamente menor a medida que avanza la enfermedad6.
Los resultados de estos análisis farmacoeconómicos deberían confirmarse en ensayos clínicos pragmáticos y aleatorizados, que comparasen directamente la eficacia, las utilidades, la tolerabilidad y el consumo de recursos sanitarios de las opciones terapéuticas evaluadas. Mientras tanto, de acuerdo con los resultados del modelo, puede concluirse que la adición de rituximab al esquema de quimioterapia de FC en primera o segunda línea de tratamiento aumenta la esperanza de vida y los AVAC, y es coste-efectivo en los pacientes con LLC no tratados previamente o que estén en recidiva o presenten resistencia al tratamiento previo.
Contribuciones de autoríaTodos los autores han contribuido de manera relevante en todas las partes y fases del estudio (concepción y diseño, análisis e interpretación de datos, escritura y revisión crítica del manuscrito), y han dado su aprobación a la versión final del artículo.
FinanciaciónEste estudio ha sido financiado con una ayuda a la investigación, sin restricciones, de Roche Farma, S.A.
Conflictos de interesesNinguno.