Análisis de coste-efectividad de la vacunación antineumocócica pediátrica en España.
MétodosSe utilizó un modelo determinístico poblacional en forma de árbol de decisión con un horizonte temporal de 1 año para estimar el impacto de la vacunación con Synflorix® o Prevenar13® sobre la población menor de 2 años en España, bajo la perspectiva del Sistema Nacional de Salud. Los datos epidemiológicos se obtuvieron del Conjunto Mínimo Básico de Datos al alta hospitalaria y de la literatura. Los datos sobre costes se obtuvieron de bases de datos nacionales de costes sanitarios. Los principales resultados en salud medidos fueron los casos evitados de enfermedad neumocócica invasora, otitis media aguda (OMA), miringotomías y hospitalizaciones por neumonía. Todos los costes se expresaron en euros de 2010. La efectividad se midió en años de vida ajustados por calidad (AVAC).
ResultadosEl potencial demostrado por Synflorix® para prevenir episodios de OMA causados por Haemophilus influenzae no tipificable podría traducirse en la prevención adicional de 41.513 episodios de OMA, 36.324 prescripciones de antibióticos y 382 miringotomías, y supondrían la ganancia de 143 AVAC frente a Prevenar13®. El coste total de la vacunación con Synflorix® resultaría unos 22 millones de euros menor.
ConclusionesLa vacunación antineumocócica de la población menor de 2 años en España con Synflorix®, en comparación con la vacunación con Prevenar13®, podría resultar en un mayor número de AVAC, así como en una reducción sustancial del coste total, resultando una estrategia dominante en términos de coste-efectividad.
To perform a cost-effectiveness analysis of pediatric pneumococcal vaccination in Spain.
MethodsA deterministic population-based model in the form of a decision-tree with a 1-year time horizon was used to estimate the impact of vaccination with Synflorix® or Prevenar13® in children aged less than 2 years in Spain from the perspective of the National Health System. Epidemiological data were obtained from the hospital discharge minimum data set (MDS) and the literature. Data on costs were obtained from national health costs databases. The main outcomes measured were the number of cases avoided of invasive pneumococcal disease, acute otitis media (AOM) and myringotomies, and hospital admissions for pneumonia. All costs were expressed in 2010 euros. Effectiveness was measured as the number of quality-adjusted life years (QALYs) gained.
ResultsThe efficacy of Synflorix® in preventing episodes of AOM caused by non-typeable Haemophilus influenzae could lead to additional prevention of 41,513 episodes of AOM, 36,324 antibiotic prescriptions and 382 myringotomy procedures and 143 QALYs gained compared with Prevenar13®. The total vaccination cost with Synflorix® would result in savings of 22 million euros.
ConclusionsPneumococcal vaccination with Synflorix® in comparison with Prevenar13® in children aged less than 2 years old in Spain could achieve a higher number of QALYs and a substantial cost offset. Vaccination with Synflorix® would be a dominant strategy in terms of cost-effectiveness.
Streptococcus pneumoniae y Haemophilus influenzae no tipificable son dos patógenos causantes de enfermedades respiratorias principalmente en la población pediátrica, en las personas de edad avanzada y en inmunodeprimidos, que pueden tener complicaciones graves.
Las enfermedades relacionadas con S. pneumoniae pueden ser invasoras (enfermedad neumocócica invasora [ENI]), como la meningitis y la bacteriemia, o no invasoras, de vías respiratorias bajas como la neumonía, o de vías respiratorias altas incluyendo la otitis media aguda (OMA).
La OMA es una enfermedad de gran incidencia en la infancia y uno de los principales motivos de prescripción de antibióticos y de consultas ambulatorias1.
A pesar de que se han identificado más de 90 serotipos de S. pneumoniae, la mayoría de las infecciones neumocócicas se deben a un grupo reducido de ellos2.
Respecto a H. influenzae no tipificable, estudios epidemiológicos nacionales recientemente publicados destacan su incremento como causa de episodios de OMA recurrente3, y en la actualidad es causa de hasta el 42% de los casos.
Desde el año 2001 está disponible en España la vacuna antineumocócica conjugada 7-valente (Prevenar®), que incluye los serotipos 4, 6B, 9V, 14, 18C, 19F y 23F. En fechas recientes han sido autorizadas por la Agencia Europea del Medicamento dos nuevas vacunas antineumocócicas conjugadas: la vacuna 10-valente conjugada con la proteína D de H. influenzae no tipificable (Synflorix®) y la vacuna 13-valente conjugada con toxina diftérica CRM197 (Prevenar13®).
Synflorix® es una vacuna 10-valente que incluye tres serotipos adicionales a los de Prevenar® (1, 5 y 7F), y utiliza la proteína D de H. influenzae no tipificable para conjugar 8 de los 10 serotipos incluidos. Está indicada para la inmunización activa frente a ENI y OMA causadas por S. pneumoniae en lactantes y niños a partir de 6 semanas de edad y hasta los 2 años de edad. Ensayos clínicos aleatorizados demostraron que Synflorix® es eficaz en la prevención de los episodios de OMA producidos por H. influenzae no tipificable4.
Por su parte, Prevenar13® incorpora 6 serotipos adicionales respecto a Prevenar® (1, 5, 7F, 3, 6A y 19A), conjugados con toxina diftérica CRM197.
El objetivo de este trabajo es comparar mediante una modelización económica los resultados en salud y los costes esperados de dos intervenciones sanitarias, en este caso dos nuevas vacunas, desde la perspectiva del Sistema Nacional de Salud.
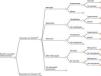
MétodosSe empleó un modelo desarrollado para evaluar el impacto de la vacunación antineumocócica en Canadá5 y que posteriormente fue adaptado para Reino Unido6. Se trata de un modelo determinístico poblacional en forma de árbol de decisión con un horizonte temporal de 1 año. La figura 1 muestra la estructura básica del modelo. Para la adaptación del modelo se siguieron las guías nacionales de evaluación económica de intervenciones sanitarias7.
Todos los costes se expresaron en euros del año 2010.
Para la selección y la validación de los datos necesarios en el análisis (datos epidemiológicos, eficacia de las vacunas y costes sanitarios asociados a las enfermedades) se contó con un panel de expertos clínicos formado por dos pediatras (atención primaria y hospital) y un microbiólogo.
En aquellos casos en que se dispuso de dos o más fuentes para la obtención de algún dato, se seleccionaron siempre los que ofreciesen una aproximación más conservadora para el análisis.
A continuación se detallan los principales datos de entrada requeridos por el modelo.
Datos epidemiológicosLa población infantil menor de 2 años en España se estimó en unos 456.000 niños, según los datos del Instituto Nacional de Estadística8.
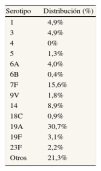
La distribución específica de los serotipos neumocócicos por grupo de edad para España se obtuvo del Laboratorio de Referencia de Neumococos del Instituto de Salud Carlos III9 (tabla 1).
La tasa de incidencia anual de ENI (meningitis y bacteriemia) se calculó a partir del número de casos hospitalizados por ENI registrados en el Conjunto Mínimo Básico de Datos al alta hospitalaria (CMBD)10. La mortalidad específica también se calculó según los datos del CMBD específicos por grupo de edad. Las incidencias de secuelas con discapacidad neurológica y auditiva se tomaron del modelo original6.
Los datos de incidencia específica por edad para neumonía que requiere hospitalización, así como su mortalidad asociada, se calcularon a partir del CMBD. Debido a la ausencia de datos de pacientes ambulatorios en España, se aplicó la relación entre casos ambulatorios y casos hospitalarios de Francia (base de datos Thales) a la incidencia de casos hospitalarios en España. La proporción de neumonías atribuidas a S. pneumoniae y a H. influenzae no tipificable se asumió como del 20% y el 5%, respectivamente6.
La proporción de episodios de OMA ambulatorios se tomó de los resultados del estudio de Garcés-Sánchez et al1 en niños menores de 5 años en la Comunidad Valenciana. La proporción de casos atribuidos a S. pneumoniae y H. influenzae no tipificable se obtuvo de una revisión sistemática de estudios epidemiológicos11, que la estimaba en 35,9% y 32,3%, respectivamente.
Las miringotomías se consideraron procedimientos hospitalarios y se estimaron a partir del CMBD.
La tabla 2 ofrece información detallada sobre las fuentes empleadas para cada parámetro epidemiológico utilizado en el modelo.
Variables epidemiológicas empleadas en el modelo
| Variable | Información adicional | Fuente | Año |
| Población española | Distribución por edad | Instituto Nacional de Estadística8 | 2009 |
| Distribución por serotipos | Media ponderada correspondiente para cada grupo de edad | Laboratorio de Referencia de Neumococos, Instituto de Salud Carlos III9 | 2008 |
| Incidencia de meningitis neumocócica | Casos hospitalizados. ICD-9 código 320.1 (2008) | CMBD10 | 2008 |
| Incidencia de bacteriemia neumocócica | Casos hospitalizados. ICD-9 código 038.2 (2008) | CMBD10 | 2008 |
| Mortalidad por meningitis | Casos de muertes. ICD-9 código 320.1 (2007) | CMBD10 | 2008 |
| Mortalidad por bacteriemia | Casos de muertes. ICD-9 código 038.2 (2008) | CMBD10 | 2008 |
| Razón de casos con secuelas por meningitis en niños | 7,0% por secuelas neurológicas y 13,3% por discapacidad auditiva | McIntyre et al12 y Pomeroy et al13 | 1997 y 1990 |
| Razón de casos con secuelas por meningitis en adultos | 19,0% por secuelas neurológicas y 25,4% por discapacidad auditiva | Auburtin et al14 y Kastenbauer et al15 | 2002 y 2003 |
| Neumonía hospitalizada | ICD-9 código 481 (2008) | CMBD10 | 2008 |
| Neumonía, casos ambulatorios | Datos españoles no disponibles | Base de datos Thales | 2007 |
| Mortalidad por neumonía | Casos de muertes. ICD-9 código 481 (2008) | CMBD10 | 2008 |
| Distribución por patógeno causante de neumonía | 20,0% de los casos atribuibles a S. pneumoniae y 5,0% a H. influenzae no tipificable | De Wals et al6 | 2009 |
| Procedimientos de miringotomía | ICD-9 códigos por procedimiento 20.0, 20.01 y 20.09 | CMBD10 | 2008 |
| Episodios de OMA | Distribución entre 0 y 5 años | Garcés-Sánchez et al11 | 2004 |
| Distribución por patógeno causante de OMA | 35,9% de los casos atribuibles a S. pneumoniae y 32,3% a H. influenzae no tipificable | Leibovitz et al1 | 2004 |
El caso base consideró una cobertura media vacunal del 90% de la población en edad de ser vacunada. El esquema de vacunación considerado fue de una dosis en los meses 2, 4 y 6 tras el nacimiento y una cuarta dosis de recuerdo en el mes 13.
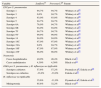
La eficacia frente a la ENI específica por serotipo para Synflorix® y Prevenar13® se consideró similar a la indicada por Whitney et al16 para Prevenar®. Para los tres serotipos adicionales (1, 5 y 7F) incluidos en Synflorix® se consideró la eficacia media frente al resto de los serotipos (94,7%). También se asumió una eficacia por protección cruzada frente al serotipo 6A del 76%16. Los mismos supuestos se asumieron para Prevenar13®, aunque en su caso la eficacia media fue considerada para los seis serotipos adicionales (1, 3, 5, 6A, 7F y 19A).
La eficacia de la vacunación para prevenir la neumonía se estimó a partir de la literatura17. Se asumió que Synflorix® y Prevenar13® evitarían un 4,3% de los casos ambulatorios. Para las neumonías que requieren hospitalización se estimó que Synflorix® evitaría un 40% de los casos, frente a un 46% Prevenar13®. La alta eficacia de ambas vacunas para prevenir casos de neumonía graves se debería a que las dos incluyen el serotipo 1, causante de gran número de neumonías complicadas y empiemas18.
El porcentaje de casos de OMA neumocócica cubiertos por los serotipos incluidos en Synflorix® y Prevenar13® se estimó en un 71,6% y un 82,2%, respectivamente19. Los datos de eficacia para la prevención de OMA con Synflorix® se basaron en el estudio POET4, que mostró una reducción de los episodios de OMA causados por serotipos incluidos en la vacuna del 57,6%, y de episodios causados por H. influenzae no tipificable del 35,6%. Para Prevenar13® la reducción de los casos de OMA por S. pneumoniae se consideró del 57,2%20, y sin eficacia frente a H. influenzae no tipificable.
La máxima eficacia global frente a la OMA se calculó en un 22,9% para Synflorix® y un 11,2% para Prevenar13®.
Las asunciones de eficacia empleadas en el caso base se especifican en la tabla 3.
Datos de eficacia
| Variable | Synflorix® | Prevenar13® | Fuente |
| ENI por S. pneumoniae | |||
| Serotipo 1 | 94,7% | 94,7% | Whitney et al16 |
| Serotipo 3 | 0,0% | 94,7% | Whitney et al16 |
| Serotipo 4 | 93,0% | 93,0% | Whitney et al16 |
| Serotipo 5 | 94,7% | 94,7% | Whitney et al16 |
| Serotipo 6A | 76,0% | 94,7% | Whitney et al16 |
| Serotipo 6B | 94,0% | 94,0% | Whitney et al16 |
| Serotipo 7F | 94,7% | 94,7% | Whitney et al16 |
| Serotipo 9V | 99,9% | 99,9% | Whitney et al16 |
| Serotipo 14 | 94,0% | 94,0% | Whitney et al16 |
| Serotipo 18C | 97,0% | 97,0% | Whitney et al16 |
| Serotipo 19A | 0,0% | 94,7% | Whitney et al16 |
| Serotipo 19F | 87,0% | 87,0% | Whitney et al16 |
| Serotipo 23F | 98,0% | 98,0% | Whitney et al16 |
| Neumonía | |||
| Casos hospitalizados | 40,0% | 46,4% | Black et al21 |
| Casos ambulatorios | 4,30% | 4,30% | Black et al21 |
| OMA por S. pneumoniae y H. influenzae no tipificable | |||
| Serotipos cubiertos | 57,6% | 57,2% | Prymula et al4, Eskola et al20 |
| Serotipos no cubiertos | -33,0% | -33,0% | Eskola et al20 |
| H. influenzae no tipificable | |||
| 35,6% | -11,0% | Prymula et al4, Eskola et al20 | |
| Miringotomía | 65,8% | 32,2% | Black et al17 |
ENI: enfermedad neumocócica invasora; OMA: otitis media aguda.
Se realizó un análisis de los costes directos sanitarios desde la perspectiva del Sistema Nacional de Salud.
El coste total incluyó los costes de vacunación (coste farmacológico y de administración) y los costes derivados del tratamiento de los casos de ENI, neumonía y OMA. Se consideró un coste de 38,36 € por dosis de Synflorix® y de 49,91 € por dosis de Prevenar13® (Precio de Venta Laboratorio a partir del PVP IVA22), con un coste por cada administración de 4,88 €23.
El coste del tratamiento de cada episodio de enfermedad o secuela se estimó según su correspondiente Grupo Relacionado de Diagnóstico (GRD), o bien a partir del consumo de recursos correspondiente23.
La tabla 4 muestra los costes unitarios utilizados en el modelo, así como las fuentes de su obtención.
Costes unitarios
| Ítem | Coste (€ de 2010) | Comentarios | Fuente |
| Synflorix® (una dosis) | 38,86 € | Precio venta laboratorio (PVL) | A partir de PVP IVA22 |
| Prevenar13® (una dosis) | 49,91 € | Precio venta laboratorio (PVL) | A partir de PVP IVA22 |
| Administración por vacuna | 4,88 € | Coste por administración | eSALUD23 |
| Meningitis hospitalizada | 6.221 € | eSALUD23 | |
| Bacteriemia hospitalizada | 3.450 € | GRD código 417 | eSALUD23 |
| Neumonía hospitalizada | 1.364 € | GRD código 773 | eSALUD23 |
| Neumonía ambulatoria | 221 € | eSALUD23 y Portalfarma22 | |
| Episodio de otitis media aguda | 60 € | eSALUD23 y Portalfarma22 | |
| Miringotomía | 1.613 € | GRD código 62 | eSALUD23 |
| Secuela neurológica | 630 € | eSALUD23 | |
| Discapacidad auditiva | 525 € | eSALUD23 |
El resultado del análisis de coste-efectividad se calculó como la relación entre los costes y los AVAC incrementales entre Synflorix® y Prevenar13®. Los AVAC se estimaron mediante los valores de utilidad para las distintas enfermedades o secuelas derivadas de ellas, ponderando por la edad24–29.
Análisis de sensibilidadPara valorar la influencia de la incertidumbre de los parámetros en los resultados del estudio y evaluar la robustez de los resultados obtenidos, realizamos un análisis de sensibilidad probabilístico mediante una simulación de Monte-Carlo de segundo orden. En él se realizaron 1000 simulaciones sobre la relación coste-efectividad incremental30. Para ello, se seleccionaron unas distribuciones fijas y se estimaron los parámetros de cada distribución en función de los datos primarios recopilados31. La incertidumbre de los parámetros epidemiológicos de incidencia y mortalidad se evaluó mediante una distribución triangular (± 20%). Para el resto de los parámetros (distribución de serotipos, distribución de patógenos, eficacia, costes y utilidades), la tabla 5 muestra las distribuciones empleadas para evaluar la incertidumbre.
Distribución de los parámetros para el análisis de sensibilidad probabilístico
| Serotipos | Parámetro: serotipos | Parámetro: eficacia frente a ENI | |
| Distribución para serotipos | Distribución para Synflorix® | Distribución para Prevenar13® | |
| 1 | Dirichlet (4,9%) | Lognormal (0,95-0,32) | Lognormal (0,95-0,32) |
| 3 | Dirichlet (4,9%) | - | Lognormal (0,95-0,32) |
| 4 | Dirichlet (0,0%) | Lognormal (0,93-0,91) | Lognormal (0,93-0,91) |
| 5 | Dirichlet (1,3%) | Lognormal (0,95-0,32) | Lognormal (0,95-0,32) |
| 6A | Dirichlet (4,0%) | Lognormal (0,76-0,46) | Lognormal (0,95-0,32) |
| 6B | Dirichlet (0,4%) | Lognormal (0,94-0,62) | Lognormal (0,94-0,62) |
| 7F | Dirichlet (15,6%) | Lognormal (0,95-0,32) | Lognormal (0,95-0,32) |
| 9V | Dirichlet (1,8%) | Lognormal (1-2,45) | Lognormal (1-2,45) |
| 14 | Dirichlet (8,9%) | Lognormal (0,94-0,57) | Lognormal (0,94-0,57) |
| 18C | Dirichlet (0,9%) | Lognormal (0,97-0,69) | Lognormal (0,97-0,69) |
| 19A | Dirichlet (30,7%) | - | Lognormal (0,95-0,32) |
| 19F | Dirichlet (3,1%) | Lognormal (0,87-0,50) | Lognormal (0,87-0,50) |
| 23F | Dirichlet (2,2%) | Lognormal (0,98-1,17) | Lognormal (0,98-1,17) |
| Parámetro | Distribución para Synflorix® | Distribución para Prevenar13® |
| Porcentaje eficacia primera dosis | Triangular (0,26-0,33-0,40) | Triangular (0,26-0,33-0,40) |
| Porcentaje eficacia segunda dosis | Triangular (0,53-0,66-0,79) | Triangular (0,53-0,66-0,79) |
| Porcentaje eficacia tercera dosis | Lognormal (0,95-0,457) | Lognormal (0,95-0,457) |
| Porcentaje eficacia cuarta dosis | Lognormal (1-3,23) | Lognormal (1-3,23) |
| Porcentaje hospitalizaciones por neumonía evitadas | Lognormal (0,4-0,095) | Lognormal (0,46-0,095) |
| Porcentaje de neumonías AP evitadas | Lognormal (0,04-0,04) | Lognormal (0,04-0,04) |
| Eficacia OMA debida a S. pneumoniae (serotipos en vacuna) | Lognormal (0,58-0,165) | Lognormal (0,57-0,135) |
| Eficacia OMA debida a S. pneumoniae (serotipos no en vacuna) | Lognormal (-0,33-0,153) | Lognormal (-0,33-0,153) |
| Eficacia OMA debida a H. influenzae no tipificable | Lognormal (0,36-0,205) | Lognormal (-0,11-0,096) |
| Porcentaje de casos de neumonía debidos a S. pneumoniae | Dirichlet (20,0%) | |
| Porcentaje de casos de neumonía debidos a H. influenzae no tipificable | Dirichlet (5,0%) | |
| Porcentaje de casos de OMA debidos a S. pneumoniae | Dirichlet (35,9%) | |
| Porcentaje de casos de OMA debidos a H. influenzae no tipificable | Dirichlet (32,3%) | |
| Coste administración vacuna | Triangular (2-4,88-7) | |
| Costes directos de tratamiento | Triangular (± 20%) | |
| Coste anual por secuela neurológica | Triangular (± 20%) | |
| Coste anual por secuela auditiva | Triangular (± 20%) | |
| Pérdida de utilidad por meningitis | Beta (7,70-324,15) | |
| Parámetro | Distribución |
| Pérdida de utilidad por bacteriemia | Beta (6,46-811,13) |
| Pérdida de utilidad por neumonía hospitalizada | Beta (6,46-811,13) |
| Pérdida de utilidad por neumonía AP | Beta (3,61-607,98) |
| Pérdida de utilidad por miringotomía | Triangular (0,004-0,005-0,006) |
| Pérdida de utilidad por OMA | Triangular (0,004-0,005-0,006) |
| Pérdida de utilidad por secuela neurológica | Triangular (0,32 -0,4-0,48) |
| Pérdida de utilidad por secuela auditiva causada por meningitis | Normal (0,06-0,2-0,12) |
AP: atención primaria; OMA: otitis media aguda.
Los resultados del análisis de sensibilidad probabilístico del modelo se expresaron mediante el plano de coste-efectividad, en el cual se representan en abscisas los AVAC incrementales y en ordenadas los costes incrementales de Synflorix® frente a Prevenar13®. Cada punto mostrado en el plano corresponde a una simulación según los parámetros y distribuciones estipulados. En el mismo plano se muestra el umbral de eficiencia comúnmente aceptado en España (30.000 €/AVAC)32.
ResultadosEfectividadLa tabla 6 muestra el número de casos esperados de las distintas enfermedades junto al número de AVAC perdidos asociados a las opciones de vacunar con Synflorix® o con Prevenar13®.
Resultados del modelo. Resultados en salud y costes totales
| Número de eventos | Número de eventos Synflorix® | Número de eventos Prevenar13® | Diferencia | |
| Casos de meningitis | 49 | 36 | 26 | +10 |
| Casos de bacteriemia | 18 | 13 | 9 | +4 |
| Neumonía hospitalizada | 448 | 307 | 284 | +23 |
| Neumonía ambulatoria | 8.447 | 8.102 | 8.102 | 0 |
| Miringotomías | 1.312 | 565 | 947 | -382 |
| Episodios OMA | 450.498 | 369.213 | 410.726 | -41.513 |
| AVAC perdidos | 2.625 | 2.135 | 2.278 | -143 |
| Coste de eventos | Coste de eventos Synflorix® | Coste de eventos Prevenar13® | Diferencia | |
| Coste de la vacunación | - | 67.011.583 € | 86.066.601 € | - 19.055.018 € |
| Coste de administración de la vacuna (3+1 dosis) | - | 8.014.522 € | 8.014.522 € | 0 |
| Coste por meningitis | 442.166 € | 331.383 € | 235.960 € | + 95.423 € |
| Coste por bacteriemia | 62.099 € | 45.601 € | 31.390 € | + 14.211 € |
| Coste por neumonía | 2.478.030 € | 2.216.968 € | 2.186.188 € | + 30.780 € |
| Coste por OMA (incluyendo miringotomía) | 29.025.165 € | 22.964.537 € | 26.059.723 € | - 3.095.186 € |
| Costes directos totales | 32.007.460 € | 100.584.593 € | 122.594.383 € | - 22.009.790 € |
| Razón de coste-efectividad incremental Synflorix® frente a Prevenar13® (coste/AVAC) | Dominante | |||
AVAC: años de vida ajustados por calidad; OMA: otitis media aguda.
La vacunación universal con Synflorix® evitaría un 9% más de casos de OMA y un 29% más de miringotomías, mientras que la vacunación con Prevenar13® podría evitar un 22% más casos de ENI.
Synflorix® evitaría más casos de OMA y, en consecuencia, un mayor número de visitas ambulatorias y de prescripciones de antibióticos (9%). Por tanto, la vacunación con Synflorix® obtendría un mayor número de AVAC (143 AVAC adicionales), principalmente por la reducción de la morbilidad asociada a los casos de OMA y por las miringotomías evitadas.
Asumiendo que un 87% de los casos de OMA se tratan con antibióticos, la reducción de 41.513 casos de OMA podría evitar alrededor de 36.324 prescripciones de estos fármacos.
CostesTal y como puede verse en la tabla 6, la estrategia de vacunación con Synflorix® podría resultar unos 22 millones de euros menos costosa que la vacunación con Prevenar13®, principalmente debido a la mayor eficacia para prevenir episodios de OMA y al menor coste de adquisición de la vacuna.
Coste-efectividad y análisis de sensibilidadEl análisis del coste incremental por AVAC muestra que la vacunación con Synflorix® resultaría ser una alternativa dominante, ya que tendría el potencial de ofrecer un mayor número de AVAC a un menor coste con respecto a Prevenar13®.
Los resultados del análisis de sensibilidad probabilístico mostraron la robustez de los resultados cuando se consideraba la incertidumbre y la variabilidad de los principales parámetros del modelo. El 89% de las 1000 simulaciones llevadas a cabo presentaron un menor coste y un mayor número de AVAC, lo que indica la vacunación con Synflorix® como dominante frente a Prevenar13®.
DiscusiónLas nuevas vacunas antineumocócicas conjugadas, Synflorix® y Prevenar13®, ofrecen una mayor cobertura de las distintas enfermedades gracias a la inclusión de más serotipos de neumococo. De acuerdo con el modelo económico empleado, la estrategia de vacunación de los niños españoles de entre 2 y 13 meses de edad con Synflorix® podría suponer un menor coste y una mayor efectividad expresada como número de AVAC, con respecto a la vacunación con Prevenar13®, por lo que resulta una intervención coste-efectiva desde la perspectiva del Sistema Nacional de Salud.
La elevada incidencia de OMA en la población infantil, junto a la mayor protección frente a ella que puede proporcionar Synflorix® al estar conjugada con la proteína D de H. influenzae no tipificable, resultaría en potenciales ahorros de costes por enfermedad además de en una mayor efectividad.
Como ya se ha comentado, los estudios epidemiológicos nacionales destacan el aumento de los episodios de OMA recurrentes causados por H. influenzae no tipificable3, otorgando a este patógeno hasta el 42% de los casos. Así pues, la asunción empleada en el modelo (32% de OMA causadas por H. influenzae no tipificable) puede considerarse conservadora.
Ésta es la primera evaluación económica sanitaria que compara directamente el impacto de las nuevas vacunas antineumocócicas en España, y por lo tanto no es posible comparar nuestros resultados con los de otros trabajos. Sin embargo, recientemente se publicó un análisis de coste-utilidad de la incorporación de estas nuevas vacunas conjugadas al programa de vacunación de la Comunidad de Madrid33. Dicho análisis evalúa el impacto de las vacunas exclusivamente sobre la ENI y en la Comunidad de Madrid, y sus resultados indican que la incorporación de Prevenar13® aportaría 224 AVAC frente a 70 AVAC con Synflorix®, con un coste incremental de 16.908 €/AVAC ganado. El análisis concluye que la inclusión de Prevenar13® resultaría una estrategia coste-efectiva frente a Synflorix®. No es posible comparar los resultados del trabajo de Picazo et al33 con el presente estudio debido a que nuestro análisis incluye el impacto de la vacunación antineumocócica tanto sobre la ENI como sobre la enfermedad no invasora (OMA, sus complicaciones, consumo de recursos y costes asociados), y hace una aproximación desde la perspectiva nacional.
Algunas limitaciones de nuestro análisis provienen de la ausencia de datos registrados sobre casos ambulatorios de neumonía y OMA. En estos casos, de los cuales no se disponía de datos nacionales o bien se tuvo que recurrir a varias fuentes, se contó con la validación por parte de un panel de expertos compuesto por dos pediatras (atención primaria y hospital) y un microbiólogo. Además, cuando se dispuso de dos o más datos para una misma variable del estudio se optó siempre por la que ofreciese una aproximación más conservadora al análisis.
De esta forma, finalmente los datos ambulatorios para la neumonía se tomaron de un registro de casos ambulatorios del Sistema Nacional de Salud de Francia, mientras que para la OMA la información se obtuvo de un estudio retrospectivo llevado a cabo en niños de la Comunidad Valenciana1.
El presente estudio asume que Synflorix® ofrece una protección adicional frente a la OMA causada por H. influenzae no tipificable, tal como se recoge en el European Public Assessment Report emitido por la Agencia Europea del Medicamento34 en el momento de la autorización de la vacuna. Se han realizado estudios clínicos en los cuales se ha observado este efecto4, y actualmente se están llevando a cabo más estudios clínicos que buscan evaluar esta protección de Synflorix® frente a las infecciones producidas por H. influenzae no tipificable35.
La eficacia de Synflorix® en la prevención de episodios de OMA por H. influenzae no tipificable es uno de los datos que más influyeron en los resultados del análisis. Por ello se incluyó este valor en el análisis de sensibilidad probabilístico, con la intención de evaluar la robustez de los resultados del análisis de coste-efectividad si se considerasen otros valores para dicha variable. El análisis de sensibilidad realizó múltiples simulaciones del modelo alterando el valor de eficacia frente a la OMA por H. influenzae no tipificable entre los intervalos de confianza inferior y superior del ensayo clínico de Synflorix® del cual se tomó el valor del caso base. Los resultados de dicho análisis mostraron que la mayoría de las simulaciones se mantuvieron en una relación de coste-efectividad incremental favorable a Synflorix®, tal como se aprecia en la figura 2.
Por último, cabe mencionar que el presente estudio no incluye el efecto de la protección de grupo (o de rebaño), que es como se conoce a la protección que tiene lugar en la población no inmunizada por el hecho de vacunar a un determinado grupo debido a la disminución del número de portadores del patógeno. Puesto que el presente estudio pretendía evaluar el impacto directo de las vacunas en la población infantil, este efecto de grupo no se incluyó. No obstante, la misma herramienta de modelización había sido utilizada previamente para analizar el coste-efectividad de la vacunación con Synflorix® frente a un escenario de no vacunación, teniendo en cuenta la protección de grupo sobre toda la población36. Los resultados de aquel análisis concluyeron que la vacunación con Synflorix® frente a la estrategia de no vacunar resultaría coste-efectiva desde la perspectiva del Sistema Nacional de Salud.
ConclusionesEl presente trabajo adapta al entorno español un modelo de evaluación económica con el objetivo de estimar el impacto de las nuevas vacunas antineumocócicas conjugadas, tanto sobre los costes como sobre los resultados en salud. De acuerdo con el análisis de coste-efectividad llevado a cabo, la vacunación con Synflorix® podría tener una mayor efectividad, medida como número de AVAC, y a un menor coste que la vacunación con Prevenar13®, por lo que resultaría una intervención coste-efectiva desde la perspectiva del Sistema Nacional de Salud.
Considerando la constante evolución de los patrones epidemiológicos relacionados con la enfermedad neumocócica en nuestro país, sería conveniente actualizar el presente análisis conforme vaya surgiendo nueva evidencia al respecto.
Contribuciones de autoríaF. Pérez y M. Brosa desarrollaron el estudio y adaptaron la herramienta de modelización económica al entorno nacional. F. Pérez y M. Brosa obtuvieron los datos y realizaron los análisis. R. Morano e I. Pérez Escolano contribuyeron en la interpretación de los resultados y revisaron los borradores del manuscrito. Todos los autores aprobaron la versión final del manuscrito.
FinanciaciónEl presente estudio ha contado con la financiación de GlaxoSmithKline S.A. para su realización. El análisis lo realizó una empresa consultora independiente contratada por GlaxoSmithKline S.A. con ese fin.
Conflicto de interesesR. Morano e I. Pérez-Escolano son empleados de GlaxoSmithKline España, empresa comercializadora de Synflorix®. F. Pérez y M. Brosa son empleados de Oblikue Consulting S.L., consultora independiente contratada para la realización del estudio.