La incorporación de nuevos tratamientos, procedimientos y tecnologías a la cartera de prestaciones de los sistemas de salud ha de cumplir un triple objetivo de modo equilibrado: mejora del acceso de los pacientes a soluciones innovadoras, sostenibilidad del sistema y compensación a la innovación. Sin embargo, los esquemas tradicionales basados en políticas de establecimiento de precios fijos, independientes de la adecuación de la utilización o del resultado final en condiciones de efectividad, pueden dar lugar a decisiones ineficientes. Recientemente, los acuerdos de riesgo compartido han aparecido como nuevos esquemas de acceso basados en resultados cuyo objetivo es reducir la incertidumbre de los diferentes agentes implicados, buscando un acuerdo en materia de financiación y de condiciones de uso de una tecnología sanitaria. Como elementos centrales del debate sobre su utilización se encuentran la variedad de instrumentos (de especial interés aquellos basados en resultados), las implicaciones para los distintos agentes involucrados en su diseño, y la supervisión y su posible aplicación en nuestro país. Como conclusión principal, los acuerdos de riesgo compartido deberían de ser unos esquemas de acceso al mercado a utilizar en casos muy concretos, cuando las condiciones estándar de acceso no puedan ser aplicables debido a la incertidumbre de resultados a largo plazo en condiciones de efectividad. Asimismo, estas medidas no están orientadas sólo a regular el precio sino también a actuar sobre la adecuación en la utilización, si bien, dada la experiencia internacional, es pronto para llegar a una conclusión sólida sobre los resultados de su aplicación.
The incorporation of new treatments, procedures and technologies into the services’ portfolio of healthcare providers should aim to improve three areas equally: patient access to innovative solutions, the sustainability of the health system and compensation for innovation. However, traditional schemes based on fixed prices that fail to consider the product’s appropriacy of use or its results in terms of effectiveness may lead to inefficient decision-making processes. Recently, risk-sharing agreements have appeared as new access schemes based on results that aim to reduce the uncertainty of the distinct health care players involved in reaching an agreement on new health technology financing and conditions of use. Key elements in the debate on these instruments are the huge variety of instruments available (especially those based on results), the implications for different players involved in their design and supervision, and their possible implementation in Spain. Our main conclusion is that risk-sharing agreements should be used in highly limited cases when standard conditions of access cannot be applied due to uncertainty about long-term effectiveness. These measures are aimed not only at regulating price but also at acting on the appropriate use of new technology. However, because international experience is limited, drawing a solid conclusion on the final results of the application of risk-sharing agreements would be premature.
Si hay un paradigma de sector regulado, dentro de un marco de economía de libre mercado como es el de la Unión Europea en general, y el de España en particular, es el sector sanitario. Sin duda, ello se debe en parte a los problemas que generaría desde la perspectiva de la equidad que los mercados sanitarios funcionaran como un mercado libre y el acceso a los servicios dependiera exclusivamente del poder de compra de los usuarios. No obstante, desde la perspectiva de la eficiencia también hay poderosas razones para la regulación. En los mercados sanitarios están presentes todo tipo de imperfecciones, tanto desde el punto de vista de la oferta como del de la demanda.
En el caso del acceso a los mercados de nuevas tecnologías hay fuertes incertidumbres de diversa naturaleza. Desde la perspectiva del financiador, existe incertidumbre sobre el impacto presupuestario de su decisión, y sobre la brecha entre los resultados de eficacia y seguridad procedentes de ensayos clínicos, y la efectividad y la seguridad de la tecnología al ser aplicada en un entorno cuyas características pueden diferir de las del ensayo (diferencias en edad, patrones de multimorbilidad, perfiles de polimedicación de los pacientes, diferencias en las condiciones de dispensación o aplicación, etc.). Desde la perspectiva del comercializador existe incertidumbre sobre restricciones en la financiación pública en el momento de comercializar su producto, sobre el precio a obtener y sobre su difusión. En suma, incertidumbres sobre las expectativas de negocio y la rentabilidad de la inversión realizada. Asimismo, los proveedores de los servicios sanitarios y los usuarios se pueden enfrentar a una gran incertidumbre sobre el beneficio/riesgo de la tecnología considerada en situaciones reales, debido a que la indicación puede o debe ser restringida a un subgrupo concreto de pacientes o a que los efectos a largo plazo no han sido demostrados.
Frente a las tradicionales políticas públicas de financiación y fijación rígida de precios de tecnologías sanitarias, especialmente en el caso de los medicamentos, las medidas basadas en incentivos y con capacidad de mejora en los resultados clínicos están ganando influencia en las políticas de uso racional de los servicios sanitarios en varios países1,2. Los acuerdos de riesgo compartido pueden ser una herramienta de gran utilidad cuando se diseñan de manera correcta y en las condiciones adecuadas. La idea fundamental es reducir la incertidumbre de los diferentes agentes implicados, buscando un acuerdo en materia de financiación y de condiciones de uso de una tecnología sanitaria concreta que, al margen de este tipo de acuerdos, no tendría facilidades de acceso al mercado.
El objetivo de este artículo es revisar el concepto de «acuerdo de riesgo compartido» y sus distintas variantes, presentar varios casos prácticos de ejemplos de su aplicación, considerar el papel que pueden desempeñar distintos actores y los posibles beneficios de su colaboración, plantear las condiciones que pueden hacer atractivas este tipo de herramientas y no dejar de considerar sus limitaciones.
Definición y clasificaciónEl término «acuerdo de riesgo compartido» se utiliza ampliamente en referencia a todos los esquemas de financiación y contratos que vinculan el precio o el reembolso de una posible innovación sanitaria, con una serie de variables de objetivos y resultados. A priori no se dispone de una definición consensuada, y las distintas interpretaciones dependen de varios factores. Ni siquiera hay acuerdo en cómo denominar a estos instrumentos, y en la literatura, mayoritariamente anglosajona, se utiliza una amplia variedad de términos. Recientemente, en Reino Unido, la reforma del Pharmaceutical Price Regulation Scheme conllevó un cambio conceptual importante, con el posible objetivo de intentar evitar las connotaciones negativas que pueden llevar consigo palabras como «riesgo» y sustituyéndolas por otras como «acceso» y «paciente» (patient access schemes)3.
Sin embargo, con independencia del término elegido, de las traducciones más o menos afortunadas de la nomenclatura anglosajona, y de las modificaciones políticas del concepto para hacerlo más amigable, lo cierto es que este tipo de esquemas presentan características comunes: el pago final que se va a realizar por los productos no va a venir simplemente determinado por el número de unidades vendidas, sino que va a estar marcado por la consecución de una serie de objetivos, previamente acordados, ya sea en términos de efectividad, eficiencia o impacto presupuestario.
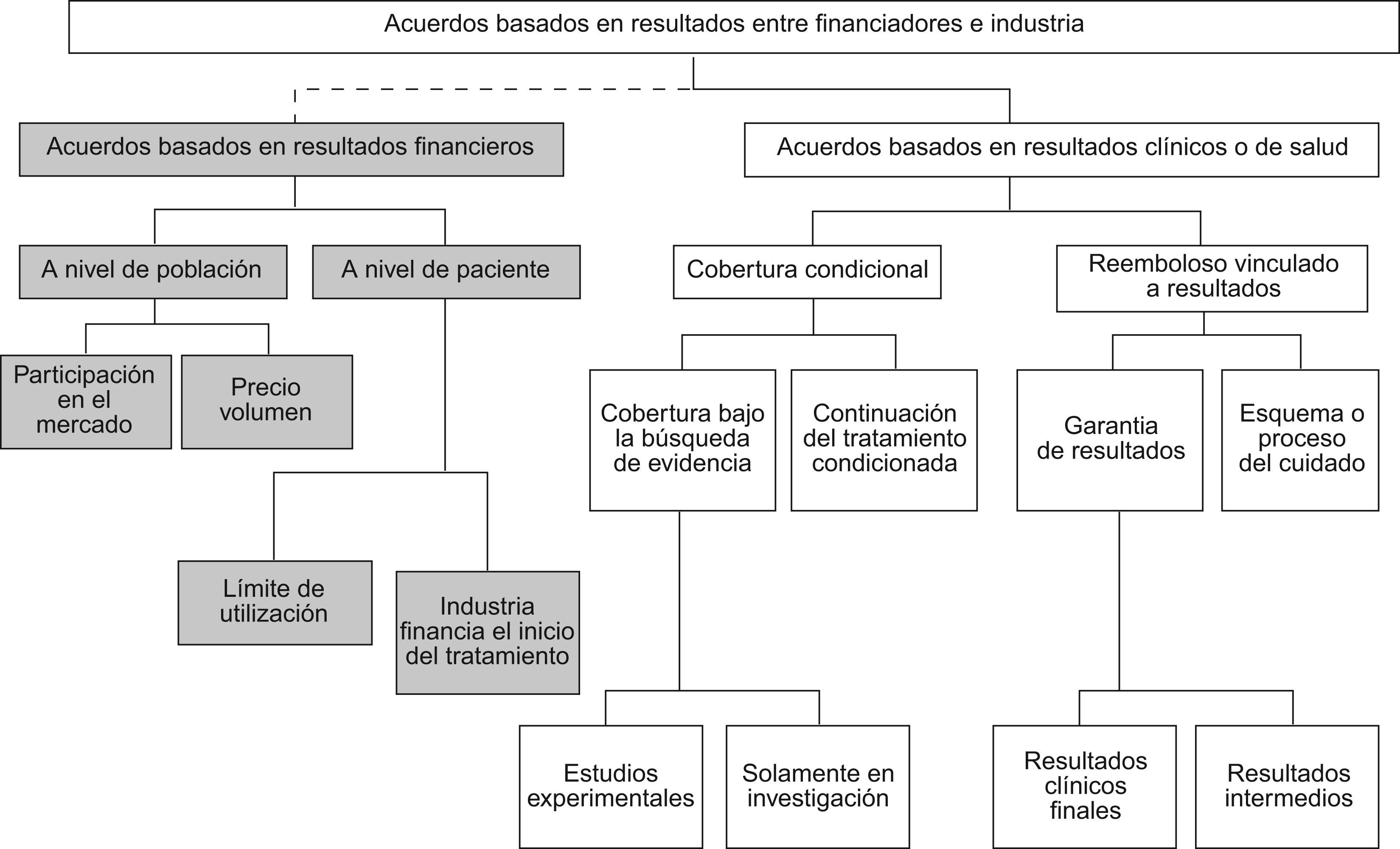
Sin duda alguna ha habido una evolución de estos instrumentos, partiendo de unos modelos iniciales en que los acuerdos estaban basados principalmente en resultados financieros hasta la actualidad, cuando la tendencia señala que la mayoría de estos modelos se acuerdan según resultados clínicos o de salud. La figura 1 muestra una clasificación que puede proporcionar una visión general de estos instrumentos4. En el primero de los casos (resultados financieros) destacarían los acuerdos precio-volumen y los presupuestos prospectivos con reembolso. Los acuerdos precio-volumen se basan en la idea de que el precio pagado por producto se determina a partir del número de unidades vendidas; en el caso de los presupuestos prospectivos con reembolso, si el volumen global del gasto es superior a un objetivo previamente determinado, las empresas comercializadoras devuelven parte de ese exceso, con varias modalidades de aplicación5.
Esquema de acuerdos de riesgo compartido4.
Sin embargo, los acuerdos de riesgo compartido basados en resultados en salud son los que han despertado más interés en los últimos años. Debido a que su evolución ha venido determinada por la casuística, no es fácil encontrar una clasificación única que permita «encajar» todas las experiencias existentes. El reembolso condicionado es un tipo de acuerdo mediante el cual la financiación de una innovación sanitaria viene determinada por un acuerdo temporal que se revisará teniendo en cuenta varios objetivos, y que determinará la continuación o no de la financiación. Dos pueden ser los principales objetivos de este reembolso condicionado: primero, financiar la última fase de investigación de una innovación, permitiendo que los pacientes tengan acceso a ella aun cuando no hay evidencia sólida de su efectividad en ese momento; y segundo, aceptar su financiación en aquellos casos en que la razón de coste-efectividad incremental (RCEI) asociada a la innovación frente a sus comparadores es superior a un umbral previamente determinado (p. ej., las 20.000–30.000 libras esterlinas por año de vida ajustado por calidad [AVAC] establecidas por el Nacional Institute for Health and Clinical Excellence [NICE] para Inglaterra y Gales6), bien en espera de recabar una mayor evidencia o bien condicionado a que un ajuste en el precio de la tecnología sanitaria permita que la RCEI esté más cercana al umbral de aceptabilidad establecido. Por último, los acuerdos de garantía de resultados, buque insignia de los acuerdos de riesgo compartido, persiguen que el pago de la tecnología sanitaria quede determinado por alcanzar los resultados en salud previamente consensuados. Son acuerdos en los que la empresa que comercializa la innovación, en función de la confianza que tiene en su producto, arriesga un porcentaje del reembolso negociado con el financiador sanitario en caso de que no se cumplan los resultados clínicos esperados. Normalmente, este tipo de acuerdos se dan en áreas terapéuticas donde hay un cierto número de productos que permiten tener comparadores y resultados bien definidos.
Más allá de la clasificación, hay diversas formas de implementación que permiten determinar si el pago se realiza a priori o a posteríori, o si el reembolso se produce en dinero o con productos (en especie), pero que al fin y al cabo no son más que modificaciones de los esquemas descritos.
Aplicaciones prácticasEl objetivo de este apartado es concretar con una serie de ejemplos la aplicación práctica de este tipo de acuerdos. A los lectores interesados en la revisión de una serie de casos más amplia se les remite a otras obras7,8.
Una de las experiencias más citadas en el campo de los acuerdos de riesgo compartido es el del bortezomib (Velcade®), un medicamento aprobado para el tratamiento de los pacientes con mieloma múltiple que han recibido previamente al menos dos tratamientos y presentan progresión de la enfermedad demostrada con el último de estos tratamientos. Si bien este fármaco demostró beneficios clínicos en comparación con el tratamiento tradicional, su RCEI se situaba entre las 33.000 y las 38.000 libras esterlinas por AVAC, por encima del umbral establecido por el NICE, lo que supuso, en octubre de 2006, su no recomendación y la petición de investigación adicional. La compañía farmacéutica, con el fin de facilitar el acceso del medicamento al mercado, propuso un acuerdo de riesgo compartido mediante el cual todos los pacientes que podrían recibir el tratamiento lo hicieran al precio acordado entre las partes a condición de que los que respondieran a los cuatro ciclos iniciales (indicado por una reducción del 50% de la proteína M) seguirían con él, pero a aquellos otros a quienes no ayudara a detener la progresión de la enfermedad se les interrumpiría el tratamiento y el financiador podría solicitar el reembolso de su coste9.
En el campo de los instrumentos terapéuticos y diagnósticos también hay experiencias de este tipo de acuerdos, especialmente en sistemas sanitarios públicos con amplia tradición evaluadora, como Canadá y Australia, y en sistemas de orientación privada como el de Estados Unidos. Por ejemplo, Oncotype DX™ es un sistema de diagnóstico genético para seleccionar candidatos a recibir quimioterapia adyuvante en el cáncer de mama, mediante la predicción de recurrencias y de la respuesta al tratamiento. Los resultados de este test tienen una implicación sobre la elección terapéutica para el paciente en función de sus resultados. En Estados Unidos fue financiado condicionalmente, tanto en el entorno sanitario público (por el Centro de Servicios para Medicare y Medicaid CMS) como por algunas de las principales aseguradoras privadas (Aetna, Cigna, UnitedHealthcare). La naturaleza y la metodología de estos acuerdos será revisada en función de la evidencia que debería generar la compañía. En este momento hay diversas fuentes que proporcionarán la evidencia necesaria para dichos acuerdos, entre las que destacan el ensayo clínico TAILORx10. El caso de PilCam™, una cápsula con una microcámara endoscópica que el paciente traga y permite obtener un diagnóstico para el sangrado gastrointestinal oscuro basado en la visualización de las lesiones, fue objeto de numerosas evaluaciones cuando salió al mercado hace unos años. El Medical Services Advisory Committee (MSAC) australiano aconsejó, en el año 2004, el reembolso condicionado a los resultados procedentes de nueva evidencia clínica generada prospectivamente, por lo que se realizó un registro entre los años 2004 y 2007 que incluyó datos de más de 4.000 pacientes, en función de los cuales, en noviembre de 2007, se aconsejó el reembolso definitivo del procedimiento11. En tal registro se observaron algunas dificultades logísticas para el desarrollo de este tipo de acuerdos, como la caída de la participación a medio plazo (la menor participación fue importante en el tercer año del estudio), quizás ligada a la voluntariedad de participación por parte de los pacientes; elemento, por otro lado, legalmente relevante.
El tratamiento del aneurisma aórtico abdominal había venido realizándose hasta finales de los años 1990 mediante cirugía abierta. A principios de la década de 2000 se publicaron diversos ensayos clínicos de una tecnología alternativa, el procedimiento endovascular para el tratamiento del aneurisma aórtico (EVAR) o técnica de reparación endovascular (TEV), que se asocia a una recuperación más rápida en el postoperatorio inmediato, con menores estancias en la unidad de medicina intensiva y menos días de ingreso hospitalario12. La controversia en torno al mantenimiento o no de estos resultados a largo plazo llevó a una profusión de evaluaciones de dicha tecnología13. Pese a que los ensayos clínicos aleatorizados disponibles en su momento destacaban resultados de mortalidad a corto plazo favorables al procedimiento EVAR, la incertidumbre de los resultados a largo plazo y la no significación estadística o la divergencia en algunos resultados de los principales estudios14,15 llevaron a diversas autoridades sanitarias a plantear políticas de reembolso condicionado a la demostración, en estudios a largo plazo, de los resultados obtenidos a corto plazo. Una vez verificados, se ratificó la financiación del procedimiento sin restricciones. Éste fue, por ejemplo, el caso de Canadá y Australia16–18. En España hubo una aproximación similar, ya que esta tecnología se incluyó en los programas de uso tutelado por el Instituto de Salud Carlos III, cuyos resultados, favorables al uso de la EVAR en determinadas condiciones (tipo de paciente y centro) han sido publicados recientemente19.
Volviendo al campo de los medicamentos, la empresa que comercializaba el rimonabant presentó en el año 2006 una solicitud de reembolso público ante la autoridad sanitaria sueca. Una de las características más relevantes del sistema de reembolso público de fármacos en Suecia es el uso de criterios de eficiencia (relación coste-efectividad) por parte del regulador público. El modelo de evaluación económica que presentó inicialmente la empresa comercializadora del fármaco utilizaba como comparadores un programa de dieta y ejercicio físico. El Comité de Beneficios Farmacéuticos (TLV/LFN) pidió una comparación entre el rimonabant y sus dos principales competidores: orlistat y sibutramina. En cada modelo se solicitó un análisis por subgrupos. Tras la recepción de esta nueva información, el TLV/LFN aconsejó el reembolso del rimonabant en los pacientes con diabetes mellitus de tipo 2 o dislipidemia que tuvieran un índice de masa corporal (IMC) de al menos 28kg/m2, y en aquellos sin comorbilidad pero con un IMC de al menos 35kg/m2. Dada la incertidumbre expresada por el comité sobre los efectos a largo plazo del medicamento, el reembolso se concedió por un plazo limitado a 2 años. Antes de que transcurriera este tiempo, la empresa debería aportar información adicional que demostrara la efectividad clínica y la seguridad en los pacientes tratados. Tras una prórroga de 1 año solicitada por la compañía para poder finalizar los estudios en curso, en octubre de 2008 la Agencia Europea del Medicamento (EMA) recomendó la suspensión de la autorización de comercialización del fármaco debido a que varios estudios señalaban problemas de seguridad. Pese a la interrupción del proceso antes de alcanzar su etapa final, el ejemplo ilustra la utilidad del uso de la evaluación económica en la valoración de un medicamento, y subraya la importancia de elegir el comparador más adecuado y considerar los subgrupos de pacientes que más se benefician de su prescripción. Ante una situación de gran incertidumbre, el reembolso del medicamento se condicionó a una reevaluación ex post con datos de pacientes seguidos durante un tiempo convenido20.
Sin agotar la lista de experiencias, uno de los ejemplos más interesantes de acuerdo de riesgo compartido es el del uso de interferón beta y acetato de glatirámero para el tratamiento de la esclerosis múltiple. Tras el anuncio del NICE de que estos tratamientos ofrecían unos malos resultados en términos de eficiencia (elevados RCEI), el ministerio de salud firmó un acuerdo con las compañías farmacéuticas para que éstas redujeran su precio hasta alcanzar un umbral de coste-efectividad aceptable. El acuerdo fijó un periodo de vigencia de 10 años, y los precios subirán o bajarán según la efectividad alcanzada. Desde el inicio este acuerdo fue criticado en la literatura21, argumentando que el dinero invertido en él podía haberse utilizado de modo más apropiado (p. ej., financiando un ensayo clínico para comparar estos tratamientos con azatrioprina, fármaco mucho más barato). Un evaluación reciente22 ha señalado el éxito de reclutamiento del tratamiento, aunque también apuntó alguno de los puntos clave a mejorar (análisis de datos, conflictos de intereses, etc.). Asimismo, el artículo de Boggild et al23 ofrece una descripción detallada del proceso seguido entre el inicio del acuerdo de riesgo compartido y una evaluación intermedia. Los resultados son interesantes en el sentido de que se muestran las debilidades de este tipo de acuerdos sobre el terreno real: pérdidas de pacientes seguidos a largo plazo, indefinición inicial sobre la eficiencia de la medicación, dudas sobre cómo reconducir el análisis ante la entrada de nuevas opciones terapéuticas, qué decisiones tomar y a través de qué canales si los resultados no son tan buenos como los esperados (¿continuar con el estudio y el acuerdo de riesgo compartido o abandonar? ¿en qué elementos fiar de antemano la decisión de abandonar la financiación de la tecnología? ¿lo decide el NHS o los investigadores independientes?, etc.). En suma, este trabajo alerta sobre la utilización de acuerdos de riesgo compartido en tratamientos cuyos efectos sólo se pueden observar a largo plazo y para los que no se puede disponer de grupo de control.
El papel de los distintos actores en los acuerdos de riesgo compartidoLos acuerdos de riesgo compartido suponen un nuevo marco de relación diferente al establecido hasta el momento24–26. Sin duda alguna, para facilitar la implantación de este tipo de experiencias se requerirá desarrollar un marco colaborativo más flexible que favorezca la consideración de los esquemas descritos entre las partes implicadas.
Desde un punto de vista operativo, también sería necesario potenciar estructuras que faciliten los análisis y la monitorización que estos acuerdos requieren; es decir, sistemas de información en la administración sanitaria que permitan una mejor evaluación y compatibilidad real de diferentes bases de datos (historia clínica informatizada, alta hospitalaria, registros de mortalidad, incapacidad, prestación farmacéutica, costes sanitarios, información sobre pruebas diagnósticas provenientes de diferentes entornos asistenciales…).
Los procesos de descentralización sanitaria llevados a cabo en España en los últimos años han conformado un escenario en el cual las comunidades autónomas han ido ganando capacidad de gestión y responsabilidad. No obstante, aunque las competencias de las comunidades en materia de gestión de la prestación farmacéutica se han centrado en la aplicación de elementos de gestión de la oferta27, dos elementos fundamentales que componen el gasto farmacéutico, como son la cartera de productos y el precio de éstos, han quedado excluidos de sus competencias.
Está claro que los gobiernos regionales desean tener un mayor protagonismo en el conjunto del proceso, ya que en ellos recae el esfuerzo financiador de la prestación. Los acuerdos de riesgo compartido pueden suponer un escenario piloto de mayores cuotas de participación en las responsabilidades financieras de las comunidades autónomas, en especial si tenemos en cuenta que la necesidad de coordinación entre niveles asistenciales y la información de calidad basada en los datos clínicos y los resultados que se generen en la evaluación de los acuerdos de riesgo compartido requerirán su participación activa. Dicho de otro modo, tanto las entidades prestadoras de servicios (hospitales, centros de atención primaria, unidades clínicas…) como los financiadores que se involucrarán en los acuerdos de riesgo compartido pertenecen a los ámbitos de gestión de las comunidades autónomas y, por lo tanto, su vinculación al desarrollo de este tipo de acuerdos sería deseable para facilitar la coordinación requerida.
Las comunidades autónomas ya han manifestado en varias ocasiones que estos nuevos instrumentos de financiación pueden utilizarse en su ámbito. Jurídicamente, dos pueden ser los principales argumentos a esgrimir: el artículo 88 de la Ley General de Uso Racional de los Medicamentos y Productos Sanitarios, que permite a las comunidades medidas de racionalización, y el artículo 90, que señala que el precio fijado a nivel central es el «precio industrial máximo», lo que puede entenderse como una «puerta abierta» a precios inferiores basados en este tipo de acuerdos. Técnicamente, algunas comunidades autónomas han establecido un conjunto de comités (la Comisión de Evaluación Económica e Impacto Presupuestario [CAEIP] en Cataluña28,29 o el Comité de Armonización de los Criterios de Utilización de Medicamentos en Andalucía, entre otras) que, según sus decisiones, pueden propiciar este tipo de acuerdos.
En este sentido, lo mismo ha sucedido con los centros hospitalarios, gerencias y otros organismos de la administración autonómica que han desarrollado estrategias de control y gestión de los servicios que prestan: a) concursos centralizados o establecimiento de centrales de compra: acción sobre determinados productos hospitalarios (especialmente fármacos de alto coste); b) concursos de determinación de tipo de ámbito regional para dispositivos y tecnologías sanitarias; c) comisiones de evaluación de medicamentos regionales y comisiones asesoras de prestaciones también de ámbito regional; d) generalización de comisiones de farmacia; e) comisiones gestoras regionales para determinados tratamientos en Galicia y Andalucía; f) programas de evaluación de la utilización de determinados productos sanitarios en centros específicos y bajo condiciones de evaluación o investigación (llevados a cabo por agencias de evaluación de tecnologías).
Así, los concursos de compras centralizadas en las comunidades autónomas, si bien han tenido un desarrollo importante en los últimos años ligado a la compra selectiva de determinados tratamientos innovadores, han venido siendo un procedimiento ampliamente utilizado para otros tipos de medicamentos (vacunas) y productos sanitarios (pañales de incontinencia, tiras reactivas para autodeterminación de glucosa capilar…). La extensión y el desarrollo de estas estrategias, con mayor implicación de las comunidades autónomas y de los centros asistenciales, así como la incorporación de la medición de resultados clínicos en dichos acuerdos, abren expectativas que pueden involucrar en mayor medida a estas administraciones en la gestión de las prestaciones y la cartera de servicios sanitarios. Un ejemplo podría ser el desarrollo de nuevos esquemas de acceso en enfermedades raras (baja incidencia, alto coste, necesidad de nuevos tratamientos y escasez de profesionales entrenados para su tratamiento) o a tratamientos de alta complejidad, cuando las condiciones de aplicación de los acuerdos de riesgo compartido serían más sencillas y sería más fácil un mayor compromiso en la búsqueda de alternativas de los distintos agentes, por ser un área que está en la agenda política sanitaria y en la cual hay además un claro interés de desarrollo de nuevos productos y de su incorporación al arsenal terapéutico. Por otro lado, las propias características de estas enfermedades llevarían a concentrar la aplicación y el seguimiento de tales acuerdos en un número limitado de «centros de excelencia» consensuados por las partes, donde se desarrollaría el conocimiento acerca de la aplicación en la práctica clínica real, y conllevaría un mayor protagonismo de los centros y las administraciones regionales, pero siempre basándose en una coordinación sanitaria desde la administración central que asegurara la equidad de acceso.
Asimismo, es importante señalar que en el ámbito hospitalario las actuaciones de los comités de evaluación terapéutica y las diversas formas de gestión han dado lugar a procesos de negociación en que los acuerdos de precio-volumen, forma «primitiva» de acuerdos de riesgo compartido, han sido sus previsibles resultados. La opacidad de estas decisiones, común en Europa, nos ha privado de conocer con detalle tales experiencias. Sin embargo, el papel de los hospitales en los acuerdos de riesgo compartido basados en resultados será clave como gestores, no sólo en el ámbito terapéutico sino también en el de la transparencia.
En suma, las autoridades regionales y los gestores sanitarios, más allá de cambios o reducciones de las condiciones planteadas en los acuerdos de riesgo compartido globales establecidos de ámbito nacional, estarían llamados a desempeñar una importante función en su puesta en práctica, en su registro e implementación operativa en las entidades asistenciales (hospitales, centros de primaria, etc.) y en facilitar su verificación.
Desde el punto de vista de las empresas comercializadoras de innovaciones sanitarias, los acuerdos de riesgo compartido pueden suponer fórmulas más flexibles de acceso a tratamientos innovadores en áreas con necesidades clínicas no cubiertas. Asimismo, se pueden establecer lazos de cooperación con el financiador sanitario en indicaciones acordadas y avaladas por la evaluación en la práctica clínica real, y colaborando en la búsqueda de fórmulas que garanticen el equilibrio entre el retorno de la inversión en innovación tecnológica y la sostenibilidad del sistema sanitario a largo plazo. Ello supone desarrollar cauces de colaboración de forma coordinada y más eficiente en la generación de conocimiento sobre los resultados de las nuevas tecnologías en la práctica asistencial real, en una situación en la cual los productos están financiados (al menos de forma parcial o condicional).
Por su parte, los profesionales sanitarios y los pacientes pueden verse beneficiados de tener un acuerdo protocolizado de antemano sobre las prácticas de prescripción/utilización bajo las cuales es razonable emplear la tecnología considerada, lo cual permite el acceso al tratamiento a las personas que potencialmente más se beneficiarían de él y reduce la incertidumbre sobre su resultado, al menos en términos comparativos frente a la inexistencia del acuerdo.
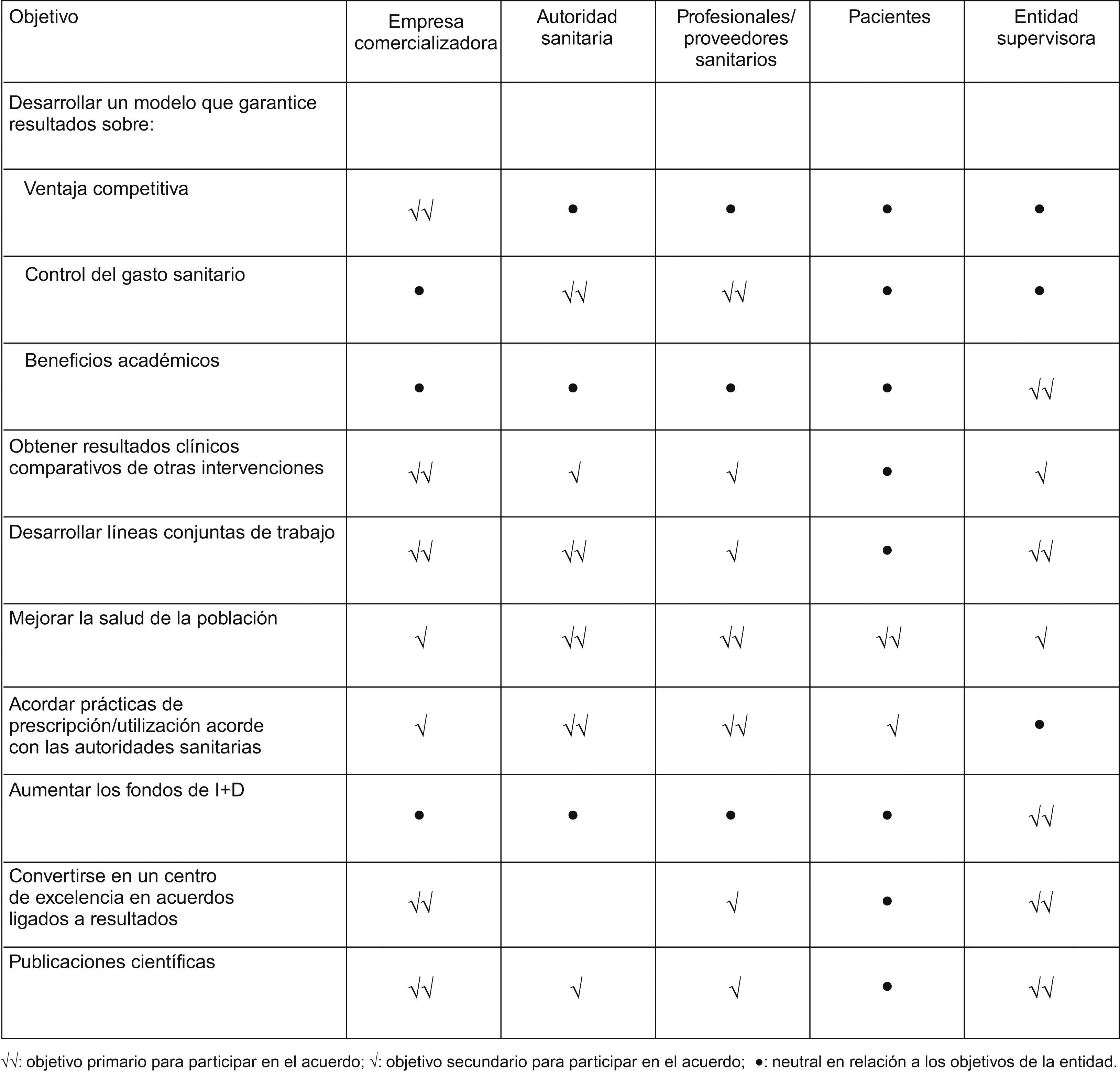
Los acuerdos de riesgo compartido presentan posibles ventajas para los agentes participantes. En este sentido, todos los agentes implicados pueden ganar con la aplicación de este tipo de acuerdos en la introducción de una tecnología sanitaria concreta (estrategia tipo win-win). No obstante, resulta claro que los objetivos de los distintos actores no siempre coinciden (tabla 1). Por tanto, un acuerdo de riesgo compartido sólo resultará atractivo si es capaz de alinear los incentivos de los diferentes agentes implicados en la búsqueda de objetivos comunes. Para ello resultará clave considerar que este tipo de acuerdos no son aplicables en cualquier marco, y que requieren contemplar una serie de condicionantes.
Objetivo de los agentes implicados en un acuerdo de riesgo compartido7.
En primer lugar30, el problema para el cual se diseña el acuerdo de riesgo compartido debe estar claramente especificado. En segundo lugar, los objetivos del acuerdo de riesgo compartido deben ser establecidos de forma clara y objetiva, detallando las obligaciones y los cometidos de cada una de las partes involucradas. En tercer lugar, los objetivos planteados deben guiar el diseño del estudio de seguimiento; para ello será clave la elección de las medidas de resultado a emplear. En cuarto lugar, el diseño del acuerdo de riesgo compartido debe considerar las características organizativas y los objetivos del sistema sanitario en que se implementa. En quinto lugar, debe asegurarse que en el seguimiento y la evaluación del acuerdo de riesgo compartido los intereses de las partes implicadas no afectarán al resultado, y por tanto éstos no deben quedar en manos exclusivas de una de las partes interesadas. Asimismo, hay que establecer claramente los principales indicadores de resultado en que se basará la evaluación de la experiencia. Aunque parecen cuestiones básicas, lo cierto es que si no se cumplen estas premisas mínimas el objetivo principal de un acuerdo de riesgo compartido, que es la reducción de la incertidumbre de los agentes, quedaría seriamente comprometido.
Los posibles riesgos de generalizar este tipo de acuerdos serían incurrir en una excesiva burocracia en el acceso a las innovaciones sanitarias, en una primera fase, pero también que las empresas comercializadoras de las innovaciones ajustaran los precios al alza en espera de suscribir estos acuerdos con la entidad financiadora31, lo cual restaría atractivo a estos esquemas.
Junto a lo ya comentado, otros elementos clave a tener en cuenta son que este tipo de acuerdos son costosos de implementar, debido tanto al tiempo y el esfuerzo invertidos en su diseño como a los recursos destinados a su supervisión y evaluación. Por tanto, no son acuerdos extrapolables a todas las tecnologías sanitarias y hay que ser cuidadoso con los criterios generales que orienten su realización en tipo y número. Asimismo, el desarrollo a corto y medio plazo de los sistemas de información sanitaria, integrando información económica y clínica, será muy importante para que este tipo de experiencias se consideren atractivas o, por el contrario, prohibitivas por su elevado coste32. Otro elemento a considerar será la cultura del entorno en que se desarrolle el acuerdo de riesgo compartido. Cuanto mayor sea el apoyo regulatorio y político recibido, y allí donde la evaluación de resultados será una parte aceptada en el proceso de adopción de innovaciones sanitarias, este tipo de herramientas tendrá más visos de éxito. Un elemento más a considerar es que el propio proceso es un elemento valorable per se. Es decir, asegurar la legitimidad del procedimiento, dando participación y voto a las partes implicadas (tabla 1) de manera transparente, puede resultar clave para la normalización de este tipo de herramientas.
ConclusionesEs bien conocido que las decisiones iniciales sobre el precio, la financiación y la indicación se toman en el momento en que la información sobre la efectividad y la seguridad es más precaria. El riesgo de utilizar contratos basados en la fijación del precio no orienta el uso a una utilización adecuada, mientras que acuerdos basados en el volumen no aseguran que los pacientes tratados sean aquellos que más se pueden beneficiar del tratamiento.
En un marco de información asimétrica, se supone que la empresa comercializadora de la potencial innovación dispone de mejor información para valorar adecuadamente su producto. Por ello, un financiador racional podría condicionar su decisión a la aportación de información posterior que confirme en pacientes reales las previsiones iniciales de eficacia y seguridad. Los acuerdos de riesgo compartido pueden ser una herramienta útil si el modelo de financiación de servicios sanitarios quiere dejar atrás modelos de tipo «pagar por ser» (estructura), trascender los modelos de tipo «pagar por hacer» (proceso) y transitar hacia un modelo de «recompensar por conseguir» (resultados). Ello también genera, por una parte, incentivos a la innovación al disponer de unas reglas del juego más claras, y por otra incentivos a que la empresa oriente su campaña de promoción hacia aquellos pacientes en quienes la prescripción/utilización de la tecnología considerada genere una mejor relación coste-beneficio.
Por tanto, es importante comprender que, por una parte, los acuerdos de riesgo compartido no deben ser una herramienta para minimizar costes ni un esquema de las empresas para acceder al mercado sorteando otras barreras, y por otra, que estas medidas no están orientadas sólo a regular el precio sino también a actuar sobre la adecuación de la utilización, puesto que alejarse de las indicaciones inicialmente aprobadas puede empeorar en gran medida la relación coste-efectividad de la innovación y, con ello, cuestionar las conclusiones de las evaluaciones presentadas en el momento de negociar el acuerdo.
Los acuerdos de riesgo compartido pueden resultar una herramienta de utilidad para mejorar la eficiencia de las políticas de acceso a los mercados de ciertas innovaciones sanitarias. No obstante, la evidencia empírica disponible aún es escasa. Por ejemplo, en la revisión de Stafinsky et al8 sobre 58 casos revisados, en 47 el estudio de seguimiento no había finalizado o bien no se disponía de información sobre las implicaciones que supuso la evaluación del acuerdo para la toma de decisiones final. Por ello, es ciertamente pronto para opinar sobre los resultados de la aplicación real de este tipo de acuerdos2. Si se trata de una moda pasajera o de un mecanismo que se aceptará de manera natural en el proceso de toma de decisiones, es una cuestión por determinar.
Contribuciones de autoríaLos tres autores han participado en la idea, la discusión sobre el diseño del artículo, la elección de los ejemplos, la redacción y las conclusiones a partes iguales.
FinanciaciónLos autores no se han beneficiado de ninguna financiación pública o privada para la realización de este artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores desean agradecer los valiosos comentarios recibidos de dos evaluadores anónimos.