Se detalla una propuesta doble para crear, organizar y desarrollar, de forma secuencial, dos organizaciones responsables de la evaluación de la eficiencia de tecnologías y políticas sanitarias en España, y el diseño que podrían tener. Serían una pieza clave en un proceso de reformas organizativas en el Sistema Nacional de Salud. La primera, que podría ser de inmediata adopción, se denominaría Oficina de Evaluación de la Eficiencia de los Medicamentos, sería un órgano funcionalmente independiente adscrito a la Agencia Española de Medicamentos y Productos Sanitarios, y se circunscribiría a la evaluación de la eficiencia de los medicamentos. La segunda, llamada Comisión Nacional de Evaluación en el Ámbito de la Salud, se configuraría como autoridad administrativa independiente y evaluaría las tecnologías y posiblemente las políticas públicas sanitarias. La independencia funcional, la suficiencia de medios y su anclaje sobre valores de buen gobierno son las características definitorias de esta doble propuesta.
We describe in detail a twofold proposal for the creation, organization and sequential development of two bodies responsible for evaluating the efficiency of health technologies and policies in Spain and its possible design. It would constitute a key element in the process of re-organising the National Health System. The first, which could be adopted immediately, would be called the Office for the Evaluation of the Efficiency of Medicines, would be attached to the Spanish Agency for Medicines and Medical Devices as a functionally independent body and limited to evaluating the efficiency of medicines. The second, the National Health Evaluation Commission, in the form of an independent administrative body, would evaluate health technologies and possibly public health policies. Functional independence, adequate resources and anchoring in the values of good governance are the defining characteristics of this dual proposal.
En España, desde distintos ámbitos profesionales, científicos e incluso institucionales, en los últimos años se ha demandado la reforma de la regulación y de la organización de la evaluación de la eficiencia de tecnologías sanitarias1–9. Una de las propuestas específicas más repetidas es la creación de una agencia independiente encargada de incorporar la dimensión de la eficiencia en los procesos evaluativos. Sin embargo, hasta ahora no se han detallado sus características concretas, ni cuál sería el alcance de su independencia. ¿Es esta propuesta disparatada o imposible de alcanzar en la situación actual? El objetivo de este artículo es mostrar que es posible, mostrando la factibilidad de una doble propuesta organizativa. Los lectores interesados en profundizar en los detalles de la propuesta pueden ampliar la información aquí expuesta acudiendo a tres Notas Técnicas de FUNCAS publicadas recientemente10–12.
Situación actualLa evaluación de la eficiencia de tecnologías sanitarias (balance entre el coste y el valor terapéutico o social de una intervención frente a su mejor alternativa) ha sido poco empleada en España por las Administraciones públicas, en especial en el caso de los medicamentos, a pesar de que su utilidad ha sido ampliamente debatida y admitida10. Es verdad que los estudios de evaluación de la eficiencia de tecnologías sanitarias han aumentado e involucrado a un número creciente de agentes, públicos y privados, con debates y retos metodológicos similares a los vividos en otros países avanzados, pero quedamos lejos de los mejores en normativa y definición de procesos suficientes y claros, organización, coordinación y recursos para su aplicación a la toma de decisiones13.
Diversos obstáculos han contribuido a dicha situación, como son la separación entre la evaluación de medicamentos y las demás tecnologías sanitarias, las complejidades de un Estado autonómico y la confusa «desorganización» de una variada constelación de instituciones, organismos, órganos, unidades y redes, con un Ministerio de Sanidad al frente que presenta importantes limitaciones e insuficiencias generalizadas de medios y personal11. Para el resto de las tecnologías sanitarias ha habido una estrategia más clara y se ha generado valiosa información sobre eficiencia para los decisores14, mientras que en el caso de los medicamentos su regulación (fragmentada, asistemática, discontinua, parcial e insuficiente)10 y las carencias del marco organizativo han sido obstáculos casi insuperables. En los últimos años ha habido intentos en la buena dirección (Plan para los Informes de Posicionamiento Terapéutico, REvalMED, etc.), pero naufragaron por falta de base legal y material.
Antecedentes organizativosPara caracterizar la nueva entidad evaluadora se ha recurrido a las valiosas enseñanzas de la experiencia de organismos de otros países, como el Pharmaceutical Benefits Advisory Committee australiano, la Canadian Agency For Drugs and Technologies in Health, el National Institute for Health and Care Excellence (NICE) inglés, la Haute Autorité de Santé (HAS) francesa, o la INFARMED (Autoridade Nacional do Medicamento e Produtos de Saúde) portuguesa11. Igualmente, se analizaron las diferentes modalidades organizativas previstas en nuestra legislación y la riqueza de casos desarrollados en España. Buenos ejemplos pueden encontrase en el ámbito sanitario, como la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) o la Agencia de Seguridad Alimentaria y Nutrición (AESAN, que tiene un diseño organizativo de gran interés), y en otros entornos públicos, como los Tribunales Administrativos de Contratación (TACRE), la Oficina Independiente de Regulación y Supervisión de la Contratación, la Comisión Nacional de los Mercados y la Competencia (CNMC), o la Autoridad Independiente de Responsabilidad Fiscal (AIReF), todos ellos destacables por su independencia.
Además de estos antecedentes, se sigue el patrón que ofrecen los elementos generalmente aceptados del buen gobierno para que la entidad evaluadora tenga credibilidad. Como resultante, se definen las dimensiones vertebradoras de la organización de la agencia evaluadora: objetivo, ámbito de actuación, funciones a desempeñar, configuración orgánica y funcional, estructura interna, estatuto de medios personales, régimen de los medios materiales, económicos y presupuestarios, y apoyos técnicos externos12.
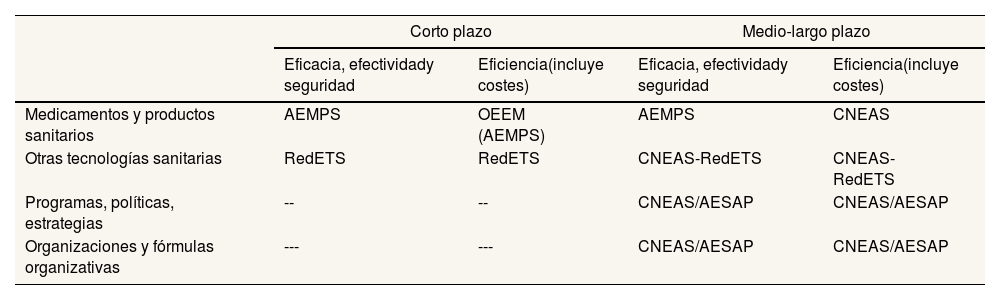
La propuestaA partir de las dimensiones señaladas puede articularse una propuesta organizativa factible y sensata en dos etapas. Cabría crear primero una Oficina de Evaluación de la Eficiencia de los Medicamentos (OEEM), como órgano funcionalmente independiente adscrito a la AEMPS, fácil de instaurar en el corto plazo y que abriría el camino. En un escenario a medio y largo plazo se crearía, necesariamente por ley, una Comisión Nacional de Evaluación en el Ámbito de la Salud (CNEAS), una agencia evaluadora potente, la cual absorbería a la OEEM y se configuraría específicamente como «autoridad administrativa independiente» de las reconocidas por la Ley de Régimen Jurídico del Sector Público. La elección es importante, pues la organización condiciona el desarrollo de las funciones y el éxito de las políticas públicas. Ambas organizaciones tendrían un mismo fin: generar información de utilidad para dar fundamentación científica y técnica a la toma de decisiones. En el corto plazo, el objetivo de la OEEM sería la eficiencia y su ámbito de actuación serían los medicamentos. A medio y largo plazo, la CNEAS, en una primera opción, podría abarcar los dos posibles objetivos (eficacia y seguridad, y además eficiencia) y cubrir los ámbitos de las tecnologías y las políticas públicas de salud, e incluso las organizaciones sanitarias. La AEMPS, dada su fortaleza, seguiría haciendo la evaluación clínica de eficacia, efectividad y seguridad de medicamentos y productos sanitarios. La tabla 1 recoge estas posibilidades. Una segunda opción sería restringir el ámbito de la CNEAS a medicamentos, productos sanitarios y otras tecnologías sanitarias, y que su objetivo fuera la eficiencia.
Propuesta de organización de la evaluación en el ámbito de la salud
| Corto plazo | Medio-largo plazo | |||
|---|---|---|---|---|
| Eficacia, efectividady seguridad | Eficiencia(incluye costes) | Eficacia, efectividady seguridad | Eficiencia(incluye costes) | |
| Medicamentos y productos sanitarios | AEMPS | OEEM (AEMPS) | AEMPS | CNEAS |
| Otras tecnologías sanitarias | RedETS | RedETS | CNEAS-RedETS | CNEAS-RedETS |
| Programas, políticas, estrategias | -- | -- | CNEAS/AESAP | CNEAS/AESAP |
| Organizaciones y fórmulas organizativas | --- | --- | CNEAS/AESAP | CNEAS/AESAP |
AEMPS: Agencia Española de Medicamentos y Productos Sanitarios; AESAP: Agencia Estatal de Salud Pública (en proyecto de ley); CNEAS: Comisión Nacional de Evaluación en el Ámbito de la Salud (organismo de nueva creación propuesto); OEEM: Oficina de Evaluación de la Eficiencia de los Medicamentos (organismo de nueva creación propuesto); RedETS: Red de Evaluación de Tecnologías Sanitarias.
La ventaja de la OEEM es su sencillez organizativa, una mayor economía de medios y unos requisitos normativos más simples. La OEEM podría ser funcional en un breve plazo, lo cual no es factible con la CNEAS. No obstante, resulta poco coherente que los medicamentos y otras tecnologías sanitarias sigan procesos de evaluación tan diferentes y no se aprovechen recursos que podrían ser comunes. Es claro que la CNEAS presenta un potencial evaluativo superior a la OEEM, y su misión, objetivos y medios disponibles así lo deberían reflejar. Cualesquiera que acaben siendo sus actuaciones, sería esencial la coordinación con otros agentes públicos afines, como la RedETS (p. ej., inclusión de la información sobre eficiencia en las guías de práctica clínica) y la esperada Agencia Estatal de Salud Pública (evaluación de políticas de salud pública de amplio alcance en materia de consumo de drogas, obesidad, etc.), o la propia AIReF (evaluación de organizaciones sanitarias, copago, etc.).
En todos los casos, habría que asegurar la plena independencia funcional de la entidad en sus tareas técnicas de evaluación, tanto respecto a intereses privados particulares como respecto a otras entidades públicas y al interés político. Recíprocamente, los decisores políticos podrían apartarse con motivación justificada de las recomendaciones técnicas del evaluador. Esto exige la separación clara y explícita de los procesos evaluadores y los de decisión. Esta separación, además de ser condición necesaria de la autonomía, facilita la adopción de decisiones impopulares y dificulta las de cariz populista, si vienen apoyadas por un dictamen técnico independiente y creíble.
Para garantizar la competencia técnica de los estudios y dictámenes, y la independencia en todas sus dimensiones, el estatuto de directivos y personal debería regular de forma exigente las condiciones de acceso (convocatorias abiertas y competitivas, con requisitos de idoneidad y criterios de mérito y capacidad); la duración prolongada, pero limitada, del mandato y la inamovilidad en el cargo de los directivos, salvo causas objetivas; la estabilidad en el puesto de los técnicos, así como las incompatibilidades, la declaración de intereses y un código de conducta.
Otro elemento fundamental será definir correctamente la naturaleza jurídico-organizativa para asegurar su independencia y disponer de una estructura interna adecuada que permita un funcionamiento eficaz. En este sentido, la OEEM sería un sencillo órgano administrativo inserto en la AEMPS, mientras que la CNEAS, como autoridad administrativa independiente, contaría con personalidad jurídica, personal, medios materiales y presupuestarios propios, y una cierta complejidad organizativa. Ambas serían entidades colegiadas. Su política de recursos humanos debería ser capaz de atraer a suficientes profesionales formados con retribuciones competitivas, carrera profesional atractiva y otros incentivos, como facilitar su formación continuada. Todos estarían sometidos a evaluación periódica y transparente de su desempeño. Dada la alta especialización de las tareas, la agencia evaluadora debe contar con un consejo asesor científico y una red de expertos externos reconocidos. Nada de esto es posible sin la dotación de medios económicos adecuados, entre ellos tasas por prestación de servicios a las empresas solicitantes, con garantías de dotación presupuestaria suficiente, incluida la vinculación de dichas tasas al organismo.
Hay otras garantías indispensables para el buen gobierno de estas entidades evaluadoras. La primera de ellas es la participación de los agentes interesados en los procesos evaluativos15. Esto incluiría tanto a las propias empresas con interés en comercializar la tecnología sanitaria como a sociedades científicas, asociaciones de pacientes o representantes de los propios órganos de decisión de la Administración sanitaria para la cual se genera la información, sin agotar la lista. Contar con distintos puntos de vista puede aportar riqueza en el proceso deliberativo y en las fases iniciales del proceso de evaluación; sin embargo, dada la presencia de conflictos de intereses de distinta naturaleza en los agentes citados, su forma de participación en los procesos debería estar reglamentada y quedar claro para todas las partes que las aportaciones deben valorarse basándose en criterios científicos y técnicos. Otro elemento que debe garantizarse es la transparencia, tanto de la información estructural (selección de sus órganos directivos y científicos, personal, colaboración con expertos externos, presupuesto y medios económicos, etc.) como de sus actividades (publicación de estudios, procesos y resultados de las evaluaciones, herramientas metodológicas, participación, etc.). Asimismo, debe estar presente como garantía la rendición de cuentas de la agencia creada ante la sociedad, sobre sus actividades, procedimientos y cumplimiento de objetivos.
Consideraciones finalesEsta es una propuesta ambiciosa, pero factible, como nos muestra el ejemplo exitoso de otras entidades públicas nacionales en otros sectores (TACRE, CNMC, AIReF), así como de entidades evaluadoras sanitarias de distintos países. La creación de una agencia de estas características debería contemplarse más como una inversión que como un gasto, ya que el coste social de oportunidad de no evaluar la eficiencia de medicamentos, otras tecnologías sanitarias, organizaciones y políticas de salud es muy alto16. Asimismo, la creación de estructuras como las propuestas transmitiría una señal clara sobre valores de buen gobierno a extender al resto del Sistema Nacional de Salud (SNS) y otras esferas de las Administraciones públicas. En último término, debe tenerse presente que generar la información necesaria para incorporar la eficiencia a las decisiones no es condición suficiente para garantizar la sostenibilidad del SNS, pero seguir ignorándola sin duda incrementa su deslizamiento hacia la insolvencia.
Contribuciones de autoríaLos autores declaramos que todos somos responsables en igual medida de la concepción y el diseño del estudio; J. Oliva realizó el primer borrador del artículo; F. Lobo y J. Vida revisaron el texto y realizaron contribuciones intelectuales relevantes; todas las partes que integran el artículo fueron revisadas y debatidas entre todos con la finalidad de que sean expuestas con la mayor precisión e integridad, y todos aprobamos la versión final del artículo.
AgradecimientosLos autores agradecemos los estimulantes comentarios recibidos en el proceso de evaluación del artículo.
FinanciaciónNinguna.
Conflictos de interesesNinguno.