Describir los cánceres de intervalo y la sensibilidad de los programas de cribado de cáncer colorrectal.
MétodosRevisión sistemática de la literatura con búsqueda en MEDLINE. La estrategia de búsqueda combina los términos ‘cáncer de intervalo’, ‘falso negativo’, ‘cribado’, ‘cribado poblacional’, ‘detección precoz de cáncer’ y ‘cáncer colorrectal’. Los criterios de inclusión fueron programas poblacionales de cribado de cáncer colorrectal, artículos originales en inglés o español, y fechas de publicación comprendidas entre enero de 1999 y febrero de 2015. Se realizó una síntesis narrativa de los artículos incluidos, detallando las características de los programas de cribado y de los cánceres de intervalo, y la sensibilidad del cribado utilizando como indicador el número de cánceres detectados mediante el cribado dividido por el total de tumores diagnosticados en la población cribada (método tradicional) o la incidencia proporcional, calculada como la incidencia de cánceres de intervalo en relación con la incidencia esperada en ausencia de cribado.
ResultadosSe incluyeron 13 artículos. La sensibilidad de los programas de cribado osciló entre el 42,2% y el 65,3% en los programas que utilizan el test del guayaco, y entre el 59,1% y el 87,0% con el test inmunológico. Se ha encontrado una mayor proporción de mujeres a las que se diagnosticó un cáncer de intervalo, y que estas lesiones estaban mayoritariamente localizadas en el colon proximal.
ConclusiónExiste una gran variabilidad en la proporción de cánceres de intervalo en los programas poblacionales de cáncer colorrectal. Para garantizar la comparabilidad entre programas, es necesario un consenso en la definición operacional de cánceres de intervalo y en los métodos utilizados para su identificación y cuantificación.
To describe interval cancers (IC) and the sensitivity of colorectal cancer (CRC) screening programmes.
MethodsA systematic review of the literature was conducted through a MEDLINE (PubMed) search. The search strategy combined the terms ‘interval cancer’, ‘false negative’, ‘mass screening’, ‘screening’ ‘early detection of cancer’, ‘colorectal cancer’ and ‘bowel cancer’. Inclusion criteria consisted of population-based screening programmes, original articles written in English or Spanish and publication dates between 1999/01/01 and 2015/02/28. A narrative synthesis of the included articles was performed detailing the characteristics of the screening programmes, the IC rate, and the information sources used in each study.
ResultsThirteen articles were included. The episode sensitivity of CRC screening programmes ranged from 42.2% to 65.3% in programmes using the guaiac test and between 59.1% and 87.0% with the immunochemical test. We found a higher proportion of women who were diagnosed with IC and these lesions were mainly located in the proximal colon.
ConclusionThere is wide variability in the IC rate in CRC programmes. To ensure comparability between programmes, there is a need for consensus on the working definition of IC and the methods used for their identification and quantification.
La detección precoz del cáncer colorrectal se considera una de las estrategias de prevención secundaria del cáncer más adecuadas. La identificación y la resección de lesiones premalignas evita la progresión a cáncer colorrectal1 y con ello se reduce la incidencia de este cáncer. El diagnóstico en estadios más precoces facilita el tratamiento y mejora el pronóstico, lo que contribuye a una reducción de la mortalidad. En este sentido, tanto el test de sangre oculta en heces (TSOH) como la sigmoidoscopia han demostrado su eficacia2,3. Los programas poblacionales de cribado de cáncer colorrectal se han extendido por la mayoría de los países desarrollados, y el TSOH es el método utilizado mayoritariamente4.
Sin embargo, no sólo es imprescindible disponer de pruebas de la eficacia del TSOH antes de generalizar su uso, sino que hay que garantizar que la gestión del programa mantiene el equilibrio entre beneficios y perjuicios contrastado experimentalmente5. La relación entre beneficios y riesgos depende de la calidad del cribado6, y el indicador principal de calidad de un programa de cribado es su capacidad para identificar los tumores en fase precoz, es decir, su sensibilidad7.
Se considera cáncer de intervalo a los tumores diagnosticados clínicamente: 1) después de un resultado negativo en el episodio de cribado (por ejemplo, TSOH negativo o bien TSOH positivo y colonoscopia negativa) y antes de la siguiente invitación al cribado; 2) después de un test positivo con colonoscopia con hallazgo de lesiones (adenomas) y antes de la siguiente prueba de seguimiento o vigilancia.
Los cánceres de intervalo en el cribado del cáncer colorrectal pueden deberse a un resultado falso negativo en la prueba de cribado o en las pruebas de confirmación diagnóstica (cáncer o adenoma no detectado), a la resección incompleta de un adenoma, o bien al desarrollo de un cáncer de novo, un tumor de crecimiento rápido8. No obstante, a la luz del conocimiento actual de la evolución natural del cáncer colorrectal, es poco probable que en el intervalo entre dos rondas de cribado se desarrolle un cáncer9.
Para poder comparar la frecuencia de cánceres de intervalo entre distintos programas deben considerarse dos aspectos clave: 1) la definición de cáncer de intervalo, que depende de los criterios de inclusión, los cuales varían en función de las características del tumor (cánceres in situ o cánceres invasivos), de la definición de participación en el cribado (por ejemplo, si se consideran participantes o no los individuos con un resultado inconcluyente) y del tiempo de seguimiento; y 2) la identificación de caso, que se relaciona con el seguimiento de la población cribada y con la existencia de fuentes de datos de calidad10.
Respecto a las fuentes de información, los cánceres no diagnosticados en el cribado pueden identificarse idealmente a través de un registro de cáncer. En las zonas donde no existe un registro de cáncer, una alternativa puede ser comprobar los registros de altas hospitalarias.
El objetivo del presente trabajo es describir los cánceres de intervalo identificados en programas poblacionales de cribado del cáncer colorrectal a través de una revisión sistemática de la literatura.
Material y métodosSe consultó la base de datos MEDLINE (PubMed) y se plantearon diferentes estrategias de búsqueda combinando los términos «cáncer de intervalo», «falso negativo», «cribado», «cribado poblacional», «detección precoz de cáncer» y «cáncer colorrectal». La estrategia de búsqueda finalmente utilizada fue: interval cancer*[Title/Abstract] OR false negative*[Title/Abstract] AND (screening OR mass screening OR early detection of cancer) AND (colorectal cancer OR bowel cancer).
Se priorizó que la búsqueda fuera más sensible que específica. Los criterios de inclusión fueron: artículos originales, idioma español o inglés, y periodo de publicación entre enero de 1999 y febrero de 2015. Por otra parte, se hizo una búsqueda manual de artículos a partir de las referencias bibliográficas citadas en los artículos seleccionados.
Se excluyeron todos aquellos estudios en cuyo título o resumen no se incluyera el tema de la revisión. Asimismo, tampoco se incluyeron los que hacían referencia a población de alto riesgo de cáncer colorrectal ni los que se basaban en cribados oportunistas.
La revisión de las publicaciones la realizaron dos autores de este estudio (XD y MG) de forma independiente y con un valor inicial de concordancia del 95,35%, calculado como la proporción de acuerdos observados. Las discrepancias se dirimieron por consenso.
La calidad de los estudios incluidos fue evaluada por un investigador usando instrumentos específicos. Las listas de comprobaciones que se usaron fueron STROBE11 y CONSORT12, ya que los estudios incluidos eran observacionales o ensayos clínicos.
Se realizó una síntesis narrativa de la información recopilada de los estudios incluidos. De cada artículo se recogió la siguiente información:
- •
Características generales de los estudios: año de publicación, país, periodo de estudio, frecuencia del cribado (anual o bienal), periodo de seguimiento (tiempo real transcurrido entre un episodio de cribado negativo y la invitación al siguiente cribado), tamaño de la muestra, rango de edad de los participantes, tipo de ronda (prevalente o incidente), test de cribado y prueba confirmatoria del cribado.
- •
Definición de cáncer de intervalo, fuente de recogida de datos y exhaustividad en la identificación de los casos.
- •
Características de los cánceres de intervalo: frecuencia (global, según sexo o según la ronda), tipo de cáncer de intervalo (test o pruebas diagnósticas), localización y estadio tumoral.
- •
Sensibilidad del episodio de cribado estimada mediante el método tradicional (número de cánceres detectados en el cribado dividido por el total de tumores diagnosticados en la población cribada) o mediante la incidencia proporcional (calculada como la incidencia de cánceres de intervalo en relación con la incidencia esperada en ausencia de cribado).
Se siguió la declaración PRISMA para la elaboración de la revisión sistemática y, de esta manera, facilitar la lectura crítica del artículo13.
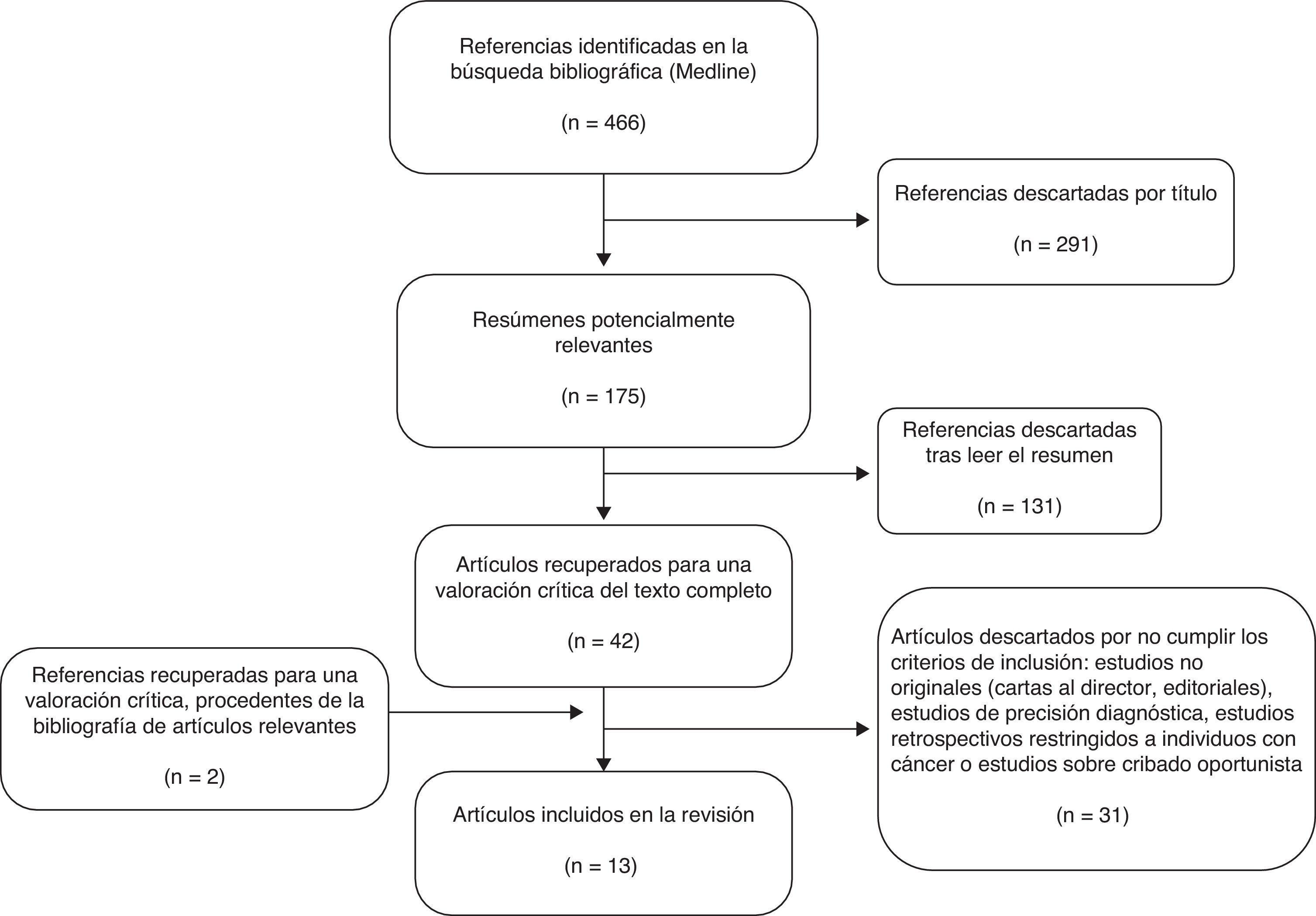
ResultadosLa búsqueda en la base de datos MEDLINE produjo 466 citas y 175 artículos potencialmente relevantes (fig. 1). El resumen de estos artículos nos llevó a considerar 44 artículos apropiados para su revisión detallada. Una vez revisados se excluyeron 31 artículos por los siguientes motivos: ocho no eran artículos originales, 15 no eran estudios de programas de cribado poblacional, uno partía de población con cáncer, en dos la definición de cáncer de intervalo no era comparable a la del resto de los estudios, uno estudiaba la sensibilidad del test de cribado y no del programa poblacional, y en los cuatro restantes las variables resultado no eran de interés para la revisión (p. ej., retraso en el análisis de las muestras o punto de corte óptimo del test).
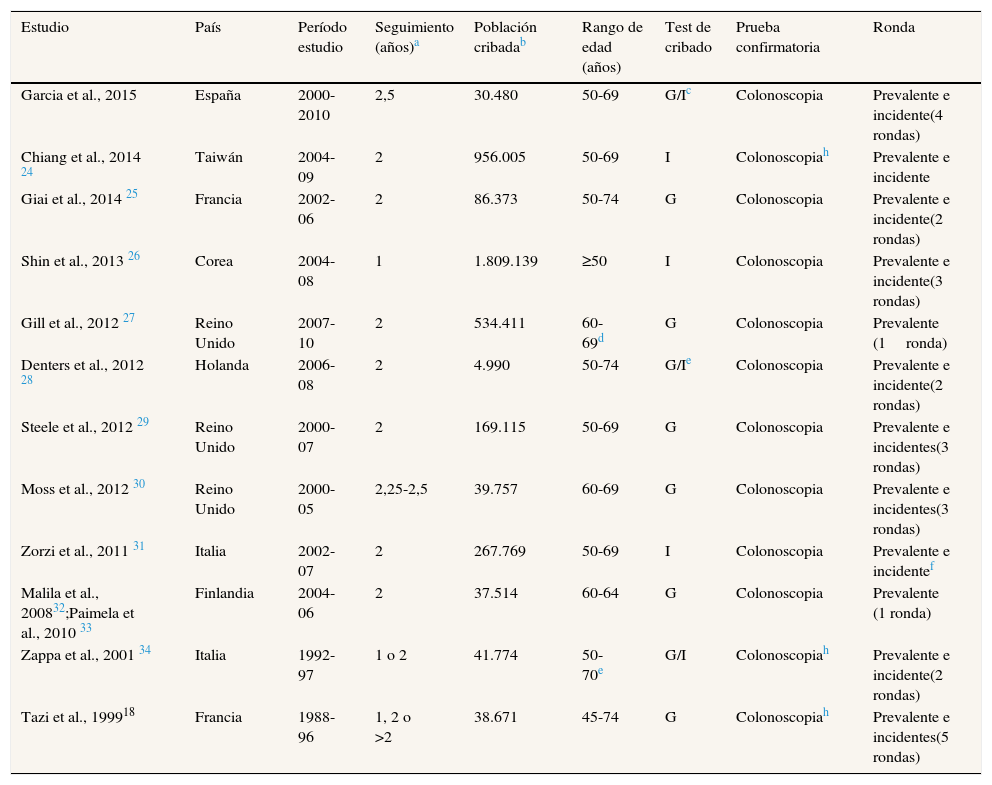
Se incluyeron 13 artículos en la revisión sistemática. En total se incluyó información de 4.015.998 participantes en programas de cribado de Francia (Borgoña y Ródano-Alpes), el Reino Unido (Inglaterra y Escocia), Holanda (Ámsterdam), Italia (Toscana y Véneto), Finlandia, España (Cataluña), Corea y Taiwán. Cabe señalar que los dos artículos sobre el programa de cribado de Finlandia están basados en la misma población y el mismo periodo de estudio, pero se decidió incluir ambos porque ofrecían información complementaria (tabla 1).
Características generales de los estudios sobre cánceres de intervalo en programas de cribado del cáncer colorrectal
| Estudio | País | Período estudio | Seguimiento (años)a | Población cribadab | Rango de edad (años) | Test de cribado | Prueba confirmatoria | Ronda |
|---|---|---|---|---|---|---|---|---|
| Garcia et al., 2015 | España | 2000-2010 | 2,5 | 30.480 | 50-69 | G/Ic | Colonoscopia | Prevalente e incidente(4 rondas) |
| Chiang et al., 2014 24 | Taiwán | 2004-09 | 2 | 956.005 | 50-69 | I | Colonoscopiah | Prevalente e incidente |
| Giai et al., 2014 25 | Francia | 2002-06 | 2 | 86.373 | 50-74 | G | Colonoscopia | Prevalente e incidente(2 rondas) |
| Shin et al., 2013 26 | Corea | 2004-08 | 1 | 1.809.139 | ≥50 | I | Colonoscopia | Prevalente e incidente(3 rondas) |
| Gill et al., 2012 27 | Reino Unido | 2007-10 | 2 | 534.411 | 60-69d | G | Colonoscopia | Prevalente (1ronda) |
| Denters et al., 2012 28 | Holanda | 2006-08 | 2 | 4.990 | 50-74 | G/Ie | Colonoscopia | Prevalente e incidente(2 rondas) |
| Steele et al., 2012 29 | Reino Unido | 2000-07 | 2 | 169.115 | 50-69 | G | Colonoscopia | Prevalente e incidentes(3 rondas) |
| Moss et al., 2012 30 | Reino Unido | 2000-05 | 2,25-2,5 | 39.757 | 60-69 | G | Colonoscopia | Prevalente e incidentes(3 rondas) |
| Zorzi et al., 2011 31 | Italia | 2002-07 | 2 | 267.769 | 50-69 | I | Colonoscopia | Prevalente e incidentef |
| Malila et al., 200832;Paimela et al., 2010 33 | Finlandia | 2004-06 | 2 | 37.514 | 60-64 | G | Colonoscopia | Prevalente (1 ronda) |
| Zappa et al., 2001 34 | Italia | 1992-97 | 1 o 2 | 41.774 | 50-70e | G/I | Colonoscopiah | Prevalente e incidente(2 rondas) |
| Tazi et al., 199918 | Francia | 1988-96 | 1, 2 o >2 | 38.671 | 45-74 | G | Colonoscopiah | Prevalente e incidentes(5 rondas) |
G: test del guayaco; I: test inmunológico.
Tiempo de seguimiento desde el resultado negativo en el cribado hasta la invitación al siguiente cribado.
Cálculo aproximado a partir de la población invitada y la participación en el cribado. En dos estudios se ha recurrido a artículos anteriores para obtener la información (Tazi et al., 1997; Goulard et al., 1998) 35,36.
Se ofreció el test del guayaco en las tres primeras rondas, en la cuarta se ofreció el guayaco a los individuos de 10 áreas básicas de salud y el test inmunológico a individuos de dos áreas básicas de salud.
En la primera ronda, 2119 personas realizaron el test del guayaco y 2871 personas realizaron el inmunológico; en la segunda ronda se ofreció únicamente el test inmunológico.
El programa de cribado en Finlandia se implementó utilizando un diseño experimental (asignación aleatoria de la población diana al grupo de cribado o bien al grupo de control). El objetivo era evaluar el programa y conocer su impacto en la población.
El estudio con población holandesa presenta datos de dos rondas del programa piloto de cribado del cáncer colorrectal en Ámsterdam y aporta resultados que permiten la comparación de la sensibilidad del TSOH con el método de guayaco y el inmunológico. En la primera ronda se asignó aleatoriamente el test del guayaco o el inmunológico; en cambio, en la segunda ronda sólo se ofreció el test inmunológico como prueba de cribado.
El estudio de la Toscana incluyó varios municipios y presenta resultados de individuos que realizaron el cribado con el test de guayaco o con un test inmunológico. El estudio de la Región del Véneto incluyó información de cinco programas de cribado, todos ellos con el test inmunológico.
El estudio realizado en nuestro país presenta resultados de cuatro rondas del programa de cribado de la ciudad de L’Hospitalet de Llobregat (Cataluña). El test de elección en las tres primeras rondas fue el del guayaco. En la cuarta ronda se ofreció el test del guayaco a la población de 10 áreas básicas de salud, y el test inmunológico a la población de las dos áreas básicas de salud restantes.
El test de elección para los programas de Taiwán y Corea fue el inmunológico. En el resto de los artículos del Reino Unido y Francia, el test utilizado fue el del guayaco.
Mayoritariamente los programas invitaron a la población a partir de los 50 años de edad y hasta los 69 o 74 años. Excepto en el estudio de Corea (anual), todos los programas tenían una periodicidad de cribado bienal. Debido a retrasos en la invitación de la población, dos estudios tuvieron periodos de seguimiento superiores a 2 años.
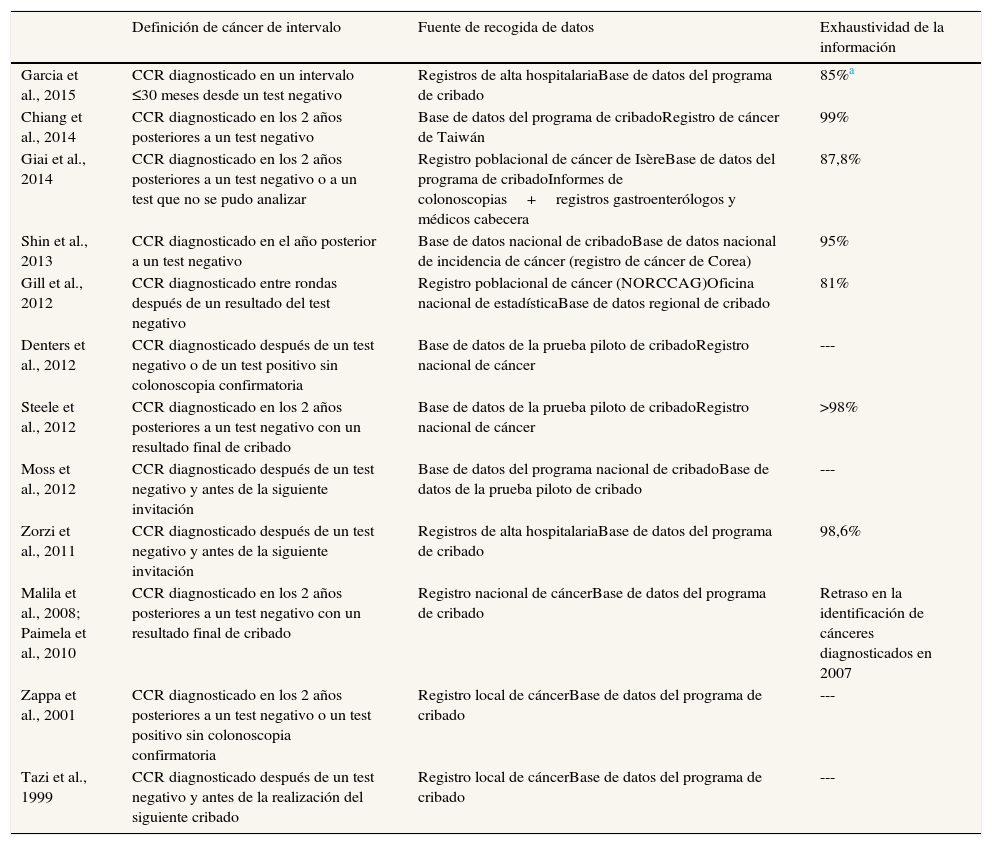
La fuente de información utilizada en la mayoría de los estudios para identificar los casos de cáncer colorrectal fueron registros poblacionales de cáncer (tabla 2). En ausencia de registros de cáncer con base poblacional, se utilizaron datos de altas hospitalarias. La exhaustividad de la información de los tumores se indicó en siete de los 13 estudios, y en tres de ellos fue inferior al 90%.
Definición e identificación de los casos de los estudios sobre cánceres de intervalo en programas de cribado del cáncer colorrectal
| Definición de cáncer de intervalo | Fuente de recogida de datos | Exhaustividad de la información | |
|---|---|---|---|
| Garcia et al., 2015 | CCR diagnosticado en un intervalo ≤30 meses desde un test negativo | Registros de alta hospitalariaBase de datos del programa de cribado | 85%a |
| Chiang et al., 2014 | CCR diagnosticado en los 2 años posteriores a un test negativo | Base de datos del programa de cribadoRegistro de cáncer de Taiwán | 99% |
| Giai et al., 2014 | CCR diagnosticado en los 2 años posteriores a un test negativo o a un test que no se pudo analizar | Registro poblacional de cáncer de IsèreBase de datos del programa de cribadoInformes de colonoscopias+registros gastroenterólogos y médicos cabecera | 87,8% |
| Shin et al., 2013 | CCR diagnosticado en el año posterior a un test negativo | Base de datos nacional de cribadoBase de datos nacional de incidencia de cáncer (registro de cáncer de Corea) | 95% |
| Gill et al., 2012 | CCR diagnosticado entre rondas después de un resultado del test negativo | Registro poblacional de cáncer (NORCCAG)Oficina nacional de estadísticaBase de datos regional de cribado | 81% |
| Denters et al., 2012 | CCR diagnosticado después de un test negativo o de un test positivo sin colonoscopia confirmatoria | Base de datos de la prueba piloto de cribadoRegistro nacional de cáncer | --- |
| Steele et al., 2012 | CCR diagnosticado en los 2 años posteriores a un test negativo con un resultado final de cribado | Base de datos de la prueba piloto de cribadoRegistro nacional de cáncer | >98% |
| Moss et al., 2012 | CCR diagnosticado después de un test negativo y antes de la siguiente invitación | Base de datos del programa nacional de cribadoBase de datos de la prueba piloto de cribado | --- |
| Zorzi et al., 2011 | CCR diagnosticado después de un test negativo y antes de la siguiente invitación | Registros de alta hospitalariaBase de datos del programa de cribado | 98,6% |
| Malila et al., 2008; Paimela et al., 2010 | CCR diagnosticado en los 2 años posteriores a un test negativo con un resultado final de cribado | Registro nacional de cáncerBase de datos del programa de cribado | Retraso en la identificación de cánceres diagnosticados en 2007 |
| Zappa et al., 2001 | CCR diagnosticado en los 2 años posteriores a un test negativo o un test positivo sin colonoscopia confirmatoria | Registro local de cáncerBase de datos del programa de cribado | --- |
| Tazi et al., 1999 | CCR diagnosticado después de un test negativo y antes de la realización del siguiente cribado | Registro local de cáncerBase de datos del programa de cribado | --- |
CCR: cáncer colorrectal.
Dato procedente de un estudio de validación en el que se comparaba la concordancia de tumores identificados mediante base de datos de alta hospitalaria (CMBD) y un registro poblacional de cáncer. Las discrepancias observadas se debían mayoritariamente a un pequeño retraso en la incorporación de la información (Márquez et al., 2006)37.
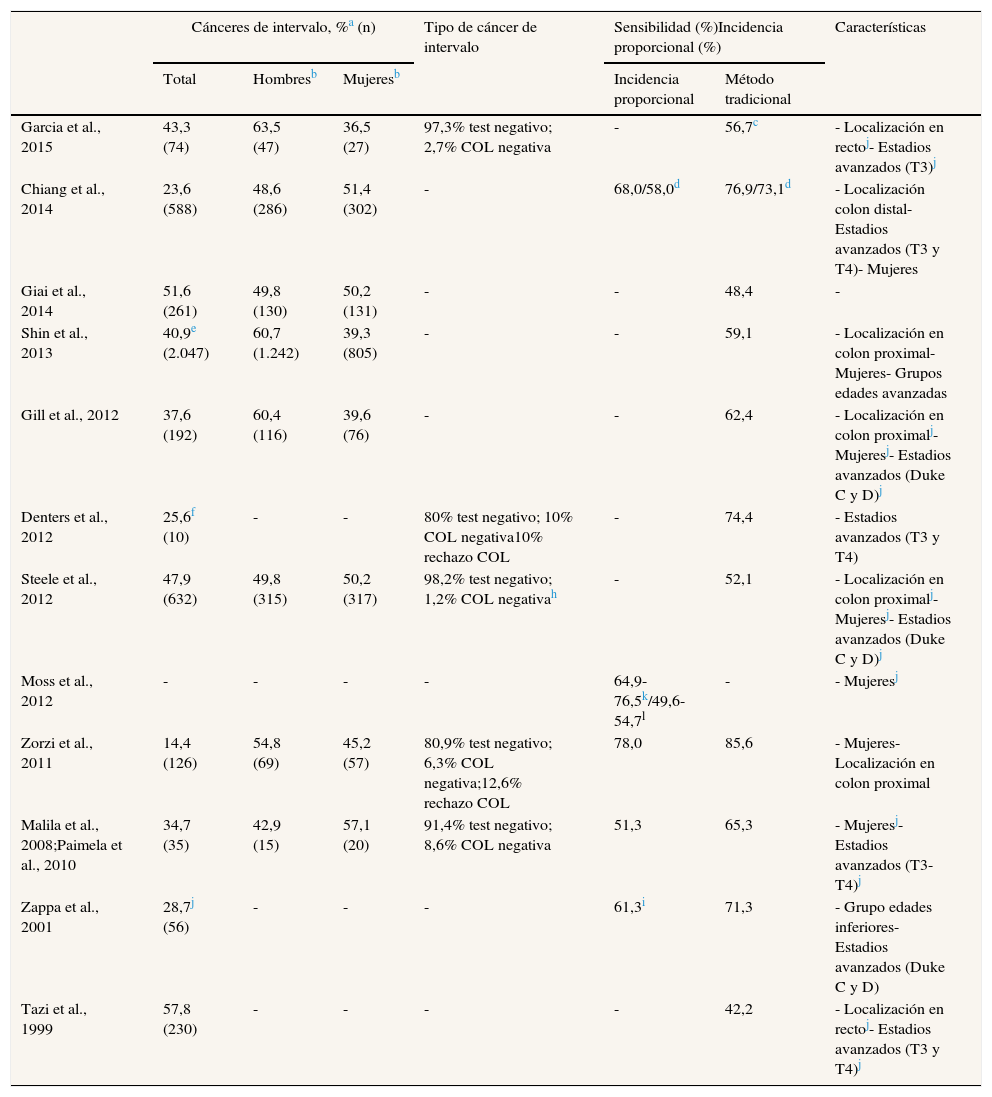
La sensibilidad de los programas de cribado (método tradicional) osciló entre el 42,2% y el 65,3% en los programas que utilizaron guayaco, y entre el 59,1% y el 87,0% en los que utilizaron el test inmunológico (tabla 3).
Características de los cánceres de intervalo y sensibilidad de los programas de cribado del cáncer colorrectal
| Cánceres de intervalo, %a (n) | Tipo de cáncer de intervalo | Sensibilidad (%)Incidencia proporcional (%) | Características | ||||
|---|---|---|---|---|---|---|---|
| Total | Hombresb | Mujeresb | Incidencia proporcional | Método tradicional | |||
| Garcia et al., 2015 | 43,3 (74) | 63,5 (47) | 36,5 (27) | 97,3% test negativo; 2,7% COL negativa | - | 56,7c | - Localización en rectoj- Estadios avanzados (T3)j |
| Chiang et al., 2014 | 23,6 (588) | 48,6 (286) | 51,4 (302) | - | 68,0/58,0d | 76,9/73,1d | - Localización colon distal- Estadios avanzados (T3 y T4)- Mujeres |
| Giai et al., 2014 | 51,6 (261) | 49,8 (130) | 50,2 (131) | - | - | 48,4 | - |
| Shin et al., 2013 | 40,9e (2.047) | 60,7 (1.242) | 39,3 (805) | - | - | 59,1 | - Localización en colon proximal- Mujeres- Grupos edades avanzadas |
| Gill et al., 2012 | 37,6 (192) | 60,4 (116) | 39,6 (76) | - | - | 62,4 | - Localización en colon proximalj-Mujeresj- Estadios avanzados (Duke C y D)j |
| Denters et al., 2012 | 25,6f (10) | - | - | 80% test negativo; 10% COL negativa10% rechazo COL | - | 74,4 | - Estadios avanzados (T3 y T4) |
| Steele et al., 2012 | 47,9 (632) | 49,8 (315) | 50,2 (317) | 98,2% test negativo; 1,2% COL negativah | - | 52,1 | - Localización en colon proximalj- Mujeresj- Estadios avanzados (Duke C y D)j |
| Moss et al., 2012 | - | - | - | - | 64,9-76,5k/49,6-54,7l | - | - Mujeresj |
| Zorzi et al., 2011 | 14,4 (126) | 54,8 (69) | 45,2 (57) | 80,9% test negativo; 6,3% COL negativa;12,6% rechazo COL | 78,0 | 85,6 | - Mujeres- Localización en colon proximal |
| Malila et al., 2008;Paimela et al., 2010 | 34,7 (35) | 42,9 (15) | 57,1 (20) | 91,4% test negativo; 8,6% COL negativa | 51,3 | 65,3 | - Mujeresj- Estadios avanzados (T3-T4)j |
| Zappa et al., 2001 | 28,7j (56) | - | - | - | 61,3i | 71,3 | - Grupo edades inferiores- Estadios avanzados (Duke C y D) |
| Tazi et al., 1999 | 57,8 (230) | - | - | - | - | 42,2 | - Localización en rectoj- Estadios avanzados (T3 y T4)j |
COL: colonoscopia.
Incidencia proporcional: 68% FIT OC-Sensor y 58% FIT HM-Jack incluyendo cánceres in situ; método tradicional: 76,9% FIT OC-Sensor y 73,1% FIT HM-Jack considerando sólo cánceres invasivos.
28,6% cánceres de intervalo en ronda prevalente: 33,3% con el test del guayaco y 25% con el inmunológico.
g 41,6% cánceres de intervalo con el test del guayaco y 11,0% con el test inmunológico.
La proporción de cánceres de intervalo diagnosticados después de un resultado negativo en el TSOH fue del 80,9% al 98,2%. La proporción fue mayor en los estudios que excluyeron a los pacientes que rechazaron realizarse una colonoscopia (91,4% a 98,2%).
Respecto a las características de los cánceres de intervalo, se diagnosticaron con más frecuencia en mujeres, estaban ubicados en la zona proximal (colon derecho) y, en comparación con los cánceres detectados en el cribado, se diagnosticaron en estadios más avanzados.
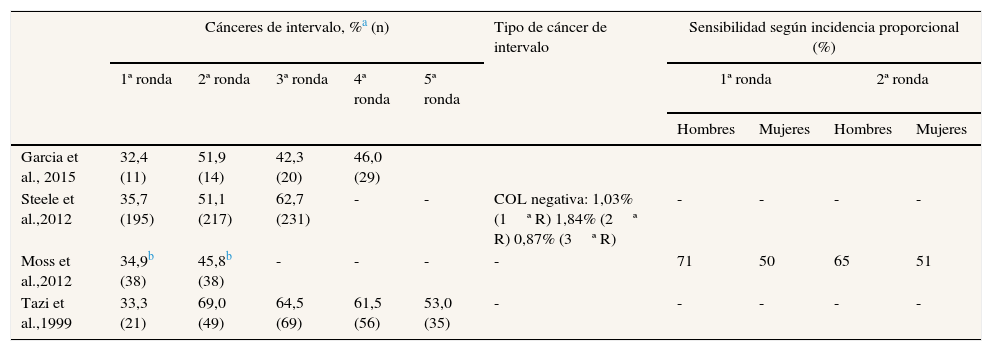
En la tabla 4 se observa la distribución de los cánceres de intervalo según la ronda de cribado en aquellos programas que presentaron resultados de tres o más rondas. La proporción de cánceres de intervalo fue menor en la primera ronda de cribado (ronda prevalente) y aumentó en rondas sucesivas (incidentes).
Cánceres colorrectales de intervalo según la ronda de cribado
| Cánceres de intervalo, %a (n) | Tipo de cáncer de intervalo | Sensibilidad según incidencia proporcional (%) | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 1ª ronda | 2ª ronda | 3ª ronda | 4ª ronda | 5ª ronda | 1ª ronda | 2ª ronda | ||||
| Hombres | Mujeres | Hombres | Mujeres | |||||||
| Garcia et al., 2015 | 32,4 (11) | 51,9 (14) | 42,3 (20) | 46,0 (29) | ||||||
| Steele et al.,2012 | 35,7 (195) | 51,1 (217) | 62,7 (231) | - | - | COL negativa: 1,03% (1ª R) 1,84% (2ª R) 0,87% (3ª R) | - | - | - | - |
| Moss et al.,2012 | 34,9b (38) | 45,8b (38) | - | - | - | - | 71 | 50 | 65 | 51 |
| Tazi et al.,1999 | 33,3 (21) | 69,0 (49) | 64,5 (69) | 61,5 (56) | 53,0 (35) | - | - | - | - | - |
COL: colonoscopia.
Son pocos los programas que han evaluado los cánceres de intervalo. Entre los motivos cabe destacar la reciente implementación de los programas poblaciones y que la evaluación de los cánceres de intervalo requiere muchos recursos.
Existe una gran variabilidad en la proporción de cánceres de intervalo en los programas de cribado del cáncer colorrectal (14,4% a 57,8%). La sensibilidad de estos programas mediante el TSOH es baja, aunque mejora notablemente con el test inmunológico. Algunos países, como el Reino Unido, Francia, España, Finlandia y algunas zonas de Italia, implementaron programas de cribado del cáncer colorrectal basado en el test de guayaco. Sin embargo, muchos de ellos han cambiado ya, o lo harán en breve, al test inmunológico. Por tanto, es de esperar que la sensibilidad global de los programas mejore sustancialmente.
Características de los cánceres de intervaloEn general se ha observado que aproximadamente nueve de cada diez cánceres de intervalo se deben a un resultado negativo en el TSOH. Alrededor de un 10% de los cánceres de intervalo se diagnosticó tras dar positivo en el TSOH y obtener un resultado negativo en la colonoscopia. La celeridad con que se diagnosticó clínicamente el cáncer después de una colonoscopia negativa indica que probablemente se trate de falsos negativos diagnósticos. Se están haciendo esfuerzos para mejorar la detección de lesiones centrándose en prolongar el tiempo de retirada de la colonoscopia, mejorando la preparación del intestino y usando nuevas tecnologías14. Probablemente todo ello contribuya a minimizar, o al menos a controlar, los cánceres de intervalo debidos a un resultado falso negativo en la colonoscopia.
No es despreciable el número de tumores diagnosticados en personas con un test positivo que rechazaron realizar la prueba de confirmación diagnóstica (entre un 7,4% y un 12,6% de los tumores diagnosticados en la población cribada). Independientemente de si se consideran cánceres de intervalo o no, dado que los individuos no finalizaron el proceso de cribado, sería importante implementar estrategias para reducir al máximo los tumores en este grupo.
Respecto a la localización tumoral, en la mayoría de los estudios se observó que los cánceres de intervalo estaban situados con más frecuencia en la zona proximal del colon. Este resultado concuerda con los de otros estudios15,16 y puede explicarse por la total degradación de la hemoglobina durante el largo recorrido que debe seguir la sangre17. Además, las lesiones sésiles serradas se localizan en su mayoría en el colon derecho. Estas lesiones suelen ser pequeñas y planas, y fácilmente pueden ser no detectadas durante la colonoscopia.
En cambio, en dos estudios se observó que los tumores situados en el recto tenían una mayor probabilidad de diagnosticarse como cáncer de intervalo. Esto puede atribuirse a la propia prueba, que detecta hematina fecal, un producto de la degradación de la hemoglobina. La hemólisis de la sangre procedente de los tumores rectales puede ser insuficiente, dado su corto trayecto a través del recto18.
En el 66,7% de los estudios, los cánceres de intervalo fueron diagnosticados en estadios más avanzados que los detectados durante el cribado. Probablemente esto se deba a que los falsos negativos, casos que no se detectan en el cribado, tengan un periodo de evolución más largo, o bien a que los verdaderos cánceres de intervalo sean más agresivos y con un crecimiento tumoral muy rápido18.
En algunos estudios se ha observado que los cánceres de intervalo son más frecuentes en las mujeres. Este hecho podría explicarse por las diferencias de sexo en la sensibilidad del TSOH, que podrían atribuirse a diferencias entre hombres y mujeres en el tiempo de tránsito colónico, que es más lento en las mujeres. Como resultado, la degradación de la hemoglobina antes de la defecación podría disminuir la concentración de hemoglobina fecal en mayor medida en las mujeres que en los hombres, lo que disminuiría la probabilidad de resultados positivos del test19.
Indicadores de impactoLa guía europea de calidad del cribado del cáncer colorrectal20 sugiere calcular la sensibilidad según el método tradicional. Sin embargo, se trata de una fórmula cuestionable, ya que en realidad compara los cánceres detectados en el cribado, es decir, aquellos destinados a emerger clínicamente en un periodo superior a 2 años, con los cánceres de intervalo, que por definición se producen durante el intervalo de 2 años. Por tanto, este método implica cierto grado de sobreestimación de la sensibilidad, en especial cuando se determina en la ronda prevalente del cribado (primera ronda del programa).
La sensibilidad calculada mediante la incidencia proporcional no está afectada por el sobrediagnóstico ni por el sesgo de duración diagnóstica. Sin embargo, la principal dificultad que presenta su cálculo es qué se considera y cómo se estima la incidencia basal.
Problemas metodológicos que dificultan la comparación y el benchmarking de los cánceres colorrectales de intervalo en los programas poblacionales de cribadoSe ha constatado que, a pesar de que existe una definición estándar de cáncer de intervalo, no hay un consenso en la utilización de esta definición. Hay estudios que sólo consideran como cánceres de intervalo aquellos detectados en el periodo entre rondas después de un resultado del test negativo, pero hay dos estudios que han incorporado también aquellos que abandonan a mitad del proceso (test de cribado positivo y no realización de prueba confirmatoria).
La fuente de identificación de casos utilizada determina la calidad de esta identificación; sin embargo, no se ha observado ninguna relación entre la calidad de la fuente de identificación (registros poblacionales de cáncer o registros de alta hospitalaria) y la sensibilidad del programa encontrada en cada estudio.
Nuestra revisión presenta algunas limitaciones relacionadas con el sistema de búsqueda, pues sólo se seleccionaron estudios identificados en MEDLINE, pero no se revisaron otras bases bibliográficas de interés (p. ej., EMBASE). No se realizó una búsqueda en Internet, ni tampoco una búsqueda adicional de estudios no publicados. Por otra parte, se excluyeron artículos no escritos en inglés o español, y aquellos que no incluían en el título o en el resumen el tema de la revisión. No obstante, nuestro trabajo tiene como principal fortaleza el uso de una metodología sistemática y estructurada de la búsqueda de los estudios publicados y de la recogida de las variables analizadas.
ConclusiónEl conocimiento obtenido en esta revisión puede proporcionar la base para el planteamiento de diversas acciones a emprender con el fin de mejorar la sensibilidad de los programas poblacionales de cribado del cáncer colorrectal para identificar lesiones precursoras y tumores sobre los que pueda mejorarse el pronóstico, mejorar la exhaustividad de la recogida de datos o incentivar la creación de una definición internacional de cáncer colorrectal de intervalo. De hecho, actualmente se están desarrollando iniciativas que intentan llegar a un consenso para la recogida y la medida de los cánceres de intervalo en el contexto del cribado del cáncer colorrectal. Por un lado, el National Health Service está desarrollando un protocolo sobre cómo evaluarlos, todavía sin publicar; la Red de Programas de Cribado de Cáncer ha realizado una propuesta de protocolo para la evaluación de los cánceres de intervalo en los programas de detección precoz del cáncer colorrectal21, y la World Endoscopy Organization está trabajando en el proyecto «Definición y taxonomía de los cánceres colorrectales de intervalo»22.
También debería incentivarse la recogida de otras variables, como los factores biomoleculares asociados a los cánceres de intervalo y a los cánceres colorrectales detectados en el cribado para conocer si existe una relación de estos factores con el tipo o con la agresividad del tumor23. Conocer las características epidemiológicas y tumorales de los pacientes con cáncer colorrectal de intervalo conduciría a un mejor conocimiento de la enfermedad y de su prevención.
Editor responsable del artículoAlberto Ruano-Ravina.
La identificación de los cánceres de intervalo permite calcular indicadores precoces del impacto del programa de cribado.
¿Qué añade el estudio realizado a la literatura?La sensibilidad de los programas de cribado mediante el test de sangre oculta en heces oscila entre el 42,2% y el 65,3% en los programas que utilizan el test del guayaco y entre el 59,1% y el 87,0% con el test inmunológico. La variabilidad observada entre programas se debe, en parte, a cuestiones metodológicas respecto a la definición de cánceres de intervalo y la fuente de datos utilizada para la identificación de los tumores.
M. Garcia participó en la concepción y el diseño del trabajo, en cada una de las fases de la revisión de la literatura y en la escritura del artículo. X. Domènech colaboró en el diseño, en la selección de las referencias y en la extracción de datos, y escribió el primer borrador del artículo. Todos los autores participaron activamente en la revisión crítica del artículo y dieron su aprobación a la versión actual. M. Garcia es la responsable del artículo.
FinanciaciónEl proyecto está parcialmente financiado por el Instituto de Salud Carlos III (PI12/00992 y RD/12/0036/0053), fondos FEDER –una manera de hacer Europa–, y el Departamento de Universidades e Investigación, Generalitat de Catalunya (2014SGR635)
Conflicto de interesesNinguno.