Describir la frecuencia de defectos del tubo neural (DTN) –anencefalia, espina bífida y encefalocele—en Asturias, su evolución temporal y el impacto del diagnóstico prenatal.
MétodosSe estudiaron los casos de DTN en nacidos y abortos inducidos durante el período 1990–2004, utilizando la base de datos del Registro de Defectos Congénitos de Asturias, de base poblacional. Se calcularon las tasas de prevalencia total y al nacimiento.
ResultadosLa prevalencia total de DTN fue de 12,2 casos por 10.000 nacidos (5,9 anencefalias, 5,0 espinas bífidas y 1,3 encefaloceles) y mostró una tendencia ligeramente descendente, con un descenso significativo de la espina bífida, mientras que las cifras de anencefalia y encefalocele se mantuvieron estables. Finalizaron en aborto inducido tras el diagnóstico prenatal el 88% de los casos (anencefalia 96,7%; espina bífida 80%; encefalocele 84,6%), lo que determinó una prevalencia al nacimiento muy baja (1,4 DTN por 10.000 nacidos).
ConclusionesEn Asturias, en los últimos 15 años se ha producido un descenso selectivo en la prevalencia total de espina bífida de causa no aclarada. La prevención secundaria, mediante los programas de diagnóstico prenatal y la consiguiente interrupción del embarazo, fue el motivo del marcado descenso de la frecuencia en los nacidos; la simple recomendación de suplementación periconcepcional con ácido fólico no parece haber logrado el efecto buscado.
To describe the frequency and prevalence trend for neural tube defects (NTD) (anencephaly, spina bifida and encephalocele) in Asturias (Spain), as well as the impact of prenatal diagnosis programs.
MethodsAll cases of NTD in births and induced abortions were studied, using data from the Registry of Congenital Defects of Asturias for 1990-2004. Total and birth prevalence rates were calculated.
ResultsThe prevalence of NTD for 1990–2004 was 12.2 per 10,000 births (5.9 anencephaly, 5.0 spina bifida and 1.3 encephalocele) and showed a slightly decreasing trend due to a significant decline in spina bifida prevalence. The prevalence of anencephaly and encephalocele remained stable. The percentage of induced abortions after prenatal diagnosis among all NTD was 88% (anencephaly 96.7%, spina bifida 80% and encephalocele 84.6%), leading to a very low birth prevalence (1.4 per 10,000) for the entire period.
ConclusionsThe total prevalence of spina bifida has decreased in the last 15 years in Asturias. Secondary prevention through prenatal diagnosis and interruption of affected pregnancies have resulted in a marked decrease in NTD at birth. The recommendation of periconceptional use of folic acid seems not to have achieved the desired effect.
Los defectos del tubo neural (DTN) son un grupo de anomalías congénitas que pueden ocurrir por un defecto en su cierre alrededor del día 28 de gestación, y que pueden llevar a aborto espontáneo, muerte intraútero, mortalidad en la primera infancia o secuelas importantes a largo plazo1. Son el segundo defecto congénito más común después de las anomalías cardiacas, excluyendo las alteraciones cromosómicas, con una frecuencia que oscila entre 5 y 60 casos por 10.000 nacidos1–3. La causa de los DTN no se conoce con exactitud, aunque hay datos que sugieren un componente genético. Se asocian a síndromes genéticos conocidos (síndrome de Meckel) y a distintas alteraciones cromosómicas (trisomía 13 y 18, aneuploidías), y tienen un riesgo de recurrencia en hermanos del 2 al 5%. También se han relacionado con factores ambientales, entre los cuales la diabetes materna y el uso de fármacos anticonvulsivantes, como el ácido valproico, son los más reconocidos1,2.
La amplia variación geográfica y temporal de los DTN, que se ha relacionado con factores étnicos y socioeconómicos, refleja la contribución articulada de los factores genéticos y ambientales en su etiología1. Estas variaciones geográficas afectan generalmente en igual proporción a la anencefalia y la espina bífida, con una distribución de frecuencias similar, mientras que la frecuencia del encefalocele se mantiene en valores más uniformes1,4. En la década de los setenta se observó el inicio de una tendencia descendente en la tasa de DTN, independiente del diagnóstico prenatal, que afecta especialmente a los países con frecuencias más elevadas. Así, en Reino Unido e Irlanda la tasa de prevalencia anual de DTN descendió desde 49 por 10.000 nacidos en 1980 a 10–15 por 10.000 nacidos en la década de los noventa5,6. Todo ello, unido al efecto del diagnóstico prenatal mediante la determinación de la alfa-fetoproteína sérica materna y la ecografía fetal, que han llevado a un descenso marcado de los nacidos con DTN, y junto con la prevención primaria con ácido fólico, hacen que la vigilancia epidemiológica de estos defectos sea importante y, a su vez, complicada7,8.
El objeto de este estudio fue describir la frecuencia de aparición y la tendencia temporal de los DTN en Asturias, así como el impacto del diagnóstico prenatal en su frecuencia al nacimiento.
Material y métodosAsturias tiene una población de aproximadamente un millón de habitantes y unas tasas de natalidad de las más bajas de España y Europa. El sistema sanitario público dispone de ocho maternidades, en las cuales tiene lugar el 95% del total de los partos. El número de nacimientos en 2004 fue de 7.205.
El Registro de Defectos Congénitos de Asturias (RDCA) es de base poblacional, con la finalidad de captar todos los casos de defectos congénitos en nacidos y en abortos inducidos tras el diagnóstico prenatal, de mujeres residentes en Asturias, y así conocer y vigilar la frecuencia de estos defectos en nuestra población. Se creó en 1990 y forma parte del European Registry of Congenital Anomalies and Twins (EUROCAT).
Forman parte del RDCA las ocho maternidades pertenecientes al Sistema Público de Asturias. Las características del RDCA están ampliamente descritas9 en la página web del EUROCAT10, con el que comparte, en lo fundamental, una metodología común.
Las fuentes de información utilizadas de forma sistemática fueron los Servicios de Pediatría/Neonatología y Obstetricia, el de Genética Clínica y la Unidad de Diagnóstico Prenatal, los de Anatomía Patológica, los de Archivos e Historias Clínicas, y los de Atención al Paciente, de los hospitales públicos; los datos del Programa de Detección Neonatal de Hipotiroidismo Congénito y Fenilcetonuria, del Programa de Detección Prenatal de DTN, el Registro de Interrupciones Voluntarias del Embarazo y el Registro de Mortalidad de la Consejería de Salud y Servicios Sanitarios.
Los Servicios de Pediatría y Neonatología fueron los responsables de captar los casos y remitir los datos cada mes al registro situado en la Consejería de Salud. Anualmente, con el fin de completar este proceso de captación, se realizó una búsqueda activa de casos cruzando la base de datos de los casos ya captados por pediatría con el resto de las fuentes de información mencionadas. Los casos nuevos de DTN se captaron principalmente del Registro de Interrupciones Voluntarias del Embarazo, de los Servicios de Atención al Paciente (que gestiona las interrupciones del embarazo que se derivan a las clínicas privadas) y del Programa de Detección Prenatal de DTN.
La codificación se realizó con la CIE-9 hasta el año 2000 y con la CIE-10 a partir de entonces (códigos 740–742 y Q00, Q01, Q05). Los casos con más de un DTN fueron asignados a una de estas cuatro categorías: a) anencefalia, que incluye la forma completa o incompleta, craneorraquisquisis y anencefalia asociada con iniencefalia o espina bífida; b) encefalocele, que incluye los casos asociados con espina bífida; c) espina bífida, que excluye la espina bífida oculta y los casos asociados con iniencefalia, anencefalia o encefalocele; y d) iniencefalia (no se analizan al no existir ningún caso). El período de estudio comprendió desde el 1 de enero de 1990 hasta el 31 de diciembre de 2004.
En este estudio, de carácter descriptivo, se utilizaron dos medidas de frecuencia: la tasa de prevalencia total, que se refiere al total de casos (vivos, muertos y abortos inducidos) registrados por cada 10.000 nacidos (vivos y muertos), y la de prevalencia al nacimiento, que no incluye los abortos inducidos. Con el fin de disminuir las fluctuaciones de las tasas, los casos se agruparon en 3 períodos de 5 años (1990–1994, 1995–1999 y 2000–2004). En la representación gráfica se respetaron las tasas anuales.
El diagnóstico prenatal puede elevar artificialmente la prevalencia total de DTN al registrar aquellos casos que terminan precozmente en abortos inducidos y que, si se dejasen a su evolución natural, podrían ser abortos espontáneos antes de la semana 20 y, por tanto, no registrables. Con el fin de conocer y corregir la influencia del diagnóstico prenatal en la prevalencia total de DTN, la recalculamos ajustando el número de abortos inducidos antes de la semana 20 de gestación, según los porcentajes estimados de pérdidas fetales espontáneas en DTN (17,4% entre las semanas 12 y 15, y 4,5% entre las semanas 16 y 19)11.
Se analizaron las malformaciones asociadas en los nacidos y en los abortos inducidos con estudio necrópsico. No se consideraron malformaciones asociadas las relacionadas directamente con el propio defecto o la presencia de otros DTN.
El análisis estadístico se realizó con el programa EPIINFO.10. Se utilizó el test de chi cuadrado para estudiar la homogeneidad de las tasas y para el análisis de la tendencia, en caso de constatar heterogeneidad. Se estableció una significación estadística del 5%.
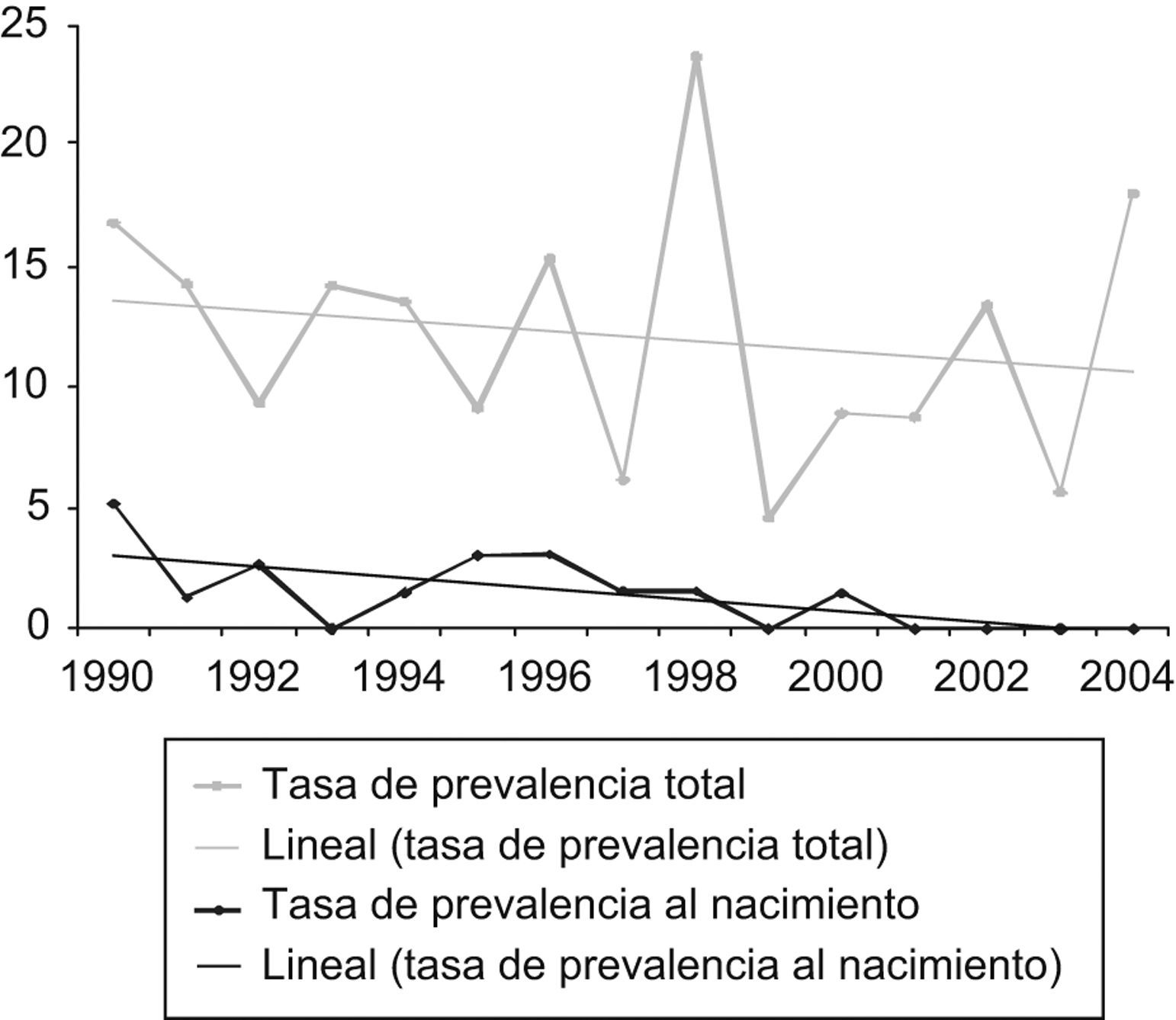
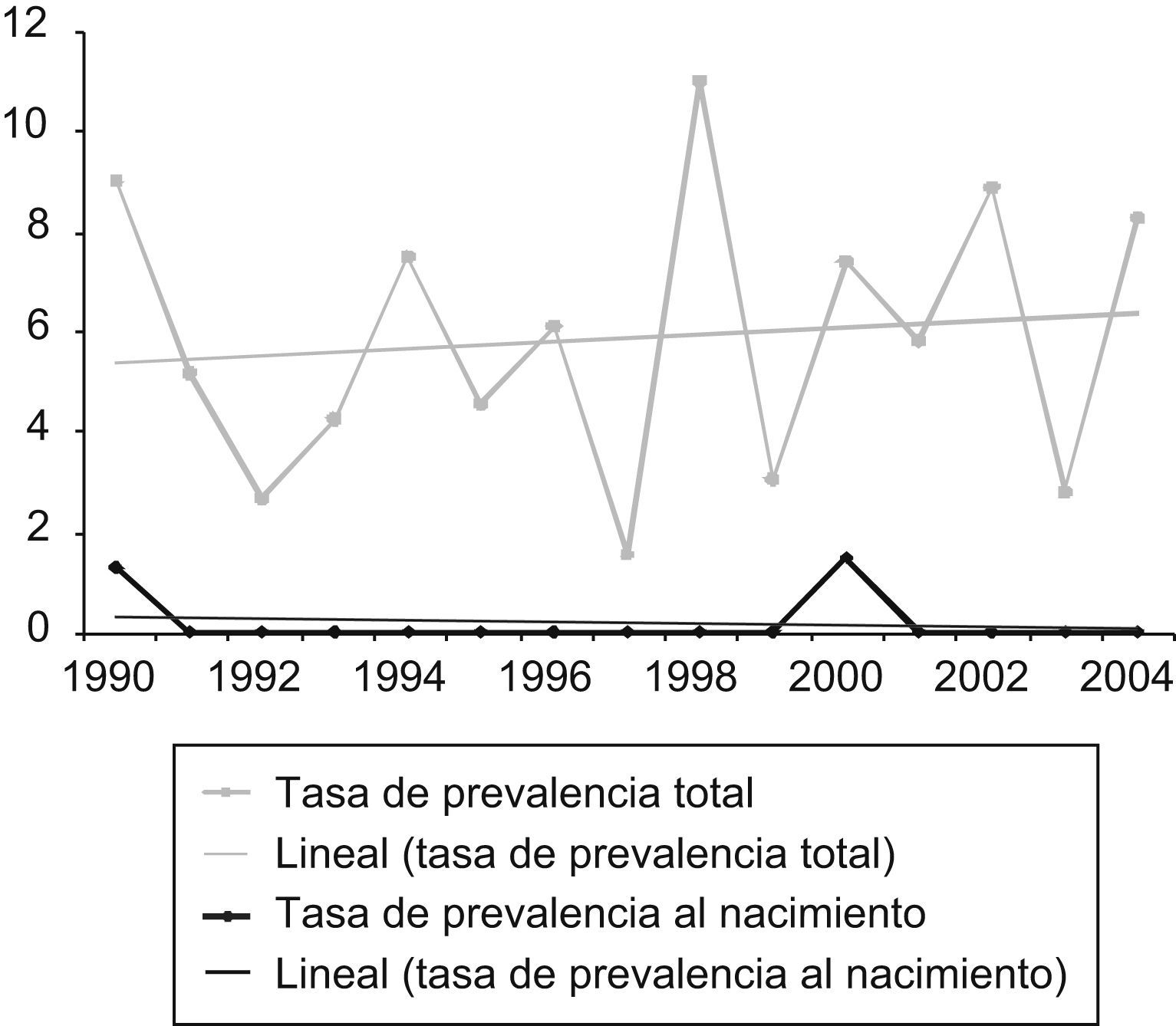
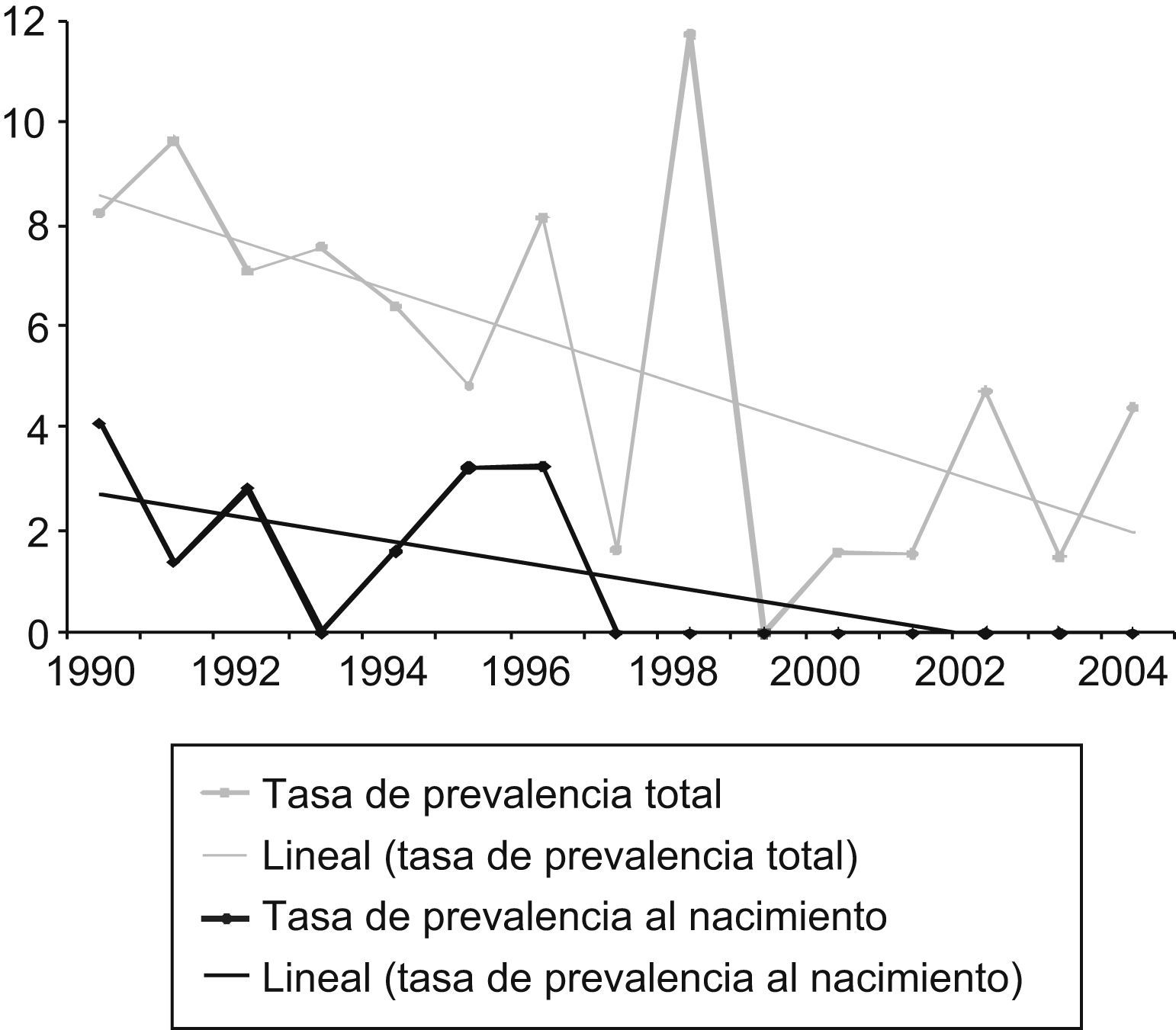
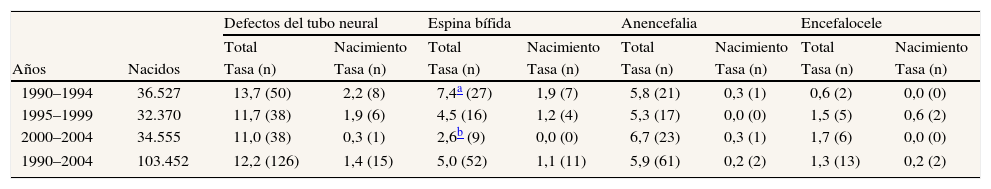
ResultadosFrecuencia de los defectos del tubo neuralDurante el período de estudio se registraron 126 casos de DTN: 61 anencefalias, 52 espinas bífidas y 13 encefaloceles. La tasa de prevalencia total presentó un ligero descenso, no significativo, para el conjunto de los DTN (chi cuadrado para homogeneidad: 1,13; p=0,56), y unas cifras estables para la anencefalia (chi cuadrado para homogeneidad: 0,58; p=0,74) y el encefalocele (chi cuadrado para homogeneidad: 2,31; p=0,31). En el caso de la espina bífida se observó una tendencia decreciente (chi cuadrado para tendencia lineal: 8,097; p=0,004). Las tasas de prevalencia al nacimiento fueron muy bajas durante todo el período: 1,4 DTN por 10.000 nacidos (1,1 para espina bífida, 0,2 para anencefalia y 0,2 para encefalocele) (tabla 1).
Prevalencia total y al nacimiento (tasa por 10.000 nacidos) de los defectos del tubo neural en Asturias (1990–2004)
| Defectos del tubo neural | Espina bífida | Anencefalia | Encefalocele | ||||||
| Total | Nacimiento | Total | Nacimiento | Total | Nacimiento | Total | Nacimiento | ||
| Años | Nacidos | Tasa (n) | Tasa (n) | Tasa (n) | Tasa (n) | Tasa (n) | Tasa (n) | Tasa (n) | Tasa (n) |
| 1990–1994 | 36.527 | 13,7 (50) | 2,2 (8) | 7,4a (27) | 1,9 (7) | 5,8 (21) | 0,3 (1) | 0,6 (2) | 0,0 (0) |
| 1995–1999 | 32.370 | 11,7 (38) | 1,9 (6) | 4,5 (16) | 1,2 (4) | 5,3 (17) | 0,0 (0) | 1,5 (5) | 0,6 (2) |
| 2000–2004 | 34.555 | 11,0 (38) | 0,3 (1) | 2,6b (9) | 0,0 (0) | 6,7 (23) | 0,3 (1) | 1,7 (6) | 0,0 (0) |
| 1990–2004 | 103.452 | 12,2 (126) | 1,4 (15) | 5,0 (52) | 1,1 (11) | 5,9 (61) | 0,2 (2) | 1,3 (13) | 0,2 (2) |
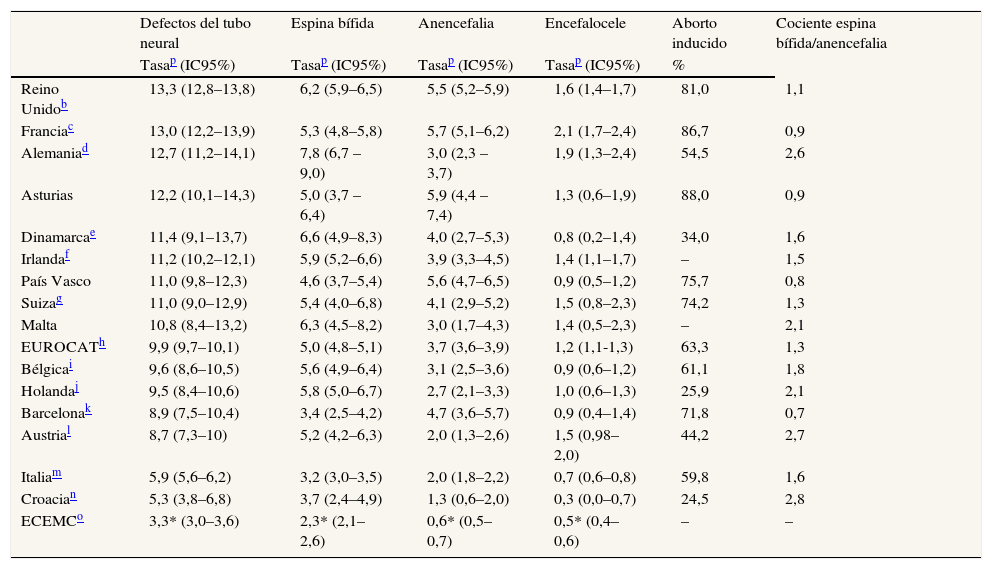
Las figuras 1 a 3 muestran la evolución temporal de estos defectos (se excluye el encefalocele por el escaso número de casos). En la tabla 2 se comparan las cifras de nuestro registro con las de otros de nuestro entorno geográfico9.
Prevalencia total de los defectos del tubo neural y sus categorías, en registros españoles y europeos pertenecientes al EUROCAT (agrupados por países o regiones), en los años 1990–2004a
| Defectos del tubo neural | Espina bífida | Anencefalia | Encefalocele | Aborto inducido | Cociente espina bífida/anencefalia | |
| Tasap (IC95%) | Tasap (IC95%) | Tasap (IC95%) | Tasap (IC95%) | % | ||
| Reino Unidob | 13,3 (12,8–13,8) | 6,2 (5,9–6,5) | 5,5 (5,2–5,9) | 1,6 (1,4–1,7) | 81,0 | 1,1 |
| Franciac | 13,0 (12,2–13,9) | 5,3 (4,8–5,8) | 5,7 (5,1–6,2) | 2,1 (1,7–2,4) | 86,7 | 0,9 |
| Alemaniad | 12,7 (11,2–14,1) | 7,8 (6,7 –9,0) | 3,0 (2,3 –3,7) | 1,9 (1,3–2,4) | 54,5 | 2,6 |
| Asturias | 12,2 (10,1–14,3) | 5,0 (3,7 –6,4) | 5,9 (4,4 –7,4) | 1,3 (0,6–1,9) | 88,0 | 0,9 |
| Dinamarcae | 11,4 (9,1–13,7) | 6,6 (4,9–8,3) | 4,0 (2,7–5,3) | 0,8 (0,2–1,4) | 34,0 | 1,6 |
| Irlandaf | 11,2 (10,2–12,1) | 5,9 (5,2–6,6) | 3,9 (3,3–4,5) | 1,4 (1,1–1,7) | – | 1,5 |
| País Vasco | 11,0 (9,8–12,3) | 4,6 (3,7–5,4) | 5,6 (4,7–6,5) | 0,9 (0,5–1,2) | 75,7 | 0,8 |
| Suizag | 11,0 (9,0–12,9) | 5,4 (4,0–6,8) | 4,1 (2,9–5,2) | 1,5 (0,8–2,3) | 74,2 | 1,3 |
| Malta | 10,8 (8,4–13,2) | 6,3 (4,5–8,2) | 3,0 (1,7–4,3) | 1,4 (0,5–2,3) | – | 2,1 |
| EUROCATh | 9,9 (9,7–10,1) | 5,0 (4,8–5,1) | 3,7 (3,6–3,9) | 1,2 (1,1-1,3) | 63,3 | 1,3 |
| Bélgicai | 9,6 (8,6–10,5) | 5,6 (4,9–6,4) | 3,1 (2,5–3,6) | 0,9 (0,6–1,2) | 61,1 | 1,8 |
| Holandaj | 9,5 (8,4–10,6) | 5,8 (5,0–6,7) | 2,7 (2,1–3,3) | 1,0 (0,6–1,3) | 25,9 | 2,1 |
| Barcelonak | 8,9 (7,5–10,4) | 3,4 (2,5–4,2) | 4,7 (3,6–5,7) | 0,9 (0,4–1,4) | 71,8 | 0,7 |
| Austrial | 8,7 (7,3–10) | 5,2 (4,2–6,3) | 2,0 (1,3–2,6) | 1,5 (0,98–2,0) | 44,2 | 2,7 |
| Italiam | 5,9 (5,6–6,2) | 3,2 (3,0–3,5) | 2,0 (1,8–2,2) | 0,7 (0,6–0,8) | 59,8 | 1,6 |
| Croacian | 5,3 (3,8–6,8) | 3,7 (2,4–4,9) | 1,3 (0,6–2,0) | 0,3 (0,0–0,7) | 24,5 | 2,8 |
| ECEMCo | 3,3* (3,0–3,6) | 2,3* (2,1–2,6) | 0,6* (0,5–0,7) | 0,5* (0,4–0,6) | – | – |
IC 95%: intervalo de confianza del 95%.
En las siguientes notas al pie se expresan entre paréntesis los períodos de estudio de los distintos registros, sólo cuando el período de años es distinto de 1990–2004.
Registros de Glasgow (90-00), Merseyside & Cheshire (95-99), NW Thames (91-04), Northern Region (00-04), Thames Walley (91-04), Trent (98-04), Wales (98-04) y Wessex (94-04).
El 17% (9/53) de los DTN observados en nacidos o en abortos inducidos con estudio post mórtem presentaron malformaciones asociadas (dos casos de secuencia Potter y uno de cada una de las siguientes malformaciones estructurales: agenesia renal unilateral, higroma quístico, drenaje venoso anómalo, hendidura palatina, hernia diafragmática derecha, aplasia del arco costal e hipoplasia pulmonar derechas y quiste aracnoideo). El encefalocele fue el que con mayor frecuencia presentó otras malformaciones (33,3%). En nueve casos de DTN se encontraron síndromes o anomalías cromosómicas (dos síndromes de Meckel, cuatro de Edwards, uno de Patau y dos triploidías). El porcentaje de estudios necrópsicos y cariotipos realizados en abortos inducidos por DTN fue del 37,8% y el 36,0%, respectivamente. La recurrencia en hermanos fue del 1,6% (anencefalia 1,6%, espina bífida 1,9% y encefalocele 0%), excluyendo dos hermanos con síndrome de Meckel.
Diagnóstico prenatalEl impacto del diagnóstico prenatal fue muy alto durante todo el período e hizo que un 88% de los casos de DTN finalizaran en aborto inducido (anencefalia 96,7%, espina bífida 80% y encefalocele 84,6%), y que las tasas de prevalencia al nacimiento fueran muy bajas (tabla 2). En los últimos cuatro años, todos los DTN fueron abortos inducidos. El impacto del diagnóstico prenatal queda reflejado en las figuras 1 a 3 por el área comprendida entre las líneas de prevalencia total y al nacimiento.
La mejora del diagnóstico prenatal también se reflejó en un importante descenso de la edad gestacional en que se realizaron los abortos inducidos. Así, el 78,9% de los DTN finalizaron en aborto inducido antes de la semana 20 de gestación (anencefalia 96,6%, espina bífida 55% y encefalocele 70%), e incluso a partir de 1997 el 41,8% de ellos (anencefalia 62,5%, espina bífida 6,2% y encefalocele 42,9%) fueron abortados antes de la semana 16.
La tasa de prevalencia total, corregida en función de los porcentajes estimados de pérdidas fetales espontáneas antes de la semana 20 de gestación, se modificó poco, siendo de 11,4 casos por 10.000 para el conjunto de los DTN (en lugar de 12,2); la más afectada fue la de anencefalia (5,3 por 10.000 en lugar de 5,9).
DiscusiónEl RDCA ha utilizado diversas fuentes de información para detectar los casos y se ha combinado la captación pasiva con la activa, lo que permitió lograr una gran exhaustividad en la captación de defectos congénitos, por lo que consideramos que los datos presentados son una buena medida de la frecuencia de DTN en Asturias.
La tasa de prevalencia total de DTN registrada en Asturias para el período (12,2 por 10.000) no difiere de la de la mayoría de los registros del EUROCAT, excepto los de Austria, Italia y Croacia, que presentaron tasas más bajas. Por otra parte, el cociente espina bífida/anencefalia en nuestro registro es similar al de los registros franceses, del País Vasco y de Barcelona, y más bajo que el del resto de los registros del EUROCAT10, en relación con una mayor frecuencia de anencefalia registrada en Asturias (tabla 1).
Dentro del conjunto de España, el Registro de Anomalías Congénitas de la Comunidad Autónoma del País Vasco (RACAV) y el Registro de Defectos Congénitos de Barcelona (REDCB), ambos pertenecientes al EUROCAT, presentan frecuencias ligeramente más bajas que las del RDCA, sobre todo el REDCB, pero estas diferencias no son significativas10. Cuando comparamos nuestros resultados con los del Estudio Colaborativo Español de Malformaciones Congénitas (ECEMC), de base hospitalaria, debemos utilizar la tasa de prevalencia al nacimiento y no la total, dado que este registro no incluye los casos que terminan en aborto inducido10. Aun así, la prevalencia al nacimiento en nuestra Comunidad es aproximadamente un 50% inferior a la del ECEMC, lo cual puede explicarse por el gran impacto del diagnóstico prenatal en Asturias, así como por la distinta metodología de ambos registros.
Los DTN se asocian con frecuencia a otras anomalías estructurales. Esta frecuencia varía de unos estudios a otros1,6,12, con un valor medio aproximado del 20%. Las anomalías cromosómicas y las mutaciones génicas se identifican en menos del 10% de los DTN2. Estas cifras son similares a las encontradas en nuestro registro, que podrían ser mayores si aumentasen los estudios necrópsicos y citogenéticos en los abortos inducidos.
La eficacia del diagnóstico prenatal mediante ecografía y determinación de la alfa-fetoproteína sérica materna, y el elevado porcentaje de abortos inducidos asociados, han sido la principal causa del descenso de los DTN al nacimiento en nuestro estudio. Por ello, la prevalencia total refleja mejor que la prevalencia al nacimiento la frecuencia real de estos defectos. Sin embargo, el registro completo de los casos de DTN tras aborto inducido es complicado, como se ha puesto de manifiesto en diferentes publicaciones13–16, lo que determina unas tasas de prevalencia total inadecuadamente bajas, que afectan en mayor medida a la anencefalia. Creemos que éste no sería el caso del RDCA, que realizó una búsqueda activa de casos de aborto inducido en diferentes fuentes de información (servicios de atención al paciente, Registro de Interrupciones Voluntarias del Embarazo y programa de diagnóstico prenatal de los DTN); más bien esta exhaustividad en el registro podría explicar, en parte, nuestra (comparativamente) elevada tasa de anencefalia.
La proporción de abortos inducidos después del diagnóstico prenatal en Asturias fue la más alta de los registros EUROCAT10. Este resultado se puede relacionar con el inicio, en 1987, del programa de diagnóstico prenatal de los DTN mediante determinación de la alfa-fetoproteína, con la política de rastreo de defectos congénitos mediante ecografía fetal en las semanas 12–14 y 18–20, y con la realización de acciones formativas específicas en ecografía fetal en 1998.
El resultado de corregir las tasas por la estimación de las pérdidas fetales espontáneas11 supuso en nuestro estudio un ligero descenso en la prevalencia total, fundamentalmente como consecuencia de una disminución de la anencefalia, defecto para el que los abortos inducidos fueron más, y más precoces.
La evolución temporal de la prevalencia total de DTN fue ligeramente descendente, aunque no de manera significativa, como consecuencia del descenso signifivativo de la espina bífida; descenso que no se puede atribuir a un subregistro de casos, por la exhaustividad del registro ya mencionada y porque la metodología se ha mantenido sin cambios a lo largo del estudio. De todos modos, el subregistro afectaría por igual a los distintos subtipos.
Un posible factor relacionado con este descenso podría ser la recomendación del suplemento periconcepcional de ácido fólico en la década de los noventa. Estudios publicados a principios de los años ochenta sugieren que el ácido fólico reduce el riesgo de recurrencia de los DTN17. Los resultados del MCR Vitamin Study18 de 1991 ratificaron esta hipótesis y, posteriormente, se confirmó que también prevendría la ocurrencia de primeros casos19. Basándose en estos resultados, en el año 1992 muchos países establecieron la recomendación de aumentar el consumo de ácido fólico en la dieta y con suplementos durante la edad reproductiva, o periconcepcional, cuando se planifica el embarazo. Países como Estados Unidos (1998), Canadá (1998) y Chile (2000) implantaron la fortificación obligatoria de los granos de cereal para asegurar que toda la población recibiera una cantidad mínima adicional1. Estudios posteriores probaron los efectos beneficiosos de dicha fortificación, logrando una reducción en la prevalencia total de DTN de hasta un 50%, e incluso mayor en zonas con una frecuencia inicial más alta20–22. Sin embargo, en Europa continental no se ha detectado, desde 1991, un descenso significativo de los DTN en sus diferentes categorías, lo que indica que la política de la simple recomendación de la suplementación de ácido fólico periconcepcional no es suficiente5,23,24. En Reino Unido e Irlanda sí se observó una tendencia descendente en la prevalencia total de DTN, aunque la tendencia es similar a la que existía antes de 19915,23.
En España, las políticas oficiales de suplementación de ácido fólico y las campañas informativas a los profesionales25 se iniciaron en el año 2001. Un estudio reciente del ECEMC26 mostró que el número de mujeres que consumieron ácido fólico durante la gestación se elevó considerablemente desde 1991, siendo del 88,5% en el período 2003-2004. Sin embargo, sólo un 17,4% de ellas lo hizo antes de saber que estaba embarazada.
Por ello, pensamos que no se puede atribuir el descenso en la frecuencia de espina bífida en Asturias al efecto de la suplementación con ácido fólico. Por otra parte, tampoco se ha demostrado que dicha suplementación afecte de forma selectiva a la espina bífida5,13,21,22. Además, los registros de RACAV y REDCB, de base poblacional y metodología similar a la nuestra, no han observado cambios en la prevalencia total de DTN y de sus subtipos durante el mismo período, pero cabe destacar que la prevalencia total de espina bífida en nuestra Comunidad, mayor en los primeros años de la década de los noventa, tiende a converger en los últimos años con la de estos registros27,28.
En consecuencia, creemos que el descenso en la prevalencia total de espina bífida, sin afectar a la frecuencia de anencefalia, podría tratarse de un hecho temporal que es preciso comprobar en el futuro, y que la política de simple recomendación de suplementación periconcepcional de ácido fólico no está teniendo el impacto deseado, siendo la prevención secundaria mediante el diagnóstico prenatal y la consiguiente interrupción del embarazo la causa del marcado descenso de los DTN en los nacidos.
En conclusión, durante el período estudiado, los DTN presentaron en Asturias una frecuencia media-alta, con una tendencia descendente de la espina bífida y un impacto del diagnóstico prenatal en la frecuencia al nacimiento muy importante.
Contribución de autoríaTodos los autores participaron en el diseño, la adquisición de los datos y la escritura del artículo o su revisión crítica con importantes contribuciones intelectuales. Todos los autores revisaron y aprobaron la versión final para su publicación. Enrique García López y Carmen Mosquera Tenreiro realizaron el análisis y la interpretación de los datos. Enrique García López es el responsable del artículo.
Este trabajo ha sido posible gracias a las gerencias y a los trabajadores de los hospitales públicos del Principado de Asturias (Hospital de Jarrio, Hospital Carmen y Severo Ochoa, Hospital San Agustín, Hospital Universitario Central de Asturias, Hospital de Cabueñes, Hospital Grande Covián, Hospital V. Álvarez-Buylla y Hospital Valle del Nalón). Han colaborado en la recogida de datos y han facilitado en todo momento nuestra labor.