El objetivo de este artículo es revisar algunos conceptos sobre la relación entre el coste-efectividad de una tecnología sanitaria, su impacto presupuestario y las decisiones que se pueden tomar a partir de una evaluación económica. Las siguientes reflexiones pueden ayudar a entender mejor un concepto que es muy importante a la hora de interpretar los resultados de una evaluación económica: la tecnología eficiente, también llamada «coste-efectiva». En muchas ocasiones, una relación coste-efectividad determinada, sin ninguna otra información adicional, resulta insuficiente para decidir si una tecnología es coste-efectiva o no, y para tomar decisiones sobre ella. A pesar de ello, es frecuente encontrar evaluaciones económicas que llegan a conclusiones incorrectas. Los aspectos que se tratarán en el presente artículo no son, ni mucho menos, originales, sino que forman parte de la literatura sobre reglas de decisión en evaluación económica1. No obstante, es posible que algunos lectores encuentren alguna utilidad en su lectura.
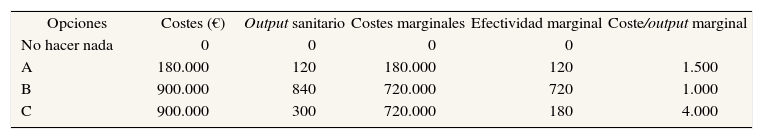
Un ejemploPara conferir utilidad a esta nota vamos a utilizar un ejemplo numérico (tabla 1). Supongamos que, en la actualidad, la opción que se está utilizando mayoritaria- mente para tratar un determinado problema de salud es A, pero aparece una nueva opción, la B o la C, que es más cara y más efectiva, y nos planteamos si debemos financiarla o no en detrimento de la antigua (estamos, por tanto, ante tratamientos mutuamente ex- cluyentes). Para ayudar a tomar esta decisión se realiza un análisis de coste-efectividad, que produce los resultados mostrados en la tabla 1. En este ejemplo, suponemos que la medida del output sanitario es común en las dos nuevas opciones.
Considerando estos resultados, y dada la necesidad de aconsejar qué opción prescribe el análisis de coste-efectividad realizado, no es infrecuente apelar al concepto de alternativa «más coste-efectiva». En ocasiones2–4, dicha alternativa se identifica con la que tiene una razón coste-efectividad menor, y se supone que el resultado del análisis aconseja que se priorice ésta. Por tanto, diríamos que la opción B es preferible a la A, y que la opción A sigue siendo preferible a la C.
En realidad, el razonamiento no es correcto. Aunque la razón de coste-efectividad de B (CEB) sea menor que la de A (CEA), no podemos concluir que hay que dejar de financiar A y pasar a financiar B, ya que B es más cara y requiere un presupuesto mayor. Lo que sí se puede decir es que si CEB < CEA, podemos dejar de financiar A y gastarnos los 180.000 € en B. Estamos suponiendo, por tanto, que B es un programa divisible y podemos poner en práctica únicamente el 20% (180.000/900.000). Si esto no es divisible, no podemos sustituir A por B a pesar de que CEB > CEA. En cuanto al segundo caso, tampoco es cierto que si CEC > CEA no deba financiarse C. Como argumentan Prieto et al5, se trata de «escoger la intervención más efectiva para la cual el coste incremental por unidad de efectividad ganada es inferior al precio máximo que se quiere pagar». Para explicar la lógica de estos 2 argumentos utilizados hay que acudir a la distinción entre tratamientos excluyentes y compatibles.
Tratamientos excluyentes y compatiblesPara interpretar mejor las relaciones de coste-efectividad, es conveniente recordar la diferencia entre tratamientos mutuamente excluyentes y mutuamente compatibles. En los primeros el paciente sólo puede recibir (con criterios clínicos) una de las opciones de tratamiento y, por tanto, la financiación de una implicaría la exclusión de la otra. En los segundos, los tratamientos se prescriben para diferentes problemas de salud, por lo que la financiación de uno no excluiría la del otro. La mayor parte de los estudios de coste-efectividad comparan tratamientos mutuamente excluyentes, ya que suelen evaluar diferentes opciones para un mismo problema de salud, como en el ejemplo de la tabla 1. Sin embargo, la decisión de si hay que financiar el nuevo tratamiento B no se puede tomar exclusivamente a partir de los resultados del estudio de coste-efectividad realizado, sea cual sea la razón de CE obtenida. La información que necesitamos para tomar una decisión, además del coste-efectividad de B respecto a A, es la siguiente:
- 1.
Los cocientes coste-efectividad de todos los tratamientos mutuamente compatibles que componen la cartera de servicios del Sistema Nacional de Salud (SNS). Con ello obtendríamos una ordenación completa de todos ellos según la razón CE.
- 2.
El impacto presupuestario de B.
- 3.
Las opciones que se dejarán de financiar para poder asumir los costes adicionales (720.000 €) que supone el nuevo tratamiento B. La opción (u opciones) de donde obtendríamos los 720.000 € necesarios tendría(n) que ser la(s) que tuviera(n) una razón CE mayor entre las que componen la cartera de servicios. Por simplificar, supondremos que es una única opción, que denominamos M, y su coste-efectividad es CEM. Podemos considerar CEM como una especie de «precio sombra» o «valor monetario de la salud», ya que es el precio máximo que, antes de la introducción de B, está gastándose el sistema sanitario para ganar una unidad de salud.
Con toda esta información ya podríamos tomar una decisión, y diríamos que hay que financiar B si CEM > CEb. La razón es obvia: si CEM > CEB, gastar 720.000 € en B en lugar de en M permite producir más salud. Por supuesto, estamos suponiendo que las unidades de medida del output sanitario de M y de B son comparables.
En teoría, los estudios de coste-efectividad no permitirían tomar decisiones sobre priorización si no hay información sobre el coste-efectividad de los tratamientos mutuamente compatibles que componen la cartera de servicios del SNS. Esto no quiere decir que ningún análisis de coste-efectividad proporcione información valiosa para la toma de decisiones. Es posible que el resultado de un análisis sea que la nueva tecnología sea dominante (p. ej., más barata y más efectiva), con lo cual no hay duda sobre la decisión que habría que tomar. También es posible que la razón sea tan pequeña, o tan grande, que un gestor pueda considerar que no le hace falta saber nada más para tomar la decisión. Por ejemplo, en el caso de la vacuna del virus del papiloma humano, un buen número de prestigiosos profesionales consideraron obvio que un coste por muerte evitada de 8 millones de euros era demasiado elevado6. Sin embargo, como principio general, los estudios de coste-efectividad producen razones de coste-efectividad que no proporcionan reglas de decisión claras.
Valores monetarios y reglas ad hocPuede parecer sorprendente que para interpretar los resultados de una evaluación económica sea necesario conocer el coste-efectividad de los tratamientos que componen toda la cartera de servicios del SNS. Esto podría llevar a pensar que realizar estudios de coste- efectividad es muy poco útil, ya que estamos lejos de poder tener la información necesaria para tomar decisiones a partir de la razón de coste-efectividad. Teóricamente, así es. Sin embargo, podría considerarse que esta postura es un tanto maximalista y que hay maneras de tomar decisiones correctas, a partir de estudios de coste-efectividad, aplicando reglas de decisión simples, pero razonables. Si intentamos ser prácticos, ¿hay reglas para tomar decisiones que no requieran conocer el coste-efectividad de toda la cartera de servicios del SNS?
Algunos autores han apelado a reglas de decisión que podemos denominar ad hoc, esto es, que no tienen un fundamento teórico claro, pero que parecen ser de sentido común. Por ejemplo, los nuevos stents recubiertos de fármaco son más caros que los anteriores, pero más efectivos. Se ha sugerido7 que, al suponer un coste por revascularización evitada inferior al de los antiguos stents, tienen un coste-efectividad «razonable» y deben ser financiados. El razonamiento parece claro: si los nuevos stents tienen un coste-efectividad menor que los anteriores, se tienen que financiar. Esta lógica es correcta dentro de un caso de impacto presupuestario nulo. Esto es, si el presupuesto que dedicamos a revascularizaciones con stents tradicionales lo dedicamos a revascularizaciones con stents antiproliferativos, el razonamiento es correcto. Podemos sustituir los stents tradicionales por los nuevos. La consecuencia es que implantaremos menos stents, porque son más caros, pero los que ponemos son de mejor calidad.
Ahora bien, si se prevé que no se va a poder mantener el presupuesto constante, y se tendrá que gastar mucho más, ya no podemos utilizar la razón de coste- efectividad como argumento para justificar la financiación de la nueva tecnología, pues únicamente una parte de dicho presupuesto vendrá de lo que deja de gastarse en los antiguos stents. Para seguir tratando a la misma cantidad de pacientes con el nuevo tratamiento, más efectivo pero más caro, hemos de utilizar parte del presupuesto que antes iba destinado a financiar otro programa. Necesitamos saber el coste-efectividad del programa con que van a competir por el presupuesto los nuevos stents, o cuál es la pérdida de la efectividad del SNS al no poder dar tratamiento a esos pacientes porque el presupuesto se ha destinado a los receptores del nuevo stent. Esto requiere, de nuevo, conocer el coste-efectividad de los programas que componen la cartera de servicios. En la medida en que los gestores crean que pueden introducir los nuevos stents con un impacto presupuestario nulo, la decisión de sustituir los antiguos es correcta; en la medida en que esto no sea posible, necesitamos conocer CEM. Lo que acabamos de aplicar a los stents es el caso de la opción B de la tabla 1.
Se han utilizado otras reglas, como la de comparar la razón CE con el coste del tratamiento, especialmente en el caso de tratamientos preventivos. Esto es, si el coste-efectividad por caso evitado es de X € y el coste del tratamiento es de Y €, en la medida en que X < Y se considera que el tratamiento tiene un coste-efectividad razonable8, ya que parece implicar que prevenir un caso cuesta menos que tratarlo. Otros argumentan a favor de una opción basándose en el coste-efectividad medio9 o en el marginal3. Ninguno de estos argumentos puede utilizarse como si se desprendiera de forma automática de los resultados de un análisis de coste-efectividad.
Posibles solucionesEn caso de no disponer de toda la información necesaria, mencionada anteriormente, para tomar decisiones a partir de un estudio de coste-efectividad, cualquier criterio que se utilice como alternativa tendrá sus limitaciones. Veamos qué criterios se pueden utilizar en función de la información disponible. Supondremos que, al menos, conocemos los costes y los efectos sobre la salud de la nueva opción respecto a la anterior. Es decir, partimos de un análisis de coste-efectividad como el de la tabla 1 y queremos saber qué decisión tomar con esas razones de CE, si no conocemos la CE de todos los tratamientos del SNS.
Supongamos que podemos estimar el impacto presupuestario (supuesto realista) e identificar las alternativas que competirán con B por los 720.000 € adicionales que necesitamos para sustituir el programa A por el B. Esto daría lugar a un tipo de análisis que se conoce como program budgeting and marginal analy- sis10. Este método requiere identificar las opciones que competirán con B por el presupuesto. Supongamos que los 720.000 € que necesitamos para financiar B provienen de Z. La regla de decisión será, entonces, que si lo que ganamos dedicando 900.000 € a B es más de lo que perdemos en términos de salud al no financiar A y Z, hay que financiar B. Este razonamiento vale tanto para B como para C. Nótese que la relación entre las razones de CEA y CEB (saber cuál es mayor) es irrelevante para tomar decisiones, en la medida en que B sea más costoso y efectivo que A. El único caso en que sería relevante sería bajo el supuesto de que B sea divisible, tanto técnica como «políticamente». Por tanto, realizar un análisis de coste-efectividad como el de la tabla 1 no nos indica si hay que financiar o no B, ya que la financiación de B afectará a otras opciones como Z que no están estudiadas por los análisis de coste- efectividad de un grupo de tratamientos mutuamente excluyentes. Un ejemplo de esto lo encontramos en Ba- rrett et al11, que estiman el coste de financiar el tratamiento con herceptina en un determinado hospital (2,3 millones de libras esterlinas), y en su análisis comparan lo que se tendría que dejar de tratar en el hospital si se utilizaran 2,3 millones de libras esterlinas cada año para financiar dicho fármaco. Desde el punto de la vista metodológico, es un planteamiento bastante correcto, pero no perfecto. No puede ser perfecto porque no disponemos de toda la información necesaria para tomar una decisión óptima, como hemos dicho antes. Al no disponer de información del coste-efectividad de todas las alternativas posibles, sería posible que CEZ > CEB > CEm. Por tanto, la decisión de sustituir A+Z por B puede producir más beneficios que costes, lo cual es correcto. Sin embargo, esto es compatible con que CEB > CEM, lo que implica que se está financiando una opción que compra salud a un precio excesivo.
Supongamos ahora que no es posible identificar las opciones que competirán con el nuevo tratamiento B. Por ejemplo, si se aprueba un nuevo fármaco más efectivo que la opción actual, pero más caro, es difícil hacer una predicción de los programas que tendrán que reducirse para financiarlo. Imaginemos que tenemos información sobre CEM porque la hemos podido calcular de forma empírica12. En este caso, la regla de decisión sería que hay que financiar B si CEB < CEM. ¿Qué limitación tiene esta regla de decisión? Que no se observa el coste de oportunidad de financiar B. El hecho de que CEB < CEM, lo «único» que nos dice (y es mucho) es que si se decide financiar ese tratamiento estamos comprando salud a un precio razonable. Ahora bien, si no podemos identificar los tratamientos contra los que competirá, es posible que para financiar B acabemos quitando recursos de un tratamiento W tal que CEW < CEb < CEm. Y esto reduciría el nivel de salud de la población.
Supongamos ahora que disponemos de información tanto de las opciones que compiten con B como del valor de CEM. En este caso tenemos toda la información necesaria para adoptar una decisión óptima. Puesto que hemos partido del supuesto de que no conocemos el coste-efectividad de todos los tratamientos de la cartera de servicios del SNS, supongamos de nuevo que conocemos CEM a partir de estudios empíricos. La clave para tomar decisiones correctas estará, por tanto, en que el CEM que calculamos empíricamente coincida con el real, esto es, con el que observaríamos si conociéramos el coste-efectividad de todos los tratamientos que componen la cartera del SNS.
La última posibilidad que queremos añadir es la de abandonar el coste-efectividad y el coste-utilidad, y volver al análisis de coste-beneficio, en el cual los beneficios se miden en unidades monetarias. El análisis de coste-beneficio nos permite decir si los beneficios de una tecnología son superiores a sus costes de forma directa, y produce una regla de decisión evidente: financiar el tratamiento si los beneficios superan a los costes. Ahora bien, en un contexto de presupuesto cerrado, seguiríamos teniendo el problema de que no observamos el coste de oportunidad, esto es, las alternativas que dejaríamos de financiar para adoptar B. El uso del análisis de coste-beneficio no evita tener que plantearse las opciones que dejarán de financiarse. Su ventaja respecto a estimar empíricamente CEM es que no asume las limitaciones implícitas en los métodos de medida de la salud. Por ejemplo, si CEM es el valor monetario de los años de vida ajustados por calidad (AVAC), utilizar una regla de decisión basada en dicho valor monetario implica aceptar las limitaciones de los AVAC y aceptar que el objetivo del SNS es maximizar el número de AVAC. El análisis de coste-beneficio no tiene estos problemas (tiene otros). De hecho, algunas guías de evaluación de tecnologías médicas aconsejan el uso del análisis de coste-beneficio en los casos en que los AVAC claramente no reflejan el valor social de los tratamientos médicos.
ConclusionesSi no disponemos de información del coste-efectividad de toda la cartera de servicios, podemos intentar tomar decisiones conociendo las alternativas que dejarán de financiarse si se financia la nueva, y el valor monetario de la salud, CEM. Sin embargo, si no conocemos alguno de estos elementos, aumenta la posibilidad de cometer errores. Si no conocemos ninguno de los dos y únicamente conocemos las razones de CE derivadas del análisis de coste-efectividad de tratamientos mutuamente excluyentes, la información no es suficiente para realizar recomendaciones.
El análisis de coste-efectividad produce razones de CE que, salvo excepciones, no permiten tomar decisiones de asignación de recursos si no se cuenta con información adicional. Se pueden tomar decisiones acertadas (aunque no óptimas) si disponemos de información sobre el coste de oportunidad o sobre el valor monetario de la salud. Para disponer de esta información es necesario fomentar una cultura de evaluación que permita conocer las relaciones de coste- efectividad de las tecnologías sanitarias existentes. Puesto que en muchas ocasiones no será posible identificar con precisión el coste de oportunidad, la única alternativa será, como ya ocurre en otros ámbitos de la administración pública, contar con un valor monetario de referencia que nos diga que, al menos, el precio que pagamos por la salud es razonable. Los valores utilizados en la actualidad se han establecido de una forma un tanto arbitraria, y en ese sentido es importante fomentar la investigación dirigida a conocer mejor cuál es el valor real de un AVAC o, dicho de otra forma, lo que la sociedad estaría dispuesta a pagar por conseguir un AVAC adicional. Por último, no parece razonable hacer recomendaciones basándose en razones de CE, como el coste por paciente asinto- mático, el coste por caso evitado u otras similares, por lo que sería recomendable hacer un mayor esfuerzo para expresar los resultados de los estudios de coste-efectividad en unidades comparables para las cuales se disponga de una referencia.