La condición biológica con que llegamos a la vejez depende en gran medida de los estilos de vida mantenidos. De éstos, el binomio actividad-obesidad emerge como un factor principal de riesgo de fragilidad; los cambios biológicos que promueven, en especial el estado de inflamación crónica, son efectores principales de sarcopenia, que es una de las bases de la fragilidad. Tales cambios también afectan a otros sistemas, como el vascular y el nervioso central, que concurren en el daño junto con la sarcopenia y sugieren un rasgo común. Este hecho apoya que la alteración de dichos sistemas pueda ser incorporada al fenotipo de fragilidad. Con estas premisas, y con los datos del estudio Toledo para un Envejecimiento Saludable, se propone una ampliación del fenotipo de fragilidad haciéndolo operativo mediante una escala que evalúa el rasgo de fragilidad.
A person's biological condition in old age partly depends on previous lifestyles. Consequently, the relationship between physical activity and obesity is emerging as an important risk factor for frailty, especially due to the resulting chronic inflammatory state. This inflammation not only leads to sarcopenia, which is basic to the development of frailty, but also affects the vascular and central nervous systems. Therefore, we believe that these two systems should be included in the frailty phenotype. Under these premises, and using the data from the Toledo Study for Healthy Aging, we propose that the frailty phenotype be extended and recommend the use of a scale to evaluate the frailty trait.
El envejecimiento no es un hecho homogéneo en la población. Mientras algunos individuos llegan a edades avanzadas de la vida en plenas facultades, otros, en cambio, padecen en estos años enfermedades y déficit que erosionan gravemente su calidad de vida. La condición en que llegamos a la vejez comienza a gestarse en edades tempranas. En la niñez y la adolescencia, la presencia de obesidad es un importante predictor de enfermedad vascular y diabetes en la edad adulta1. Asimismo, la personalidad y los estilos de vida, junto con el estado de salud, en los sujetos menores de 50 años, son predictores principales del estado de salud en la vejez2,3. Por tanto, la capacidad o la reserva biológica con que llegamos a la vejez va a depender (además de nuestra herencia genética) principalmente de cómo hemos vivido. Es decir, cada individuo puede, en cierta medida, predeterminar su salud futura.
Clásicamente, el estudio del envejecimiento se centró en los procesos biológicos que conducen a él, en las enfermedades relacionadas con la edad y en los llamados síndromes geriátricos (discapacidad, trastorno cognitivo, etc.), determinantes de la calidad de vida en el anciano. La vía causal era sobre todo la enfermedad y se echaba en falta un marco conceptual y experimental que explicara otras vías hacia la discapacidad en ausencia de enfermedad relevante, así como la gran variabilidad en la manera de envejecer de las personas. La fragilidad, un síndrome que emerge en los últimos 10 años, viene a proporcionar este marco conceptual al cual nos referíamos; en el presente trabajo revisaremos su fenotipo y bases biológicas, y propondremos un nuevo instrumento de medida.
FragilidadLa fragilidad como concepto surgió hace varias décadas y en la actualidad hay un acuerdo general en cuanto a que el núcleo de la fragilidad es un incremento de la vulnerabilidad a estresores producido por una alteración en múltiples e interrelacionados sistemas, que conduce a una disminución en la reserva homeostática y de la capacidad de adaptación del organismo, y lo predispone a eventos adversos de salud4.
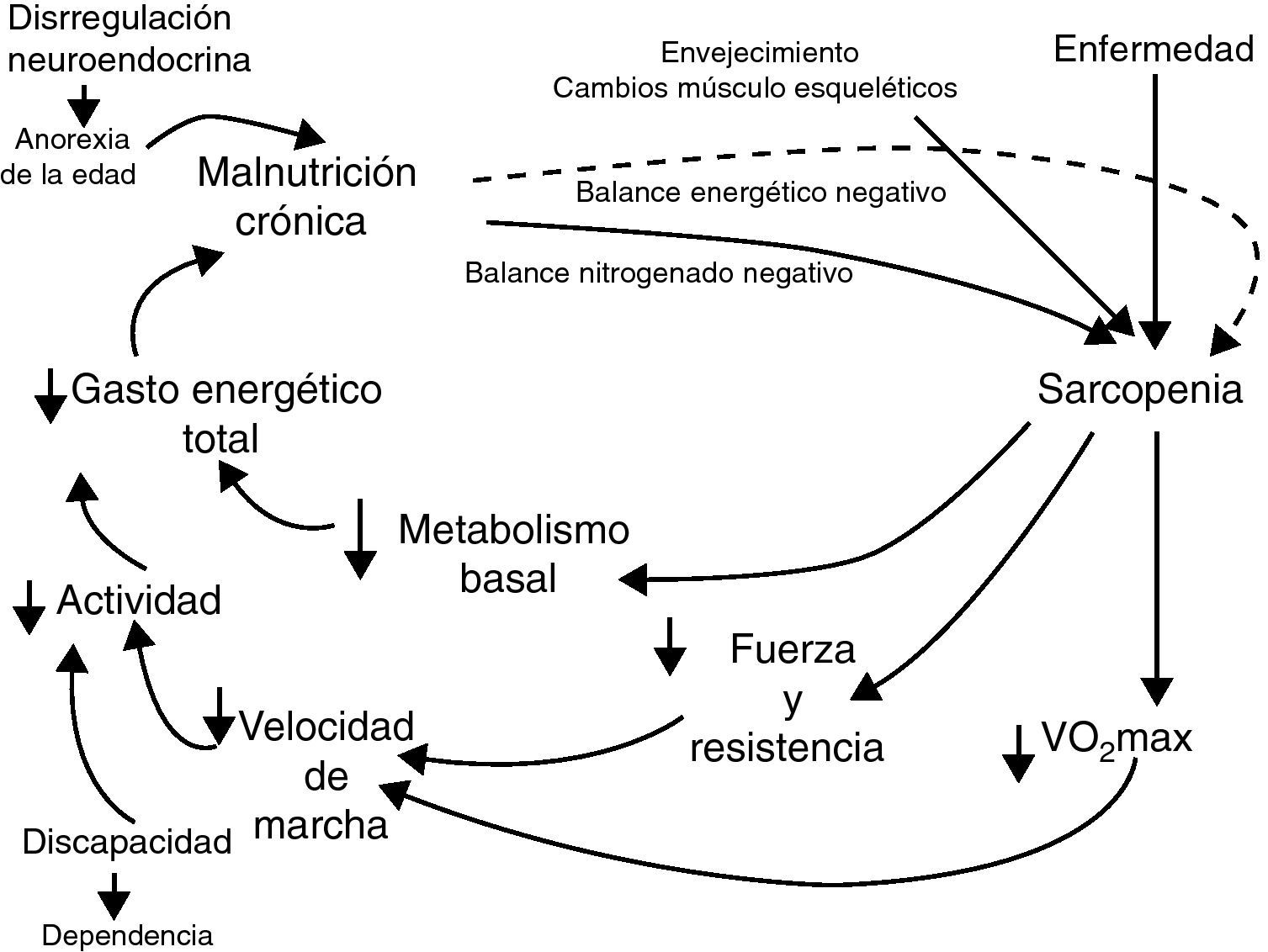
Así como la definición mantiene un aceptable consenso en torno a ella, el fenotipo de fragilidad está sujeto a continuo debate. En la última década, con el desarrollo de estudios epidemiológicos centrados en el estudio del envejecimiento, el concepto de fragilidad se desarrolla de forma más empírica y se asume que es una condición biológica e inestable del ser, y que es un fenómeno principalmente relacionado con el envejecimiento. Dos aproximaciones al fenotipo de fragilidad surgen al amparo de grandes estudios poblacionales de envejecimiento. En primer lugar, con el Canadian Study of Health and Aging (CSHA) surge el concepto de fragilidad como una acumulación de déficit5. Así como las células, los procesos fisiológicos y los sistemas acumulan déficit con el envejecimiento, con la edad los seres humanos presentan un incremento en el número de enfermedades y situaciones que condicionan su relación con el entorno y su respuesta a estresores internos y externos. La carga de más o menos déficit determinará el tiempo restante hasta la muerte del sujeto, actuando así como un estimador de la edad biológica. Para hacer operativo este fenotipo de fragilidad, Rockwood y Mitnitski5 identifican hasta 80 déficit. El espectro de los déficit es amplio e incluye diferentes dimensiones: estado cognitivo, emocional, nutricional y funcional, capacidad de comunicarse, motivación y percepción del estado de salud, fuerza, equilibrio y movilidad, sueño y aspectos sociales. La escala es predictora de mortalidad6 y desde el punto de vista clínico puede ser útil, dentro de una evaluación geriátrica integral, para identificar sujetos con riesgo de eventos adversos de salud a corto y medio plazo, así como para ayudar a la toma de decisiones en la asignación de recursos. No obstante, desde nuestro punto de vista, la escala presenta algunas limitaciones: la inclusión de afecciones o condiciones que no comparten un constructo biológico la hacen poco útil para la identificación de los determinantes fisiopatológicos de la fragilidad, y la inclusión de déficit funcionales la aleja del concepto de fragilidad como un estado “precursor” de discapacidad sobre el cual puede actuarse para prevenirla. En segundo lugar, de la mano del Cardiovascular Health Study (CHS) se ha desarrollado un nuevo fenotipo de fragilidad. Walston y Fried7,8 han desarrollado un constructo cuyas bases son la sarcopenia y el disbalance energético, y establecen una relación de retroalimentación entre ellos, llamada «ciclo de la fragilidad» (fig. 1). Identifican cinco dimensiones en el constructo: debilidad, baja resistencia al esfuerzo, lentitud, baja actividad física y pérdida de peso, y las hacen operativas en cinco criterios. Dividen a la población en frágiles (aquellos que cumplen tres o más criterios), prefrágiles (si cumplen uno o dos criterios) y no frágiles (los que no cumplen ninguno). Con los datos del CHS8 demuestran que el síndrome tiene un alto impacto en la población, con una prevalencia de sujetos frágiles del 7% entre los mayores de 65 años y de prefrágiles del 47%. También ponen de manifiesto una clara relación de la fragilidad con la edad y además muestran que ser frágil es un buen predictor de hospitalización, caídas, discapacidad, disminución de la movilidad y mortalidad a corto y medio plazo. El constructo de Fried y Walston7,8 cumple con los criterios de la definición de fragilidad: es un fenómeno biológico, que afecta a múltiples sistemas y que confiere vulnerabilidad al individuo. Asimismo, es una situación definida, precursora de síndromes geriátricos (discapacidad, caídas, etc.), con unos criterios estandarizados, que ha posibilitado el desarrollo de numerosos estudios epidemiológicos y la comparación entre ellos. Estos motivos son los que han cimentado el éxito del constructo, y por ello es la aproximación a la fragilidad que utilizaremos en este trabajo.
Ciclo de la fragilidad8.
Los estudios epidemiológicos realizados en la última década han avalado los resultados del CHS. Las prevalencias de fragilidad halladas en los estudios con criterios homologables arrojan una estimación del 7% al 12%9. Los estudios españoles corroboran que la fragilidad tiene una gran impacto en nuestro país: el Estudio Toledo para un Envejecimiento Saludable (ETES)10 arroja una prevalencia de fragilidad del 8,4% (mayores de 64 años) y muestra una clara relación con la edad; en el estudio FRADEA de Albacete11 la prevalencia alcanza el 16,9% (mayores de 69 años); y en el estudio de Peñagrande12 se sitúa en el 10,3% (mayores de 64 años). No obstante, otros estudios muestran importantes discrepancias en las estimaciones: un estudio europeo13 realizado en 10 países (Share Study) muestra una prevalencia del 17%, con un 27% en España. En otro estudio14 realizado en varios países de Latinoamérica y el Caribe, la prevalencia en las mujeres osciló entre el 30% y el 48%, y en los hombres entre el 21% y el 35%. Es de destacar que, aunque ambos estudios se basan en el constructo de Fried, la operatividad de los criterios es sustancialmente distinta, lo cual nos hace sospechar que estas diferencias pueden explicarse por diferencias metodológicas.
Los estudios de incidencia de fragilidad son más escasos. El Women's Health Initiative Observational Study15, con más de 4.000 mujeres, muestra una incidencia de fragilidad a los 3 años de seguimiento del 14,8%, y el CHS, con más de 5000 hombres y mujeres, refiere una incidencia del 7,2% en 4 años8.
La importancia que ha adquirido el síndrome en los últimos años radica en que los sujetos frágiles están en riesgo de importantes eventos adversos sobre la salud a corto, medio y largo plazo. El estudio EPESE16, realizado en hispanos, muestra que el 84% de los sujetos clasificados como frágiles fallecieron durante los 10 años de seguimiento, mientras que sólo murieron el 33% de los no frágiles; relación con la mortalidad que ha sido contrastada en otros estudios8,15,17. Además, la fragilidad es un poderoso predictor de discapacidad8,17,18, hospitalización8,18, caídas8,17, pérdida de la movilidad8 y enfermedad cardiovascular19.
En estudios transversales8,16,19, la alteración cognitiva, el rasgo distímico y la enfermedad vascular presentan una potente asociación con la fragilidad. En estudios longitudinales, estos factores también se muestran como predictores de fragilidad16,19. En nuestro medio, el ETES10 también muestra un marcado aumento de la fragilidad para estas afecciones. Desde otro punto de vista, en los sujetos frágiles es casi constante la presencia de estos trastornos: la prevalencia de deterioro cognitivo es del 46%, la de rasgo depresivo del 50% y la de enfermedad vascular sintomática (isquemia cerebral, cardiopatía isquémica, arteriopatía periférica) del 30%, frente al 9%, el 7,7% y el 10,7% en los sujetos no frágiles (datos no publicados del ETES). La vía causal puede tener varias fuentes, que no son excluyentes entre sí. La fragilidad es una situación inestable, y el tiempo que una persona vive en fragilidad es limitado20, lo cual sugiere que puedan compartir bases fisiopatológicas comunes, pero con penetrancia variable (p. ej. mecanismos inflamatorios), que además de favorecer la aparición de enfermedad y de fragilidad predispongan a una persona a entrar en fragilidad una vez avance la enfermedad y predispongan a otra a expresar antes una enfermedad (p. ej., enfermedad de Alzheimer). En este sentido, las alteraciones de la pared vascular y de los procesos cognitivos-ejecutivos-anímicos podrían entrar a formar parte del fenotipo de fragilidad.
Bases biológicas de la fragilidadComo ya se ha comentado, la pérdida de la homeostasis se origina por la alteración de múltiples e interrelacionados sistemas. Este término, que es un aspecto central de la definición, ha sido recientemente apuntalado por Gruenewald et al21, quienes con datos del MacArthur Study of Successful Aging evidenciaron que la acumulación de biomarcadores empleados para evaluar la carga alostática de un sujeto tiene una relación dosis-efecto con la incidencia de fragilidad. Desde sus orígenes, las bases biológicas de la fragilidad se han relacionado con los cambios fisiológicos asociados al envejecimiento. Así, las alteraciones en el sistema neuroendocrino, con un descenso de la testosterona y de otras hormonas sexuales, un descenso del sulfato de deshidroepiandrosterona (DHEA) y del eje factor de crecimiento-factor de crecimiento similar a la insulina 1 (GH-IGF1, Growth Factor-Insulin-like Growth Factor 1), y un aumento del cortisol y de las alteraciones del sistema inmunitario expresadas por una elevación de los factores proinflamatorios, se han implicado en el proceso de sarcopenia en el anciano y se consideran el núcleo fisiopatológico de la fragilidad7,22. Los estudios poblacionales longitudinales llevados a cabo en la última década han confirmado parcialmente las hipótesis iniciales. Así, se ha observado que los marcadores inflamatorios y la testosterona libre (en los hombres) son predictores de fragilidad23–27, mientras que la infraexpresión de IGF-1 se ha mostrado como predictor de sarcopenia26, pero no de fragilidad23, y por último la DHEA, de momento, sólo se ha asociado a fragilidad en estudios transversales28. En los últimos años han emergido como coadyuvantes de fragilidad factores relacionados con el desequilibrio energético y nutricional. Así, en estudios transversales y longitudinales15,16,29 se ha observado que la obesidad se asocia a fragilidad, y es de especial interés la obesidad abdominal. Además, surge el concepto de «obesidad sarcopénica» fenotipo, que podría encuadrarse en un fenotipo ampliado de la fragilidad30,31. Asimismo, una situación relacionada con la obesidad, la resistencia a la insulina, se configura como un determinante de sarcopenia y un factor de riesgo de fragilidad24,32. También algunos déficit de micronutrientes, como la vitamina D, se han mostrado como consistentes efectores de fragilidad23,33. Finalmente, en la actualidad se discute el papel que tiene en la fragilidad la disfunción del sistema leptina/adiponectina34.
La inactividad, precursor de la fragilidadLa condición cardiovascular es un determinante conocido de la salud. Se acepta que el umbral por debajo del cual es predictor de malos resultados de salud es 8 mets en los hombres y 7 mets en las mujeres. La condición cardiovascular sufre, desde los 45 años de edad, un lento y progresivo deterioro hasta la vejez. La progresión de este deterioro es independiente del nivel alcanzado previamente, si bien es sensible a los cambios en los estilos de vida. En este sentido, el Aerobics Center Longitudinal Study (ACLS)35 ha mostrado que los sujetos sedentarios y obesos alcanzan un dintel de ajuste vascular relacionado con problemas de salud incluso 20 años antes que aquellos no obesos y activos.
Al igual que la condición cardiovascular, la masa muscular también disminuye con la edad. Se alcanza un pico máximo entre la segunda y la tercera décadas de la vida, y a partir de entonces se observa un progresivo declinar. Se estima que entre los 20 y los 80 años se pierde un 30% de la masa muscular36. Esto se traduce en un alto riesgo de presentar sarcopenia en la vejez, la cual puede alcanzar el 50% en los mayores de 80 años37. En ambos casos, la condición en que llegamos a la vejez puede variar notablemente de unos sujetos a otros, y esta variabilidad se explica en buena parte por el grado de actividad física desarrollado durante la vida. El sedentarismo ha mostrado ser un potente factor de riesgo independiente de mortalidad total y específica38,39, que en algún estudio explica hasta un tercio de las muertes por cáncer de colon, diabetes y enfermedad coronaria40, y es un determinante de arteriosclerosis41, deterioro cognitivo42 y depresión43. Desde un punto de vista funcional, la inactividad es un predictor independiente de limitación de la movilidad44 y se asocia a una pobre masa muscular45. En los siguientes apartados indagaremos acerca de qué mecanismos fisiopatológicos se sugieren como posibles explicaciones.
Actividad y sistema nervioso centralEn la última década ha habido un progresivo incremento de evidencia científica sobre el papel de la actividad como modulador de la función y de la estructura del sistema nervioso central. En estudios observacionales se ha hallado que el grado de actividad física es un factor determinante independiente del rendimiento cognitivo y de la depresión. Los estudios transversales muestran que los sujetos más sedentarios tienen un rendimiento cognitivo peor y mayor rasgo depresivo46,47. Asimismo, los estudios longitudinales evidencian que la actividad física es un factor protector ante la depresión, el declive cognitivo y la demencia42,47–49. Por otra parte, los sujetos con una alta condición cardiovascular tienen mejor rendimiento cognitivo50 y mayor área hipocámpica51 que aquellos con una condición cardiovascular más pobre. En estudios aleatorizados de intervención que han evaluado el impacto de los programas de ejercicio sobre la cognición, el resultado es congruente con los estudios observacionales y se encuentra un aumento del rendimiento cognitivo en los sujetos sometidos a la intervención respecto a los controles, principalmente en áreas tan sensibles para el envejecimiento cerebral como son el sistema ejecutivo y la memoria52,53. Esta mejora cognitiva puede explicarse, en parte, por un aumento en la plasticidad de las redes neuronales54, y no parece ser únicamente funcional sino que también se han visto cambios estructurales en el sistema nervioso central en respuesta al ejercicio, con un incremento de la sustancia gris y blanca55. Por tanto, hay concordancia entre los estudios realizados en animales y en humanos, tanto observacionales como de intervención, en que la actividad mejora el rendimiento cognitivo a corto, medio y largo plazo. La explicación biológica de este resultado no está clara. En los últimos años han aparecido evidencias de que el factor neurotrófico derivado del cerebro (BDNF, Brain Derived Neurotrophic Factor), una proteína implicada en el mantenimiento, el crecimiento y la supervivencia de las neuronas56, podría ser el enlace entre ejercicio y rendimiento cognitivo. El BDNF parece estar implicado en los procesos cognitivos, principalmente de aprendizaje y memoria57, y se observan concentraciones bajas de este factor en los sujetos con depresión y enfermedad de Alzheimer (enfermedades asociadas a un pobre rendimiento cognitivo)58,59. Congruentes con estos hallazgos, en los últimos años hay evidencias en animales60 y en humanos que muestran que el BDNF aumenta con el ejercicio60,61, si bien esta elevación es transitoria. A corto plazo, el BDNF puede explicar parte de los beneficios de la actividad física sobre la cognición. Sin embargo, hay otros factores que a medio y largo plazo también pueden estar implicados. En primer lugar, como se ha señalado, la inactividad es un factor de riesgo de morbilidad cardiovascular, depresión y también de declive cognitivo. A la vez, la enfermedad vascular es un determinante conocido de declive cognitivo62–64 en la población anciana. Asimismo, un marcador de arteriosclerosis como es el incremento del grosor de la íntima/media en la carótida se asocia con una mayor presencia de infartos silentes, de hiperintensidades de la sustancia blanca y de alteraciones cognitivas63. Los efectos sobre el declive cognitivo se ven incluso en sujetos con enfermedad vascular subclínica65. Esto sugiere que la relación entre sedentarismo y declive cognitivo también parece estar mediada por la presencia de enfermedad vascular. Complementariamente, la presencia de hiperintensidades en la sustancia blanca es un determinante de depresión de comienzo tardío, por lo que se ha propuesto el término «depresión vascular»66,67. La importancia de estos hechos deriva de que la enfermedad vascular es un factor modificable en la lucha contra el declive cognitivo y la depresión en el anciano. Las bases fisiopatológicas aún están en estudio, pero hay evidencias de que el óxido nítrico (NO) puede desempeñar un papel relevante. Esta sustancia es sintetizada por el endotelio vascular en un proceso modulado principalmente por la óxido nítrico sintetasa endotelial (eNOS). La disminución de la síntesis de NO por el endotelio es un potente factor en la génesis de enfermedad vascular68,69. Los estudios en animales70 muestran que el ejercicio aumenta la liberación de NO por el endotelio vascular que parece estar mediada por la eNOS. Otros estudios en animales también han hallado que una sobreexpresión de eNOS derivada de la actividad física previa a la oclusión arterial es un factor protector del daño neurológico agudo secundario a la isquemia y la reperfusión cerebrales69,71. Las vías por las cuales la sobreexpresión de eNOS puede explicar estos beneficios son múltiples, incluyendo mecanismos de vasodilatación, antitrombóticos, antiinflamatorios, antioxidantes o antiapoptóticos71. Tales hallazgos, unidos a que se han encontrado evidencias de una elevación del NO y un descenso de la endotelina 1 en humanos sometidos a programas de ejercicio aeróbico72, inducen a pensar que el ejercicio puede ser, entre otros, un agente preventivo y terapéutico en la enfermedad vascular cerebral71. Asimismo, la diabetes mellitus y el hiperinsulinismo se han mostrado como factores de riesgo de declive cognitivo, demencia, demencia vascular y tipo Alzheimer73–75. Las bases patológicas de su relación con la demencia vascular son claras y se explican por el riesgo vascular. La relación con la enfermedad de Alzheimer es menos consistente, pero los trabajos observacionales (transversales y longitudinales) identifican una asociación entre el hiperinsulinismo, la diabetes y la enfermedad de Alzheimer. El estudio de Luchsinger et al74 muestra que el hiperinsulinismo explica el 30% del riesgo atribuible de enfermedad de Alzheimer, y asciende al 39% cuando se incluye la diabetes mellitus. Una explicación es que las alteraciones vasculares observadas en el cerebro de los diabéticos aflorarían un déficit cognitivo de una enfermedad de Alzheimer subyacente75. Los estudios anatomoclínicos apoyan esta hipótesis, ya que se ha observado que los diabéticos con demencia presentan más lesiones vasculares y menos depósito de proteína beta amiloide que las personas dementes no diabéticas que tienen un perfil opuesto76. Otra interesante vía es la metabólica, que afirma que la acción de la insulina o mecanismos relacionados con ella intervendrían en la cascada de la proteína beta amiloide75,77,78.
Sedentarismo y obesidadLa obesidad es uno de los principales determinantes de la salud. Su etiología es compleja y en ella influyen múltiples factores (sociales, genéticos, culturales y ambientales), cuyo resultado final es un balance energético positivo. Entre ellos, el sedentarismo se ha considerado como un poderoso factor de riesgo de obesidad en todas las edades de la vida79. El Epic-Norfolk Prospective Population Study80, además de mostrar una franca asociación entre inactividad e incremento en el índice de masa corporal (IMC), evidencia una relación dosis-efecto entre la actividad y un menor incremento del IMC en el seguimiento. Otros estudios, controlando sesgos de causalidad inversa, muestran que la obesidad también se comporta más como un predictor de sedentarismo que al contrario81,82. No obstante, el estudio de Mortensen et al81 mostró que la inactividad se comporta como un factor de riesgo de incremento del IMC en sujetos que pasan a ser inactivos. Los resultados de estos estudios demuestran que la relación entre obesidad e inactividad es biyectiva, es decir, que la inactividad favorece el desarrollo de obesidad y viceversa.
Es conocido que la obesidad es uno de los principales determinantes modificables de mortalidad y comorbilidad83. Se estima que la obesidad disminuye la esperanza a los 40 años en 7 y 6 años en las mujeres y los hombres, respectivamente, y se acorta otros 6 años más en los fumadores84. Asimismo, es un factor de riesgo de enfermedad cardiovascular, síndrome metabólico y demencia, entre otros83,85. También la obesidad en la edad adulta es un determinante de mortalidad, hospitalización, enfermedad cardiovascular y diabetes en la vejez86. Igualmente, es un potente predictor de discapacidad y de fragilidad, de tal manera que algunos autores incluyen la obesidad dentro del espectro de la fragilidad y acuñan el término «obesidad sarcopénica»30,87. No obstante, la obesidad no es un fenómeno homogéneo en cuanto a su poder patógeno. Varios estudios indican que la obesidad central, y principalmente visceral, es un determinante más potente de enfermedad vascular que el morfotipo ginecoide de obesidad88,89, y esto parece que tiene que ver con la superior capacidad del tejido adiposo visceral de generar inflamación en comparación con el tejido adiposo subcutáneo90.
En los últimos años la obesidad se ha considerado dentro del espectro de las afecciones o condiciones que cursan con inflamación crónica91. Tal es así que hoy se considera al tejido adiposo un productor principal de citocinas inflamatorias en las personas obesas. Esto puede explicar en buena parte la asociación entre obesidad y enfermedad vascular, ya que el exceso de lípidos (principalmente triglicéridos y ácidos grasos) induce la activación de las más potentes cascadas inflamatorias, como son la vía de las serina cinasas y del factor nuclear kappa B, además de la liberación a la circulación general de las citocinas inflamatorias que inducen la aparición de disfunción endotelial, resistencia a la insulina y fenómenos procoagulantes, todos ellos promotores de arteriosclerosis91. En la actualidad hay evidencias de que la inflamación crónica (una de las bases biológicas de la fragilidad) es un factor promotor de numerosas enfermedades y condiciones. La inflamación se ha mostrado como un factor predictor de mortalidad92, enfermedad vascular93, sarcopenia26,94, fragilidad23,25,95 y resistencia a la insulina96,97. Hoy se sabe que los macrófagos que infiltran el tejido adiposo son, además de los adipocitos, un efector principal del factor de necrosis tumoral alfa (TNF-α)96, una citocina que es promotora principal de los siguientes cambios: es un potente estimulador de la lisis proteica muscular98, promueve la resistencia a la insulina en el adipocito mediante la alteración del receptor insulínico y del transportador de la glucosa GLUT4, y la resistencia a la insulina sistémica mediante el incremento de ácidos grasos libres y de la inhibición de la producción de adiponectina96, y favorece la aparición de arteriosclerosis por varias vías. Además de promover la resistencia a la insulina, el TNF-α induce la activación de las células endoteliales, la cual promueve el desarrollo de la cascada inflamatoria y se inicia la lesión endotelial. Asimismo, estimula el reclutamiento de los neutrófilos y aumenta el daño endotelial, a la vez que disminuye la biodisponibilidad de NO y favorece la disfunción endotelial99.
Rasgo de fragilidadComo ya hemos comentado, la condición de salud con que se llega a la vejez se construye a lo largo de la vida. Dependiendo de la herencia genética, los estilos de vida influirán en mayor o menor medida en la salud de un individuo y mermarán o mejorarán su condición física y cardiovascular. Fruto de ello, la reserva homeostática presentará grandes variaciones de un sujeto a otro. Así, cuando se hacen relevantes los cambios involutivos del envejecimiento o aparecen los trastornos en los distintos sistemas derivados de la presencia de enfermedades, cada sujeto estará en mayor o menor riesgo de eventos adversos de salud (mortalidad, hospitalización, deterioro funcional, etc.), dependiendo de su reserva biológica. Este rasgo biológico, que llamaremos «rasgo de fragilidad», es un fenómeno continuo: cuanta más disminución en la reserva biológica, más cerca se está del umbral de presentar efectos adversos derivados de ello. Este umbral no es un salto cualitativo (presencia/ausencia de riesgo de eventos adversos) sino un intensificado continuo en el riesgo.
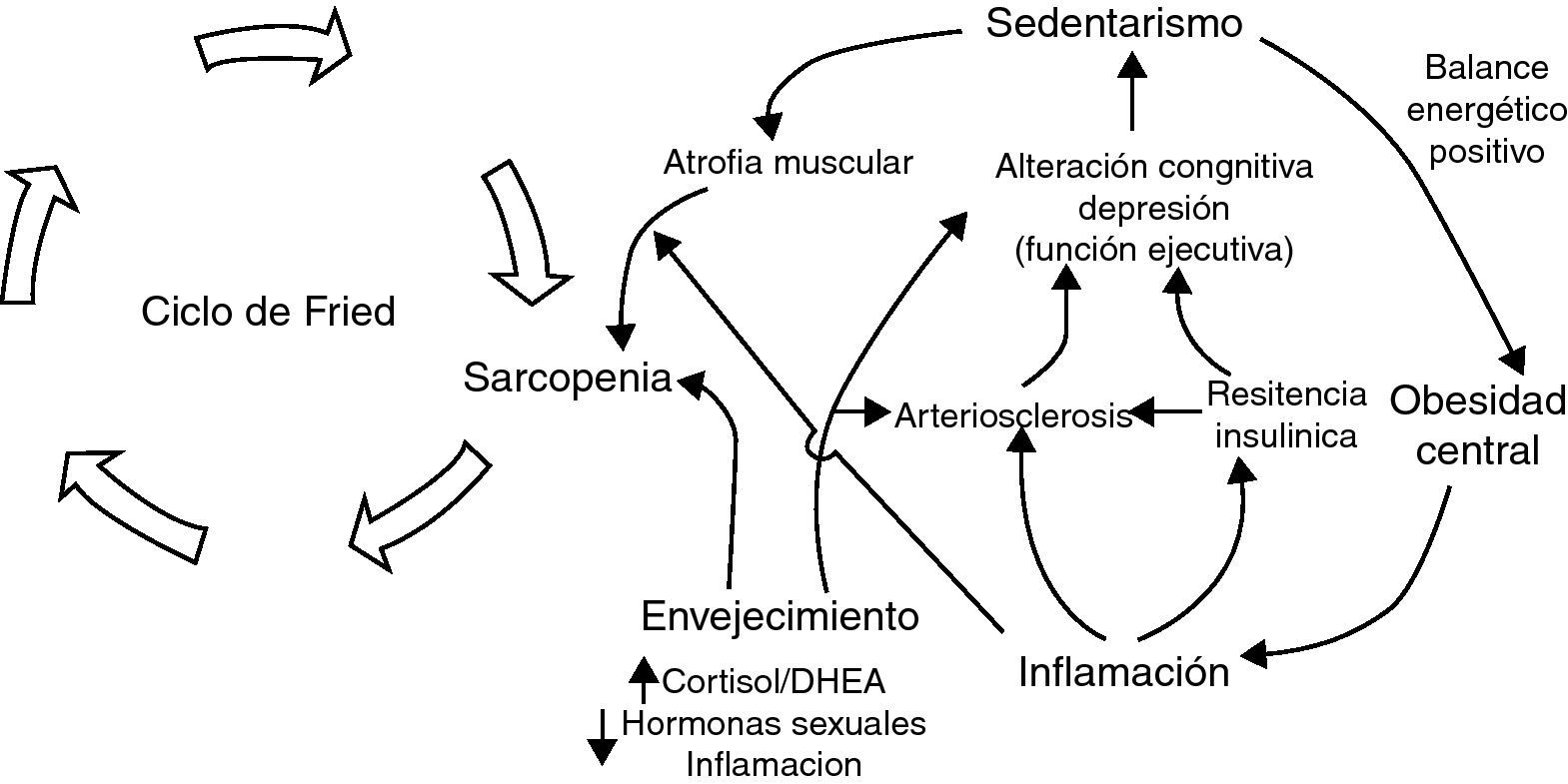
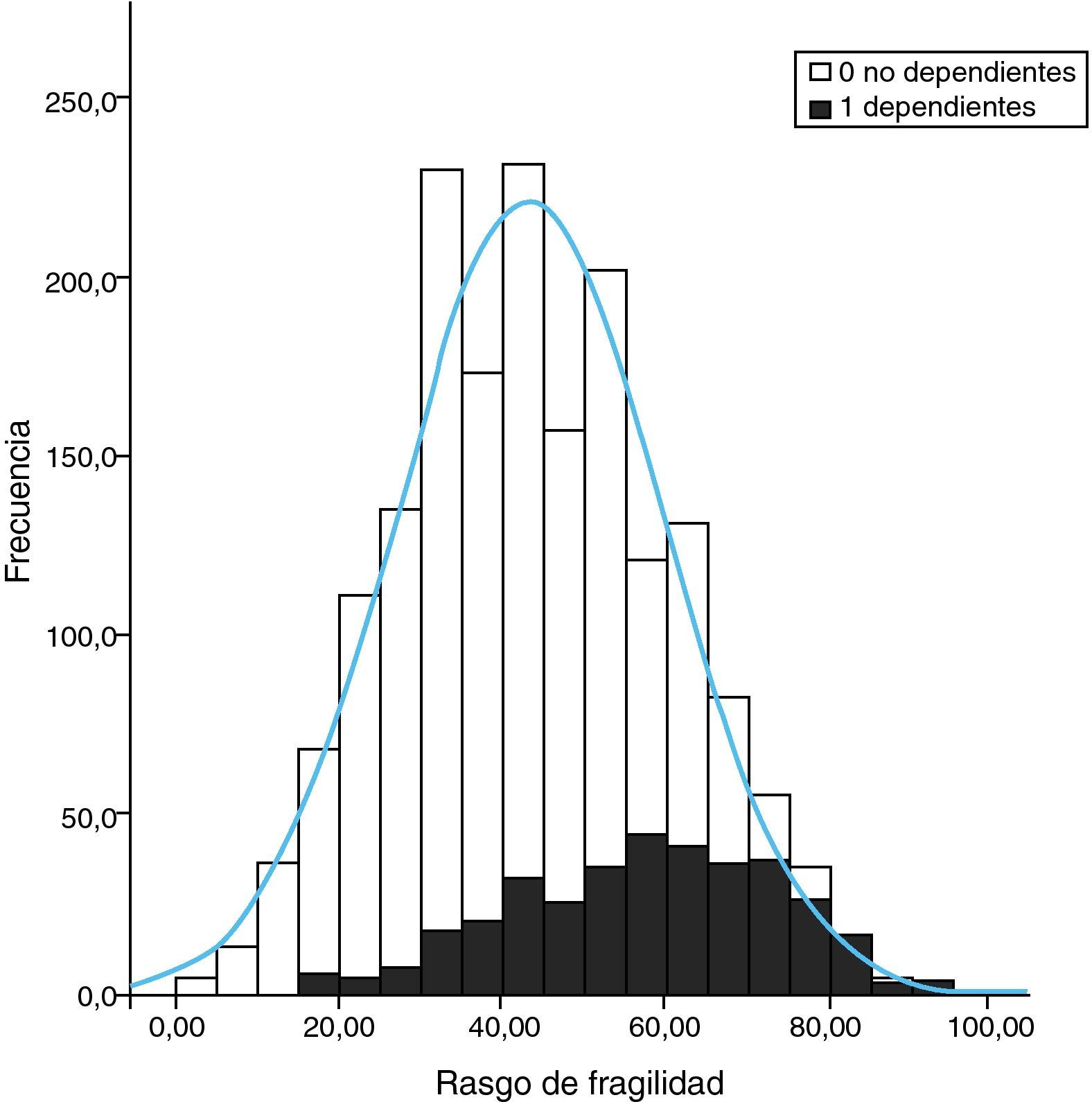
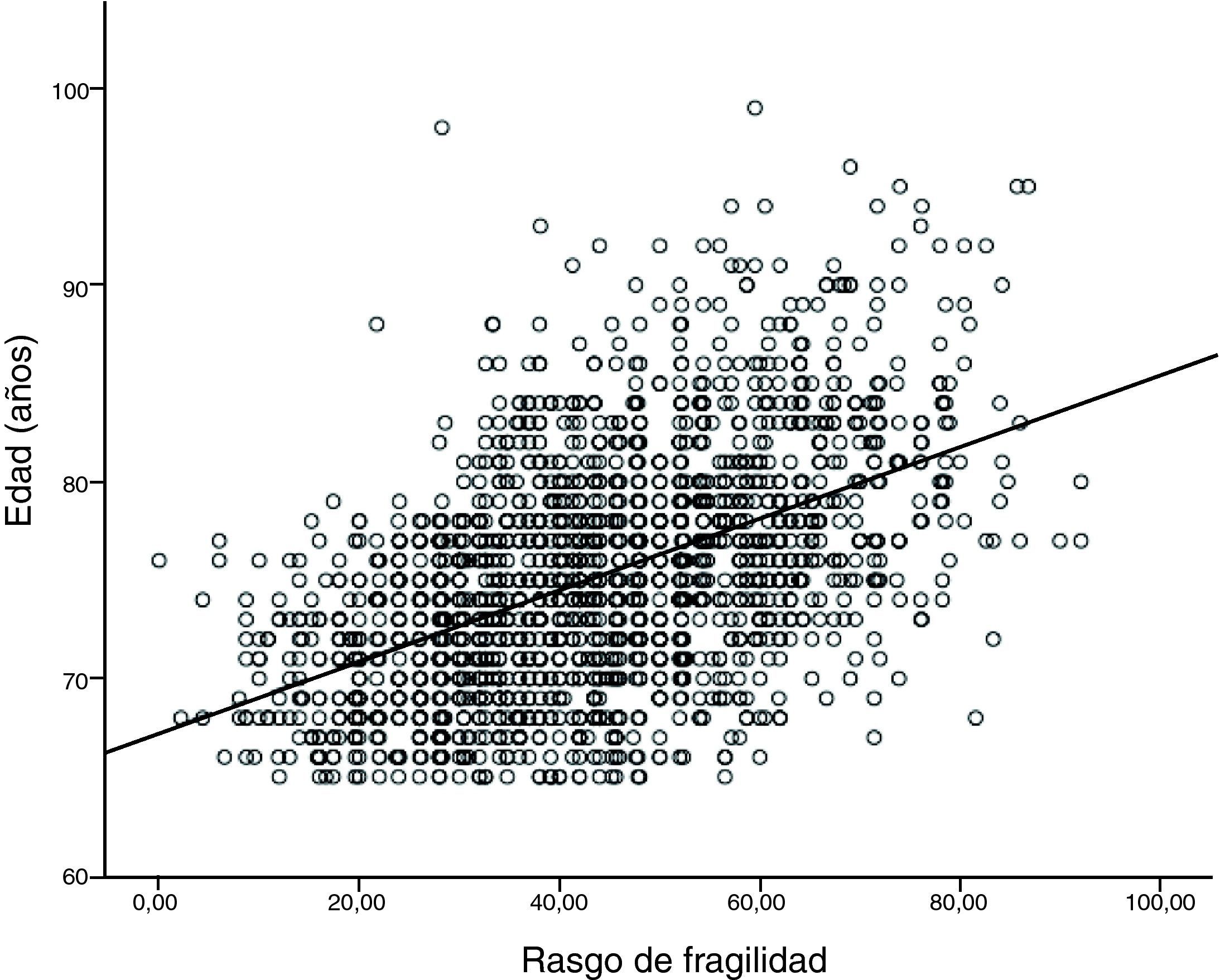
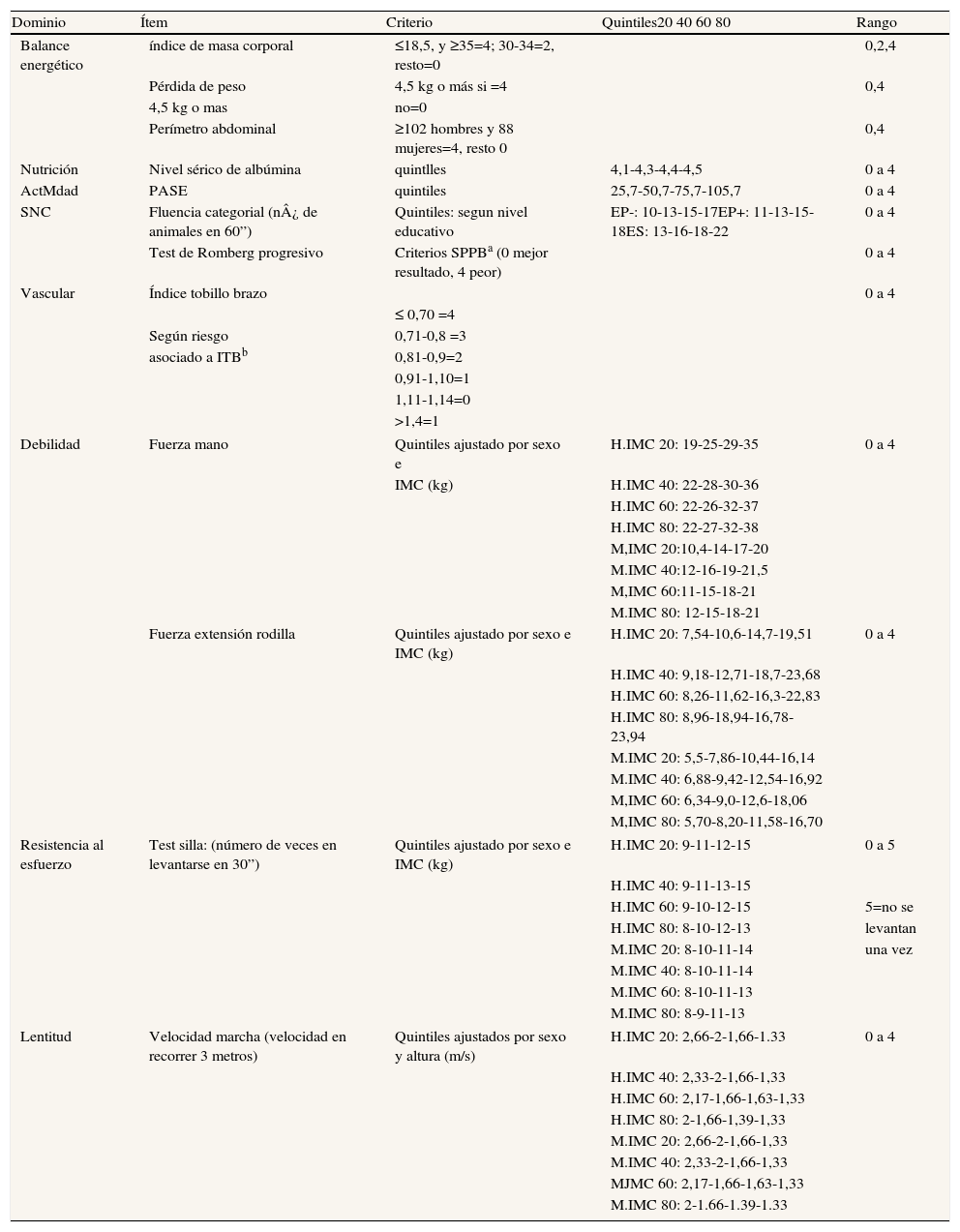
A nuestro juicio, y a la luz de los estudios que hemos comentado, consideramos que la inactividad es un factor primordial en la determinación de la condición física y cardiovascular. Asimismo, es un determinante de obesidad global y visceral. Ambos favorecen la aparición de un estado inflamatorio y de resistencia a la insulina, que son efectores de arteriosclerosis y sarcopenia. Además, estos factores son determinantes de disfunción ejecutiva y trastorno distímico, lo cual incrementa el riesgo de inactividad (fig. 2). Así, la sarcopenia, la arteriosclerosis y la disfunción ejecutiva comparten bases fisiopatológicas comunes, lo cual apoya la ampliación del espectro de la fragilidad a estas dos afecciones. Basándose en el constructo de Fried y ampliando su espectro a las situaciones que comparten «comunalidades» biológicas, se ha desarrollado una escala que hemos denominado «rasgo de fragilidad», con 12 ítems (tabla 1) que evalúan ocho dimensiones de la fragilidad: balance energético, estado nutritivo, pérdida de energía, actividad, fuerza, lentitud, sistema nervioso central y sistema vascular. Se utilizaron para ello los datos del primer corte transversal del ETES10. La puntuación global es la suma de los puntos de cada ítem, y se normaliza de 0 a 100 (puntuación=[sumatorio de puntos/puntos totales posibles] × 100), siendo 0 la mejor puntuación y 100 la peor. En los sujetos de quienes se desconocía algún ítem, la puntuación total se corrigió descontando en el denominador los puntos equivalentes a los ítems perdidos. Se permitió una pérdida de hasta un máximo de tres ítems (25%). Se incluyeron en el estudio 1.830 sujetos, el 43,9% de ellos hombres y con una edad media de 75,1 años (desviación estándar [DE]: 5,9). El rango de puntuación osciló entre 0 y 92. La puntuación se ajustó a una distribución normal (fig. 3). La puntuación media fue de 43,6 (DE: 16,3). Se observó una clara relación con la edad: 32,7, 38,8, 46,3, 53,9 y 59,9 para las edades de 65-69 años, 70-74 años, 75-79 años, 80-84 años, y 85 y más años, respectivamente (p<0,0001). Asimismo, se observó una relación con la carga de comorbilidad, evaluada mediante el índice de Charlson (rs=0,167; p<0,000, ajustado por edad), y con la discapacidad (fig. 3). Quizá el hallazgo más relevante es que la puntuación de la escala sirve para estimar cerca del 25% de la varianza de la edad biológica de las personas mayores (siendo la expresión de la edad biológica la siguiente: edad biológica=64,29+0,18 × rasgo de fragilidad; r2=0,247) (r2=0,243 ajustada por sexo, nivel educativo, comorbilidad y función) (fig. 4), lo que sugiere que puede ser un buen estimador de la edad biológica, hallazgo que habrá que evaluar en estudios de seguimiento.
Criterios operativos de la escala rasgo de fragilidad
| Dominio | Ítem | Criterio | Quintiles20 40 60 80 | Rango |
| Balance energético | índice de masa corporal | ≤18,5, y ≥35=4; 30-34=2, resto=0 | 0,2,4 | |
| Pérdida de peso | 4,5 kg o más si =4 | 0,4 | ||
| 4,5 kg o mas | no=0 | |||
| Perímetro abdominal | ≥102 hombres y 88 mujeres=4, resto 0 | 0,4 | ||
| Nutrición | Nivel sérico de albúmina | quintlles | 4,1-4,3-4,4-4,5 | 0 a 4 |
| ActMdad | PASE | quintiles | 25,7-50,7-75,7-105,7 | 0 a 4 |
| SNC | Fluencia categorial (n¿ de animales en 60”) | Quintiles: segun nivel educativo | EP-: 10-13-15-17EP+: 11-13-15-18ES: 13-16-18-22 | 0 a 4 |
| Test de Romberg progresivo | Criterios SPPBa (0 mejor resultado, 4 peor) | 0 a 4 | ||
| Vascular | Índice tobillo brazo | 0 a 4 | ||
| ≤ 0,70 =4 | ||||
| Según riesgo | 0,71-0,8 =3 | |||
| asociado a ITBb | 0,81-0,9=2 | |||
| 0,91-1,10=1 | ||||
| 1,11-1,14=0 | ||||
| >1,4=1 | ||||
| Debilidad | Fuerza mano | Quintiles ajustado por sexo e | H.IMC 20: 19-25-29-35 | 0 a 4 |
| IMC (kg) | H.IMC 40: 22-28-30-36 | |||
| H.IMC 60: 22-26-32-37 | ||||
| H.IMC 80: 22-27-32-38 | ||||
| M,IMC 20:10,4-14-17-20 | ||||
| M.IMC 40:12-16-19-21,5 | ||||
| M,IMC 60:11-15-18-21 | ||||
| M.IMC 80: 12-15-18-21 | ||||
| Fuerza extensión rodilla | Quintiles ajustado por sexo e IMC (kg) | H.IMC 20: 7,54-10,6-14,7-19,51 | 0 a 4 | |
| H.IMC 40: 9,18-12,71-18,7-23,68 | ||||
| H.IMC 60: 8,26-11,62-16,3-22,83 | ||||
| H.IMC 80: 8,96-18,94-16,78-23,94 | ||||
| M.IMC 20: 5,5-7,86-10,44-16,14 | ||||
| M.IMC 40: 6,88-9,42-12,54-16,92 | ||||
| M,IMC 60: 6,34-9,0-12,6-18,06 | ||||
| M,IMC 80: 5,70-8,20-11,58-16,70 | ||||
| Resistencia al esfuerzo | Test silla: (número de veces en levantarse en 30”) | Quintiles ajustado por sexo e IMC (kg) | H.IMC 20: 9-11-12-15 | 0 a 5 |
| H.IMC 40: 9-11-13-15 | ||||
| H.IMC 60: 9-10-12-15 | 5=no se | |||
| H.IMC 80: 8-10-12-13 | levantan | |||
| M.IMC 20: 8-10-11-14 | una vez | |||
| M.IMC 40: 8-10-11-14 | ||||
| M.IMC 60: 8-10-11-13 | ||||
| M.IMC 80: 8-9-11-13 | ||||
| Lentitud | Velocidad marcha (velocidad en recorrer 3 metros) | Quintiles ajustados por sexo y altura (m/s) | H.IMC 20: 2,66-2-1,66-1.33 | 0 a 4 |
| H.IMC 40: 2,33-2-1,66-1,33 | ||||
| H.IMC 60: 2,17-1,66-1,63-1,33 | ||||
| H.IMC 80: 2-1,66-1,39-1,33 | ||||
| M.IMC 20: 2,66-2-1,66-1,33 | ||||
| M.IMC 40: 2,33-2-1,66-1,33 | ||||
| MJMC 60: 2,17-1,66-1,63-1,33 | ||||
| M.IMC 80: 2-1.66-1.39-1.33 | ||||
H: hombres; M: mujeres; ITB: índice tobillo-brazo; IMC: índice de masa corporal; SNC: sistema nervioso central; PASE: Physical Activity Scale for the Elderly; SPPB: Short Physical Performance Battery; EP-: sin estudios primarios completos; EP+: con estudios primarios completos; EP: con estudios secundarios o más.
aJGerontol. 1994:49: M85-M94
bJAMA. 2008; 300: 197-208 Abreviaturas:
Histograma de distribución de la puntuación de la escala de rasgo de fragilidad en la muestra. La línea curva representa la distribución normal teórica de los datos. Las barras oscuras representan la frecuencia de sujetos dependientes en una o más actividades de la vida diaria básicas (índice de Katz) y las claras los no dependientes.
Es conocido que el origen de la discapacidad y la dependencia en el anciano se explica principalmente por alteraciones en los sistemas musculoesquelético, vascular y nervioso central. Como hemos visto, la evidencia científica apoya la hipótesis de que al menos parte de las alteraciones en estos tres sistemas comparten bases biológicas comunes. Los cambios biológicos subyacentes están íntimamente relacionados con los estilos de vida de la población, y entre ellos el sedentarismo es un actor principal. Por tanto, la lucha contra estos factores modificables ofrece una vía principal en la prevención gerontológica. En este campo, la fragilidad es un marco conceptual que proporciona un rasgo biológico continuo entre el envejecimiento saludable y la gran dependencia, y permite la clasificación y la monitorización del sujeto y de la población al dotar a los sistemas de salud de un soporte básico para la evaluación y la implementación de programas de salud en la población de edad avanzada.
Contribuciones de autoríaLos tres autores han contribuido en la misma proporción al diseño, la revisión bibliográfica y la escritura del artículo. F.J. García realizó el diseño y el constructo de la escala, y analizó sus datos.
DedicatoriaEl estudio Toledo de Envejecimiento Saludable está dedicado a la memoria de María Isabel Sánchez Ayala y Fernando Serrano Lira, investigadores del proyecto.
FinanciaciónEl proyecto está financiado por el Fondo de Investigaciones Sanitarias: PI031558, PI07/90637, PI0790306 y RD06/0013; y por el FISCAM: 03031-00. Asimismo, el Estudio Toledo de Envejecimiento Saludable está integrado en la Red Temática de Investigación en Envejecimiento y Fragilidad (RETICEF), de la cual recibe fondos.
Conflictos de interesesNinguno.
A la Dra. Carmen Castillo, por su ayuda en la elaboración del documento.