Aunque en España se han realizado estudios sobre concentraciones en medios biológicos humanos de compuestos tóxicos persistentes (CTP) desde hace varias décadas, no se ha llevado a cabo una revisión sistemática. Los objetivos fueron: a) identificar los estudios realizados en España en los últimos 30 años que hubiesen determinado concentraciones en humanos de diclorodifeniltricloroetano (DDT), diclorodifenildicloroeteno (DDE), hexaclorobenceno (HCB), hexaclorociclohexanos (HCH) y policlorobifenilos (PCB), y b) sintetizar las principales características y resultados de cada estudio. Los estudios son sumamente heterogéneos y la mayoría carece de representatividad poblacional. Las concentraciones de DDT y DDE parecen haber decrecido moderadamente en los últimos 20 años. Hay numerosas fluctuaciones en los valores de HCB, HCH y PCB, en algún caso compatibles con un estancamiento. Se observan grandes diferencias en los valores detectados en los distintos estudios y dentro de un mismo grupo: las concentraciones de CTP de algunos individuos pueden llegar a ser más de 200 veces superiores a los de otros. La magnitud real de la contaminación humana por CTP y sus tendencias a lo largo del territorio español, así como su diversidad geográfica y social, siguen siendo ampliamente desconocidas.
No systematic review is available on studies conducted in Spain on human concentrations of persistent toxic substances (PTS). The objectives were: to identify studies conducted in Spain in the past 30 years that determined concentrations in humans of dichlorodiphenyltrichloroethane (DDT), dichlorodiphenyldichloroethane (DDE), hexachlorobenzene (HCB), hexachlorocyclohexane (HCH) and polychlorinated bi-phenyls (PCBs); and to summarize the main characteristics and results of each study. Studies are highly heterogeneous and most lack population representativeness. Concentrations of DDT and DDE might have decreased moderately in the last 20 years. Numerous fluctuations are apparent in levels of HCB, HCHs and PCBs, in some instances compatible with some stagnation. There are enormous differences in levels detected across and within studies: PTS concentrations of some individuals may be over 200-fold higher than those of others. The actual magnitude of human contamination by PTS and their trends across Spain –as well as the geographic and social heterogeneity– remain largely unknown.
Actualmente, una amplia mayoría de las poblaciones humanas presentan concentraciones detectables de algunos compuestos tóxicos persistentes (CTP), también denominados contaminantes orgánicos persistentes (COP)1. La contaminación humana por CTP es relativamente reciente y muy variable en su magnitud; sus implicaciones clínicas, sanitarias, ambientales y sociales sólo son conocidas en parte1-5. Todas ellas serían razones importantes para que los profesionales de la salud pública participasen activamente en los análisis sobre los CTP, pero hay más, como veremos inmediatamente.
La contaminación por CTP de las personas, los demás organismos vivos y el medio ambiente se viene produciendo de un modo especialmente claro desde hace unos 50 años, con oscilaciones: tras los aumentos en las concentraciones observados en muchas poblaciones entre las décadas de los cincuenta y los setenta, algunos compuestos han tenido descensos importantes en las últimas 2 o 3 décadas; es a menudo el caso del plaguicida diclorodifeniltricloroetileno (DDT). No obstante, los niveles humanos de otros CTP parecen haberse estabilizado; un ejemplo serían los bifenilos policlorados o policlorobifenilos (PCB). Existen asimismo compuestos de aparición más reciente, como los polibromodifenil éteres (PBDE) y los polibromobifenilos (PBB), utilizados como pirorretardantes en múltiples bienes de consumo, cuyas concentraciones están aumentando a juzgar por algunos programas realizados en muestras de sangre y leche materna6-11.
El elevado número de compuestos químicos, la variedad de sus posibles efectos adversos y diversas incertidumbres sobre su magnitud clínica y poblacional han generado una preocupación razonable en científicos, médicos y ambientalistas, entre otros profesionales, así como en una parte no desdeñable del resto de la sociedad5-8,12,13. Hay conocimientos científicos sólidos acerca de la naturaleza lipofílica de muchos CTP, su resistencia a la degradación, sus prolongados tiempos de vida media y su persistencia en los seres vivos1-4. También se conoce bien su alta capacidad de bioacumulación y biomagnificación; ambos procesos provocan concentraciones corporales progresivamente elevadas. La «bioacumulación» ocurre dentro de un mismo nivel de la cadena trófica: es el aumento a lo largo de la vida en la concentración de una sustancia en los tejidos de un individuo debido a la ingesta de la sustancia, fundamentalmente a partir de las grasas alimentarias14-19. La «biomagnificación», en cambio, ocurre a medida que se asciende en la cadena trófica, en el nivel más alto de la cual, recordemos, se encuentran los seres humanos3.
La presente revisión se centra fundamentalmente en algunos CTP que en la actualidad están incluidos en el llamado Convenio de Estocolmo20,21, ya en vigor; entre ellos, el diclorodifenildicloroetileno (DDE), principal derivado del DDT, así como el hexaclorobenceno (HCB) y los hexaclorociclohexanos (HCH; entre ellos, el γ-HCH o lindano). El mencionado tratado también se aplica a productos industriales y de consumo ampliamente utilizados en nuestras sociedades, como los PCB (presentes en transformadores eléctricos, aceites industriales, tintas, plásticos, lámparas), y a residuos producidos de forma no intencionada por las incineradoras y otras industrias, como las dioxinas y los furanos4,13,20,22-27.
Para valorar los datos que más adelante se presentan en este artículo es conveniente recordar que, habitualmente, los ecosistemas –y dentro de ellos las personas– se ven expuestos a los CTP a concentraciones relativamente bajas, durante largos periodos de tiempo (hoy en día, para la mayoría de CTP, a lo largo de toda la vida)1-5. Las concentraciones no son «bajas» en el sentido literal, pues se encuentran en el mismo rango de valores que otras muchas hormonas y sustancias endógenas imprescindibles para un funcionamiento normal del organismo; por ejemplo, entre las personas es habitual hallar concentraciones de CTP entre 1 y 30 ng/ml, y superiores. Las concentraciones pueden considerarse bajas en el sentido de que en los sistemas experimentales tradicionales, la potencia fisiológica (p. ej., hormonal) de estos compuestos ambientales es a menudo muy inferior a la de las sustancias normales o endógenas del organismo vivo. No obstante, actualmente, tanto los sistemas clásicos de evaluación toxicológica y ambiental como los nuevos sistemas (p. ej., los de la toxicología genética) están experimentando cambios considerables; en particular, se produce una eclosión de conocimientos sobre los mecanismos (p. ej., epigenéticos y toxicogenéticos indirectos) de actuación de los CTP en sus dosis habituales28-34. A menudo estos conocimientos mecanísticos son coherentes con observaciones clínicas y epidemiológicas acerca de los efectos de los CTP en personas que viven en condiciones normales en nuestras sociedades. Tales observaciones indican que los CTP pueden contribuir a aumentar el riesgo de alteraciones neurológicas, inmunológicas y neoplásicas, infertilidad, malformaciones congénitas, problemas de desarrollo neuroconductual, diabetes mellitus tipo 2, enfermedad de Alzheimer o enfermedad de Parkinson, síndromes de fatiga crónica y de hipersensibilidad química, entre otros1-3,35-45. Es biológicamente plausible que tales efectos ocurran, sobre todo, en interacción con otras exposiciones ambientales y como parte de procesos epigenéticos, transgeneracionales o no28-34.
Por las razones hasta aquí apuntadas y por las desarrolladas en la bibliografía citada, para los profesionales de la salud es relevante conocer cuál ha sido la evolución que durante las últimas décadas han tenido las concentraciones de CTP en la población general española. En este sentido, cabe destacar que en la literatura académica no haya una revisión al respecto; lógicamente, los estudios empíricos suelen hacer referencia a trabajos precedentes.
Los objetivos del presente trabajo fueron: a)identificar los estudios realizados en España en los últimos 30 años en los que se hubiesen determinado las concentraciones en humanos de los CTP que se detallan en el apartado siguiente; b) resumir las principales características de cada estudio, y c) sintetizar sus principales resultados.
Material y métodosSe revisaron los estudios que analizaron las concentraciones de los siguientes CTP y sus análogos en alguna población española: DDT, DDE, HCB, HCH y PCB. Por tanto, se excluyen otros compuestos, como endosulfan, oxiclordano, toxafeno, hidrocarburos aromáticos policíclicos, dioxinas y furanos, algunos de los cuales han tenido estudios específicos13,22-25,46,47. Los estudios e informes se identificaron en búsquedas sistemáticas en MEDLINE/PubMed, mediante términos como los siguientes: compuestos tóxicos persistentes, compuestos orgánicos persistentes, población general, plaguicidas, biomonitorización, Convenio de Estocolmo, muestras biológicas, «Spain», «Spanish», «organochlorine», DDT, DDE, HCB, HCH, PCB y «humans». Los estudios se identificaron también en las bibliografías de las propias publicaciones científicas, en las bibliotecas de distintas organizaciones y en páginas web de organismos oficiales, como el Ministerio de Sanidad y el Ministerio de Medio Ambiente. Se revisaron, asimismo, tesis doctorales y presentaciones a congresos. La búsqueda se extendió hasta febrero de 2007.
Los resultados de la revisión se resumen en 2 tablas para cada compuesto (a y b). La primera muestra las características principales de cada estudio, como el año de recogida de las muestras (si no se especificaba con claridad, estimado por nosotros), el lugar donde se realizó el estudio, la población y la muestra utilizada para hacer la determinación de los niveles de CTP En algunas ocasiones, hay diversas publicaciones de un mismo estudio realizado en una misma población y con las mismas muestras. Las distintas poblaciones estudiadas casi siempre pueden deducirse –si las publicaciones lo permiten– de la parte «1a» de las tablas. En la parte «b» de la tabla se muestra el método analítico utilizado para determinar las concentraciones, el número de hombres y mujeres incluidos en cada estudio, su edad y las concentraciones halladas del compuesto. Siempre que ha sido posible, en esta segunda tabla se especifica la media y/o la mediana, ya que son los dos parámetros más utilizados en la bibliografía; en las tablas no se incluyen los valores máximo y mínimo de las concentraciones, pues son excepcionales los estudios que los mencionan. Para algunos trabajos se ofrece más de un resultado, en el caso de que se estudiasen los niveles en distintas poblaciones, muestras biológicas o períodos.
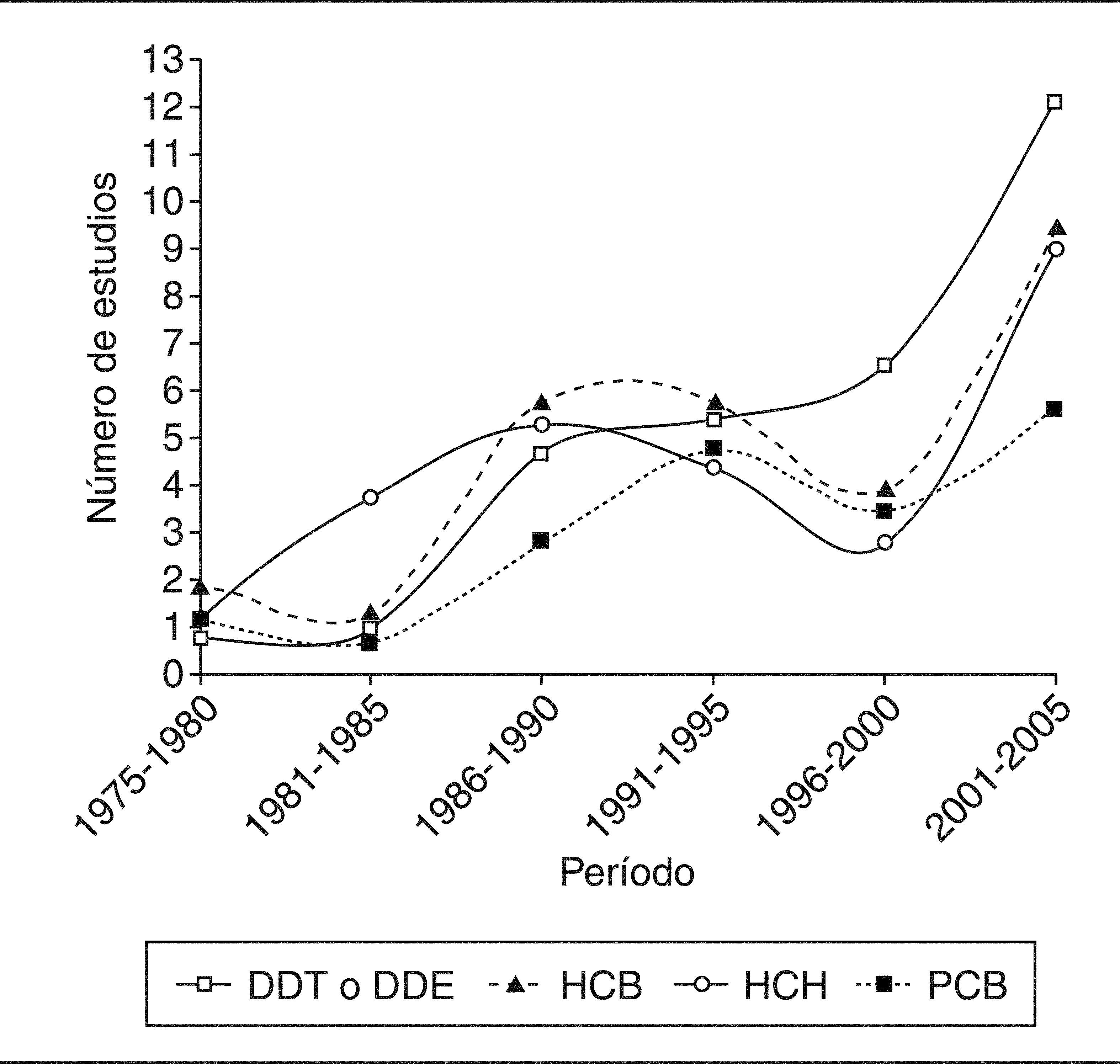
ResultadosSe hallaron unos 40 estudios que determinaban las concentraciones de CTP en poblaciones españolas. La mayoría de ellos estaban promovidos por grupos de investigación, y sólo una minoría por administraciones públicas. Desde mediados los años setenta hasta la actualidad, el número de estudios publicados cada año ha ido oscilando y, en general, ha sido escaso, aunque la tendencia podría ser ascendente (fig. 1).
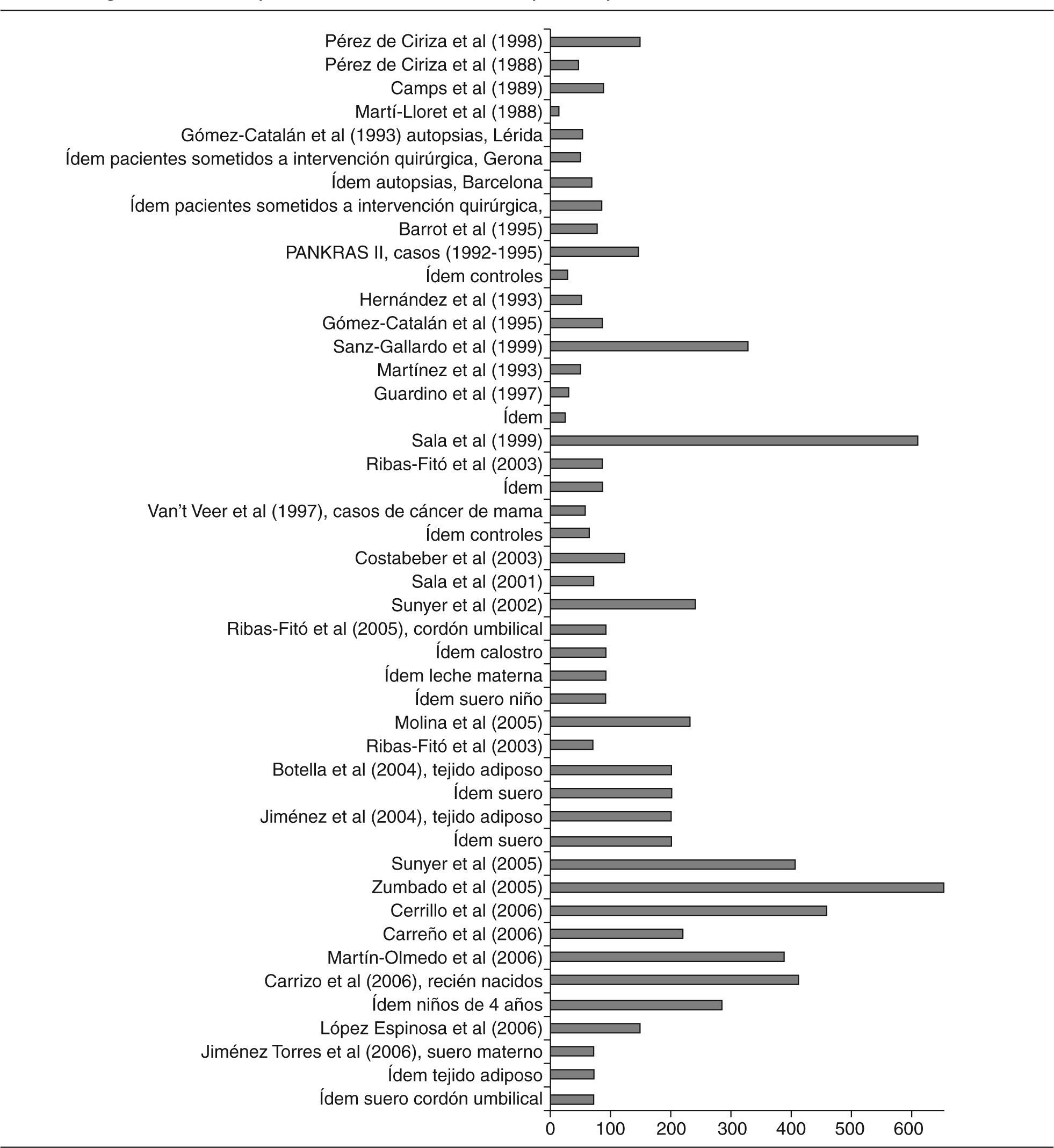
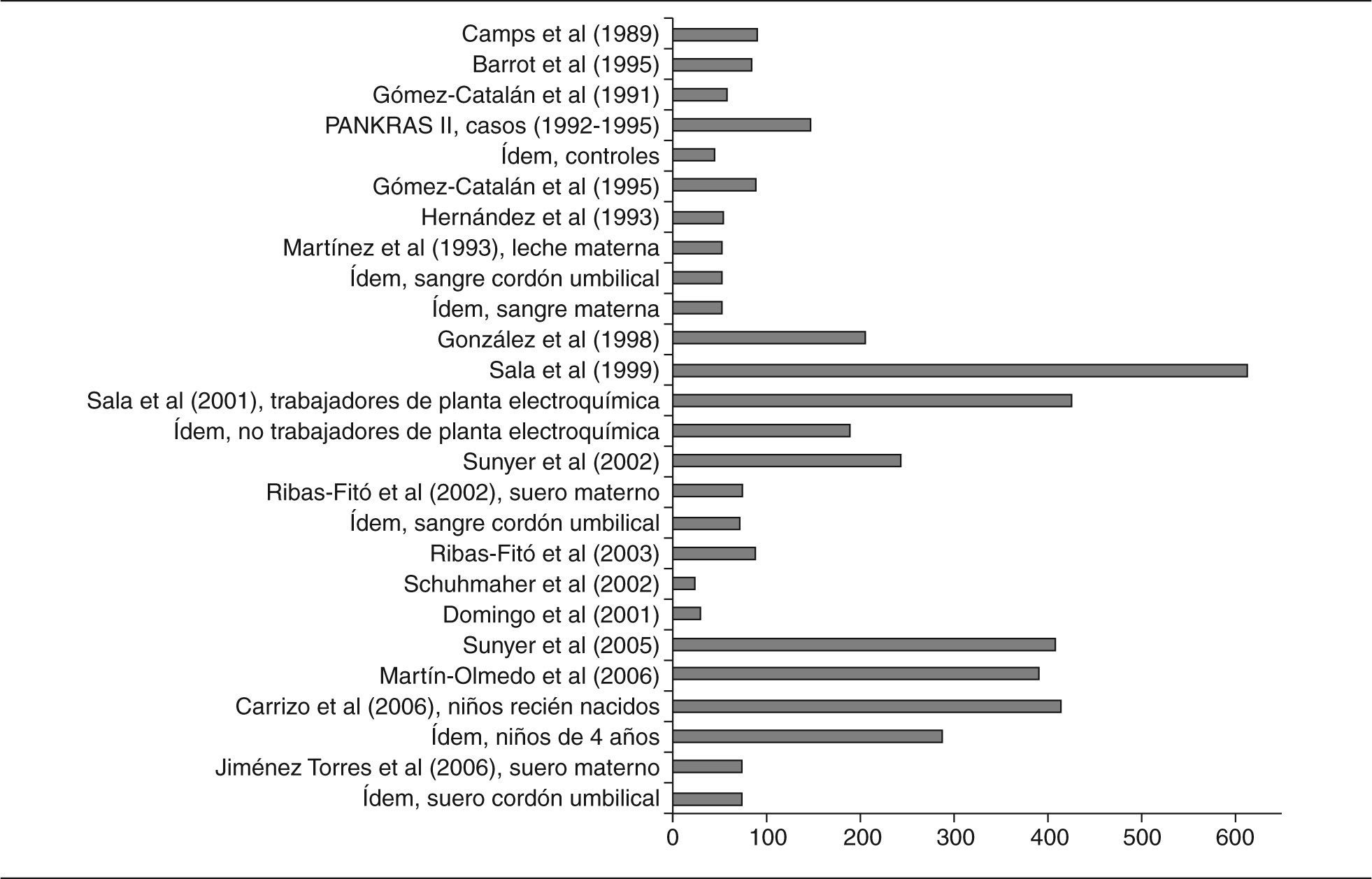
No todos los trabajos revisados especifican con suficiente detalle sus propias características metodológicas. Además, cuando se mencionan, tales características pueden llegar a ser bastante heterogéneas, lo que dificulta las comparaciones entre los estudios y las valoraciones de los resultados. La cautela es, pues, especialmente necesaria al comparar resultados de muestras obtenidas en distintos momentos y poblaciones, en especial dada la gran variedad de los métodos utilizados para seleccionar a los individuos, como es evidente en la parte «a» de las 4 tablas (ver en particular la columna sobre la población en estudio). Además, hay otras divergencias en los procedimientos utilizados en los distintos estudios, sobre todo en las complejas técnicas de análisis de los niveles de CTP, que no sólo difieren entre los estudios si no que, por añadidura, han experimentado cambios profundos en las últimas décadas (ver columna sobre métodos analíticos). La visión general de la tablas pone de manifiesto otros cuatro factores que limitan las valoraciones de los resultados de los estudios: a) los distintos parámetros estadísticos que se utilizan para presentar las concentraciones (medias, medianas); b) las diferentes unidades en que se calculan las concentraciones y la presentación de los resultados crudos o ajustados por lípidos (ng/ml, ng/g, μg/g, mg/l); c) las diferentes muestras biológicas en las que se analizan los compuestos (sangre, leche materna, tejido adiposo), y d) la común inclusión por mecanismos «de conveniencia», sin selección aleatoria, así como los heterogéneos grupos de personas (voluntarios, autopsias, población institucionalizada, agricultores), carentes de representatividad poblacional. También es relevante el número de sujetos participantes en los estudios, sumamente bajo en algunos de ellos (figs. 2 y 3). A continuación se comentan sucintamente los principales resultados para cada grupo de compuestos.
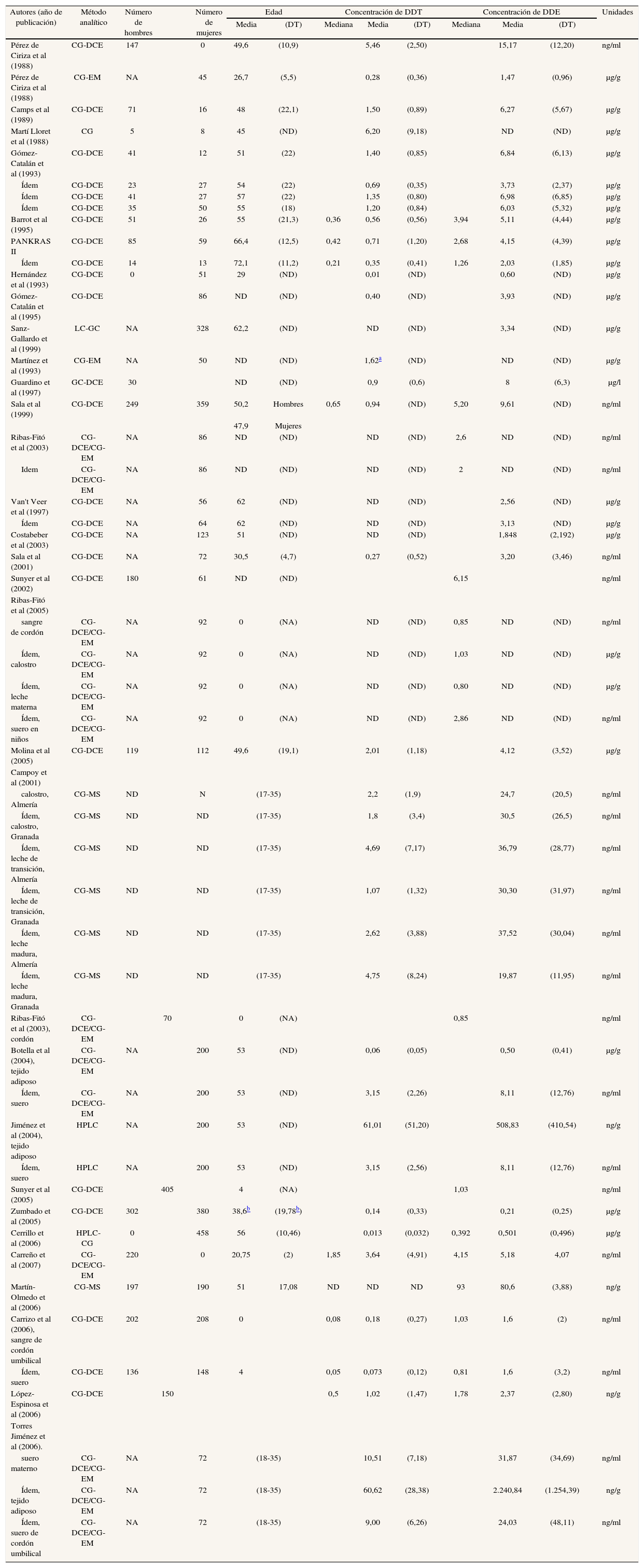
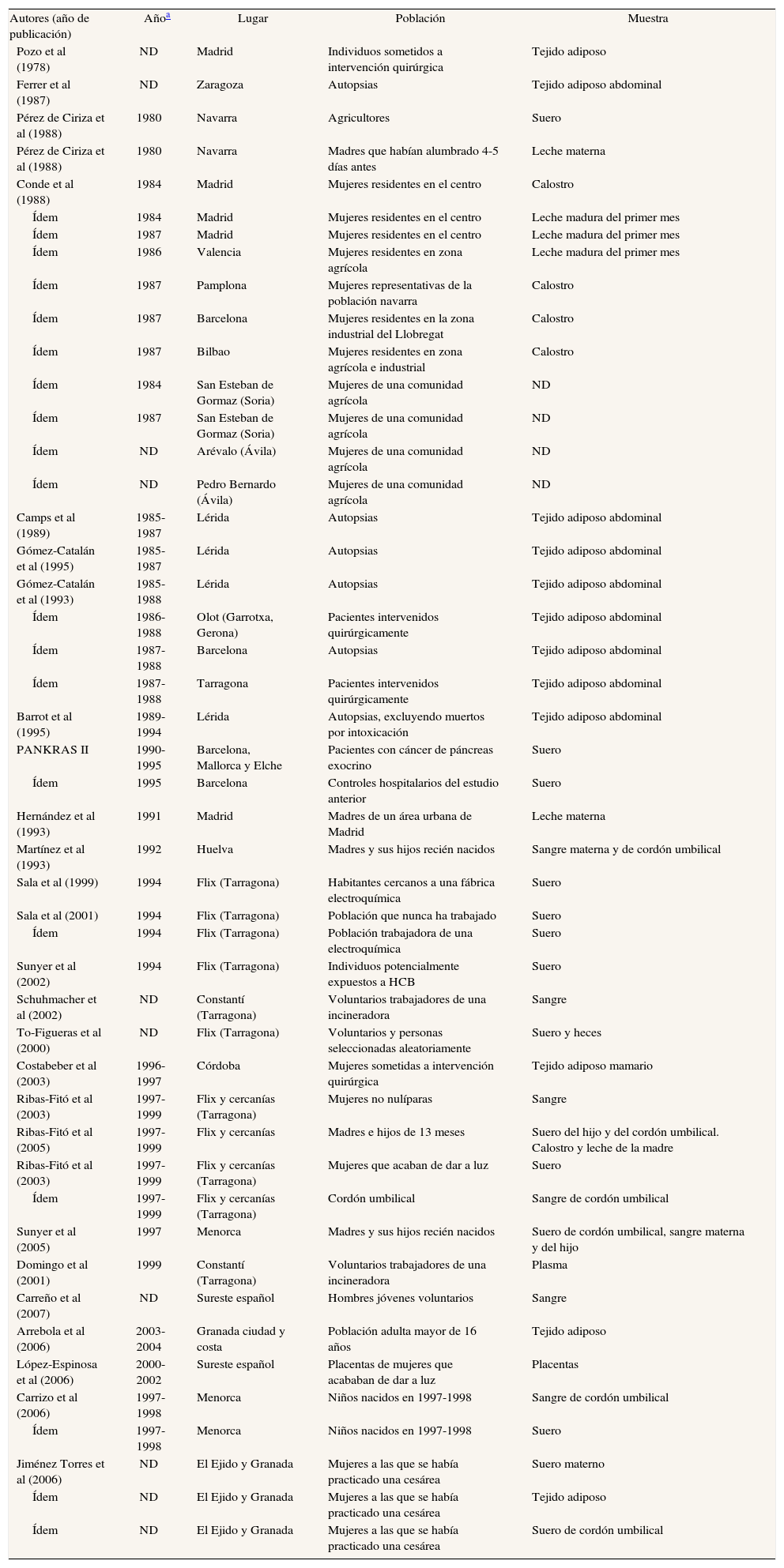
Los estudios que determinan el diclorodifeniltricloroetano (p,p'-DDT) y el diclorodifenildicloroetileno (p,p'-DDE) se detallan en las tablas 1a y 1b48-81. Las muestras biológicas en que se determinan estas concentraciones son, principalmente, sangre y tejido adiposo. Algunos estudios las han determinado en leche materna o similar (calostro o leche de transición). El número de participantes muestra una cierta tendencia a aumentar desde finales de la década de los ochenta (fig. 2). La mayoría de estudios incluye menos de 100 individuos.
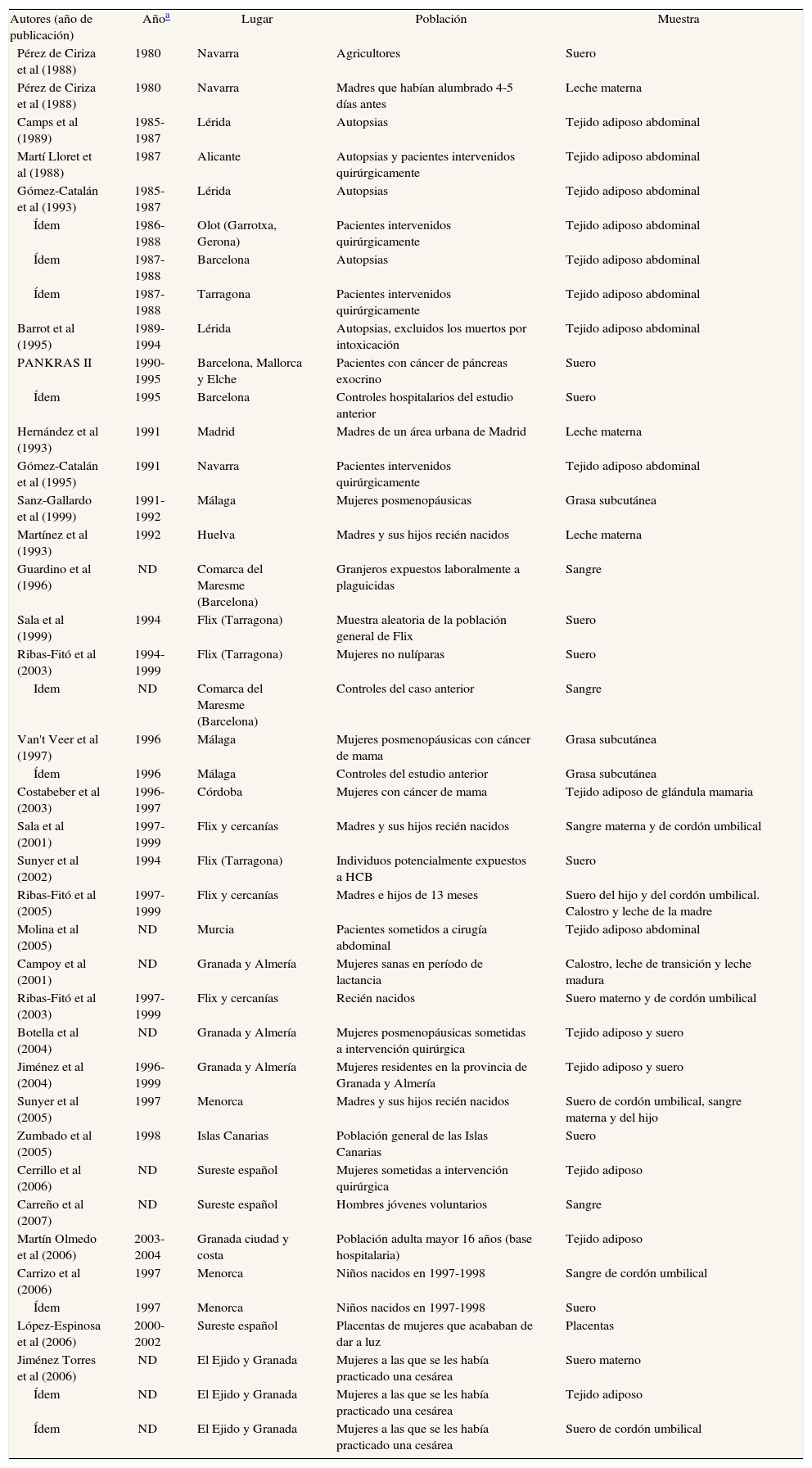
Principales características de los estudios españoles que analizan concentraciones de DDT y DDE en humanos
| Autores (año de publicación) | Añoa | Lugar | Población | Muestra |
| Pérez de Ciriza et al (1988) | 1980 | Navarra | Agricultores | Suero |
| Pérez de Ciriza et al (1988) | 1980 | Navarra | Madres que habían alumbrado 4-5 días antes | Leche materna |
| Camps et al (1989) | 1985-1987 | Lérida | Autopsias | Tejido adiposo abdominal |
| Martí Lloret et al (1988) | 1987 | Alicante | Autopsias y pacientes intervenidos quirúrgicamente | Tejido adiposo abdominal |
| Gómez-Catalán et al (1993) | 1985-1987 | Lérida | Autopsias | Tejido adiposo abdominal |
| Ídem | 1986-1988 | Olot (Garrotxa, Gerona) | Pacientes intervenidos quirúrgicamente | Tejido adiposo abdominal |
| Ídem | 1987-1988 | Barcelona | Autopsias | Tejido adiposo abdominal |
| Ídem | 1987-1988 | Tarragona | Pacientes intervenidos quirúrgicamente | Tejido adiposo abdominal |
| Barrot et al (1995) | 1989-1994 | Lérida | Autopsias, excluidos los muertos por intoxicación | Tejido adiposo abdominal |
| PANKRAS II | 1990-1995 | Barcelona, Mallorca y Elche | Pacientes con cáncer de páncreas exocrino | Suero |
| Ídem | 1995 | Barcelona | Controles hospitalarios del estudio anterior | Suero |
| Hernández et al (1993) | 1991 | Madrid | Madres de un área urbana de Madrid | Leche materna |
| Gómez-Catalán et al (1995) | 1991 | Navarra | Pacientes intervenidos quirúrgicamente | Tejido adiposo abdominal |
| Sanz-Gallardo et al (1999) | 1991-1992 | Málaga | Mujeres posmenopáusicas | Grasa subcutánea |
| Martínez et al (1993) | 1992 | Huelva | Madres y sus hijos recién nacidos | Leche materna |
| Guardino et al (1996) | ND | Comarca del Maresme (Barcelona) | Granjeros expuestos laboralmente a plaguicidas | Sangre |
| Sala et al (1999) | 1994 | Flix (Tarragona) | Muestra aleatoria de la población general de Flix | Suero |
| Ribas-Fitó et al (2003) | 1994-1999 | Flix (Tarragona) | Mujeres no nulíparas | Suero |
| Idem | ND | Comarca del Maresme (Barcelona) | Controles del caso anterior | Sangre |
| Van't Veer et al (1997) | 1996 | Málaga | Mujeres posmenopáusicas con cáncer de mama | Grasa subcutánea |
| Ídem | 1996 | Málaga | Controles del estudio anterior | Grasa subcutánea |
| Costabeber et al (2003) | 1996-1997 | Córdoba | Mujeres con cáncer de mama | Tejido adiposo de glándula mamaria |
| Sala et al (2001) | 1997-1999 | Flix y cercanías | Madres y sus hijos recién nacidos | Sangre materna y de cordón umbilical |
| Sunyer et al (2002) | 1994 | Flix (Tarragona) | Individuos potencialmente expuestos a HCB | Suero |
| Ribas-Fitó et al (2005) | 1997-1999 | Flix y cercanías | Madres e hijos de 13 meses | Suero del hijo y del cordón umbilical. Calostro y leche de la madre |
| Molina et al (2005) | ND | Murcia | Pacientes sometidos a cirugía abdominal | Tejido adiposo abdominal |
| Campoy et al (2001) | ND | Granada y Almería | Mujeres sanas en período de lactancia | Calostro, leche de transición y leche madura |
| Ribas-Fitó et al (2003) | 1997-1999 | Flix y cercanías | Recién nacidos | Suero materno y de cordón umbilical |
| Botella et al (2004) | ND | Granada y Almería | Mujeres posmenopáusicas sometidas a intervención quirúrgica | Tejido adiposo y suero |
| Jiménez et al (2004) | 1996-1999 | Granada y Almería | Mujeres residentes en la provincia de Granada y Almería | Tejido adiposo y suero |
| Sunyer et al (2005) | 1997 | Menorca | Madres y sus hijos recién nacidos | Suero de cordón umbilical, sangre materna y del hijo |
| Zumbado et al (2005) | 1998 | Islas Canarias | Población general de las Islas Canarias | Suero |
| Cerrillo et al (2006) | ND | Sureste español | Mujeres sometidas a intervención quirúrgica | Tejido adiposo |
| Carreño et al (2007) | ND | Sureste español | Hombres jóvenes voluntarios | Sangre |
| Martín Olmedo et al (2006) | 2003-2004 | Granada ciudad y costa | Población adulta mayor 16 años (base hospitalaria) | Tejido adiposo |
| Carrizo et al (2006) | 1997 | Menorca | Niños nacidos en 1997-1998 | Sangre de cordón umbilical |
| Ídem | 1997 | Menorca | Niños nacidos en 1997-1998 | Suero |
| López-Espinosa et al (2006) | 2000-2002 | Sureste español | Placentas de mujeres que acababan de dar a luz | Placentas |
| Jiménez Torres et al (2006) | ND | El Ejido y Granada | Mujeres a las que se les había practicado una cesárea | Suero materno |
| Ídem | ND | El Ejido y Granada | Mujeres a las que se les había practicado una cesárea | Tejido adiposo |
| Ídem | ND | El Ejido y Granada | Mujeres a las que se les había practicado una cesárea | Suero de cordón umbilical |
HCB: hexaclorobenceno; ND: no disponible.
Principales resultados de los estudios españoles que analizan concentraciones de DDT y DDE en humanos
| Autores (año de publicación) | Método analítico | Número de hombres | Número de mujeres | Edad | Concentración de DDT | Concentración de DDE | Unidades | ||||||
| Media | (DT) | Mediana | Media | (DT) | Mediana | Media | (DT) | ||||||
| Pérez de Ciriza et al (1988) | CG-DCE | 147 | 0 | 49,6 | (10,9) | 5,46 | (2,50) | 15,17 | (12,20) | ng/ml | |||
| Pérez de Ciriza et al (1988) | CG-EM | NA | 45 | 26,7 | (5,5) | 0,28 | (0,36) | 1,47 | (0,96) | μg/g | |||
| Camps et al (1989) | CG-DCE | 71 | 16 | 48 | (22,1) | 1,50 | (0,89) | 6,27 | (5,67) | μg/g | |||
| Martí Lloret et al (1988) | CG | 5 | 8 | 45 | (ND) | 6,20 | (9,18) | ND | (ND) | μg/g | |||
| Gómez-Catalán et al (1993) | CG-DCE | 41 | 12 | 51 | (22) | 1,40 | (0,85) | 6,84 | (6,13) | μg/g | |||
| Ídem | CG-DCE | 23 | 27 | 54 | (22) | 0,69 | (0,35) | 3,73 | (2,37) | μg/g | |||
| Ídem | CG-DCE | 41 | 27 | 57 | (22) | 1,35 | (0,80) | 6,98 | (6,85) | μg/g | |||
| Ídem | CG-DCE | 35 | 50 | 55 | (18) | 1,20 | (0,84) | 6,03 | (5,32) | μg/g | |||
| Barrot et al (1995) | CG-DCE | 51 | 26 | 55 | (21,3) | 0,36 | 0,56 | (0,56) | 3,94 | 5,11 | (4,44) | μg/g | |
| PANKRAS II | CG-DCE | 85 | 59 | 66,4 | (12,5) | 0,42 | 0,71 | (1,20) | 2,68 | 4,15 | (4,39) | μg/g | |
| Ídem | CG-DCE | 14 | 13 | 72,1 | (11,2) | 0,21 | 0,35 | (0,41) | 1,26 | 2,03 | (1,85) | μg/g | |
| Hernández et al (1993) | CG-DCE | 0 | 51 | 29 | (ND) | 0,01 | (ND) | 0,60 | (ND) | μg/g | |||
| Gómez-Catalán et al (1995) | CG-DCE | 86 | ND | (ND) | 0,40 | (ND) | 3,93 | (ND) | μg/g | ||||
| Sanz-Gallardo et al (1999) | LC-GC | NA | 328 | 62,2 | (ND) | ND | (ND) | 3,34 | (ND) | μg/g | |||
| Martínez et al (1993) | CG-EM | NA | 50 | ND | (ND) | 1,62a | (ND) | ND | (ND) | μg/g | |||
| Guardino et al (1997) | GC-DCE | 30 | ND | (ND) | 0,9 | (0,6) | 8 | (6,3) | μg/l | ||||
| Sala et al (1999) | CG-DCE | 249 | 359 | 50,2 | Hombres | 0,65 | 0,94 | (ND) | 5,20 | 9,61 | (ND) | ng/ml | |
| 47,9 | Mujeres | ||||||||||||
| Ribas-Fitó et al (2003) | CG-DCE/CG-EM | NA | 86 | ND | (ND) | ND | (ND) | 2,6 | ND | (ND) | ng/ml | ||
| Idem | CG-DCE/CG-EM | NA | 86 | ND | (ND) | ND | (ND) | 2 | ND | (ND) | ng/ml | ||
| Van't Veer et al (1997) | CG-DCE | NA | 56 | 62 | (ND) | ND | (ND) | 2,56 | (ND) | μg/g | |||
| Ídem | CG-DCE | NA | 64 | 62 | (ND) | ND | (ND) | 3,13 | (ND) | μg/g | |||
| Costabeber et al (2003) | CG-DCE | NA | 123 | 51 | (ND) | ND | (ND) | 1,848 | (2,192) | μg/g | |||
| Sala et al (2001) | CG-DCE | NA | 72 | 30,5 | (4,7) | 0,27 | (0,52) | 3,20 | (3,46) | ng/ml | |||
| Sunyer et al (2002) | CG-DCE | 180 | 61 | ND | (ND) | 6,15 | ng/ml | ||||||
| Ribas-Fitó et al (2005) | |||||||||||||
| sangre de cordón | CG-DCE/CG-EM | NA | 92 | 0 | (NA) | ND | (ND) | 0,85 | ND | (ND) | ng/ml | ||
| Ídem, calostro | CG-DCE/CG-EM | NA | 92 | 0 | (NA) | ND | (ND) | 1,03 | ND | (ND) | μg/g | ||
| Ídem, leche materna | CG-DCE/CG-EM | NA | 92 | 0 | (NA) | ND | (ND) | 0,80 | ND | (ND) | μg/g | ||
| Ídem, suero en niños | CG-DCE/CG-EM | NA | 92 | 0 | (NA) | ND | (ND) | 2,86 | ND | (ND) | ng/ml | ||
| Molina et al (2005) | CG-DCE | 119 | 112 | 49,6 | (19,1) | 2,01 | (1,18) | 4,12 | (3,52) | μg/g | |||
| Campoy et al (2001) | |||||||||||||
| calostro, Almería | CG-MS | ND | N | (17-35) | 2,2 | (1,9) | 24,7 | (20,5) | ng/ml | ||||
| Ídem, calostro, Granada | CG-MS | ND | ND | (17-35) | 1,8 | (3,4) | 30,5 | (26,5) | ng/ml | ||||
| Ídem, leche de transición, Almería | CG-MS | ND | ND | (17-35) | 4,69 | (7,17) | 36,79 | (28,77) | ng/ml | ||||
| Ídem, leche de transición, Granada | CG-MS | ND | ND | (17-35) | 1,07 | (1,32) | 30,30 | (31,97) | ng/ml | ||||
| Ídem, leche madura, Almería | CG-MS | ND | ND | (17-35) | 2,62 | (3,88) | 37,52 | (30,04) | ng/ml | ||||
| Ídem, leche madura, Granada | CG-MS | ND | ND | (17-35) | 4,75 | (8,24) | 19,87 | (11,95) | ng/ml | ||||
| Ribas-Fitó et al (2003), cordón | CG-DCE/CG-EM | 70 | 0 | (NA) | 0,85 | ng/ml | |||||||
| Botella et al (2004), tejido adiposo | CG-DCE/CG-EM | NA | 200 | 53 | (ND) | 0,06 | (0,05) | 0,50 | (0,41) | μg/g | |||
| Ídem, suero | CG-DCE/CG-EM | NA | 200 | 53 | (ND) | 3,15 | (2,26) | 8,11 | (12,76) | ng/ml | |||
| Jiménez et al (2004), tejido adiposo | HPLC | NA | 200 | 53 | (ND) | 61,01 | (51,20) | 508,83 | (410,54) | ng/g | |||
| Ídem, suero | HPLC | NA | 200 | 53 | (ND) | 3,15 | (2,56) | 8,11 | (12,76) | ng/ml | |||
| Sunyer et al (2005) | CG-DCE | 405 | 4 | (NA) | 1,03 | ng/ml | |||||||
| Zumbado et al (2005) | CG-DCE | 302 | 380 | 38,6b | (19,78b) | 0,14 | (0,33) | 0,21 | (0,25) | μg/g | |||
| Cerrillo et al (2006) | HPLC-CG | 0 | 458 | 56 | (10,46) | 0,013 | (0,032) | 0,392 | 0,501 | (0,496) | μg/g | ||
| Carreño et al (2007) | CG-DCE/CG-EM | 220 | 0 | 20,75 | (2) | 1,85 | 3,64 | (4,91) | 4,15 | 5,18 | 4,07 | ng/ml | |
| Martín-Olmedo et al (2006) | CG-MS | 197 | 190 | 51 | 17,08 | ND | ND | ND | 93 | 80,6 | (3,88) | ng/g | |
| Carrizo et al (2006), sangre de cordón umbilical | CG-DCE | 202 | 208 | 0 | 0,08 | 0,18 | (0,27) | 1,03 | 1,6 | (2) | ng/ml | ||
| Ídem, suero | CG-DCE | 136 | 148 | 4 | 0,05 | 0,073 | (0,12) | 0,81 | 1,6 | (3,2) | ng/ml | ||
| López-Espinosa et al (2006) | CG-DCE | 150 | 0,5 | 1,02 | (1,47) | 1,78 | 2,37 | (2,80) | ng/g | ||||
| Torres Jiménez et al (2006). | |||||||||||||
| suero materno | CG-DCE/CG-EM | NA | 72 | (18-35) | 10,51 | (7,18) | 31,87 | (34,69) | ng/ml | ||||
| Ídem, tejido adiposo | CG-DCE/CG-EM | NA | 72 | (18-35) | 60,62 | (28,38) | 2.240,84 | (1.254,39) | ng/g | ||||
| Ídem, suero de cordón umbilical | CG-DCE/CG-EM | NA | 72 | (18-35) | 9,00 | (6,26) | 24,03 | (48,11) | ng/ml | ||||
CG: cromatografía de gases; CG-DCE: cromatografía de gases con detección por captura de electrones; CG-EM: cromatografía de gases con espectrometría de masas; DT: desviación típica; NA: no aplicable; ng/ml equivale a partes por billón (ppb) (billón en la acepción anglosajona, es decir, mil millones); ND: no disponible; μg/g equivale a partes por millón (ppm).
Aunque no lo demuestren (por las razones ya apuntadas), los datos de la tabla 1b son compatibles con la noción de que los valores en suero de p,p'-DDT y p,p'-DDE han decrecido moderadamente en los últimos 20 años. En los estudios disponibles, el p,p'-DDT presenta unas concentraciones medias de 5,46 ng/mL en agricultores navarros en los años ochenta52 y de 3,15 ng/ml en mujeres posmenopáusicas sometidas a intervención quirúrgica73, más recientemente. En el caso del p,p'-DDE las correspondientes cifras son 15,17 ng/ml52 y 8,11 ng/ml73. Las diferencias son de escasa magnitud, como veremos a continuación. Se observan también pequeñas diferencias en las concentraciones de p,p'-DDE en tejido adiposo: de 6,27 μg/g cuando el compuesto fue analizado en algunas autopsias53 y de 0,5 μg/g en mujeres posmenopáusicas intervenidas73. En mujeres sometidas a cesárea se han encontrado valores elevados de DDT y DDE tanto en suero materno (10,51 y 31,87 ng/mL, respectivamente) como en tejido adiposo (60,62 y 2240,84 ng/g, respectivamente)81.
Hay grandes diferencias en los valores detectados en los distintos estudios; por ejemplo, hacia 1988 se detectan cifras promedio entre 0,28 y 6,20 μg/g de p,p'-DDT. Nótese que este último valor es 22 veces superior al primero; tratándose de medias, es evidente que entre ambas poblaciones hubo diferencias todavía más extremas en la parte superior de las distribuciones. En relación con los valores de p,p'-DDT, también es notorio que la media en un estudio efectuado en 1998, el único basado en una muestra representativa de una población general48, fue todavía de 0,14 μg/g (tabla 1b); así pues, esta cifra sólo es la mitad de la hallada 10 años antes en la otra población española52. En este amplio estudio48, los percentiles 25 y 75 para las concentraciones de p,p'-DDE fueron 0 y 93,3 ng/g en el grupo de menores de 18 años, y 128 y 417 ng/g en el grupo de 65-75 años, respectivamente, de modo que dentro de una misma población general las diferencias pueden ser superiores a 400 veces. También dentro de un mismo grupo de pacientes puede haber grandes diferencias en las concentraciones de CTP Así, por ejemplo, en un grupo de 144 pacientes con cáncer de páncreas57-59, las concentraciones mínima y máxima de p,p'-DDE fueron 114,44 y 29.878,93 ng/g; la segunda cifra es 260 veces superior a la primera. Lógicamente, la magnitud de las diferencias depende en parte de la escala; en los casos anteriores, las concentraciones se expresan en partes por billón (ppb) (1 ng/g, 1 ng/ml o 1 μg/l).
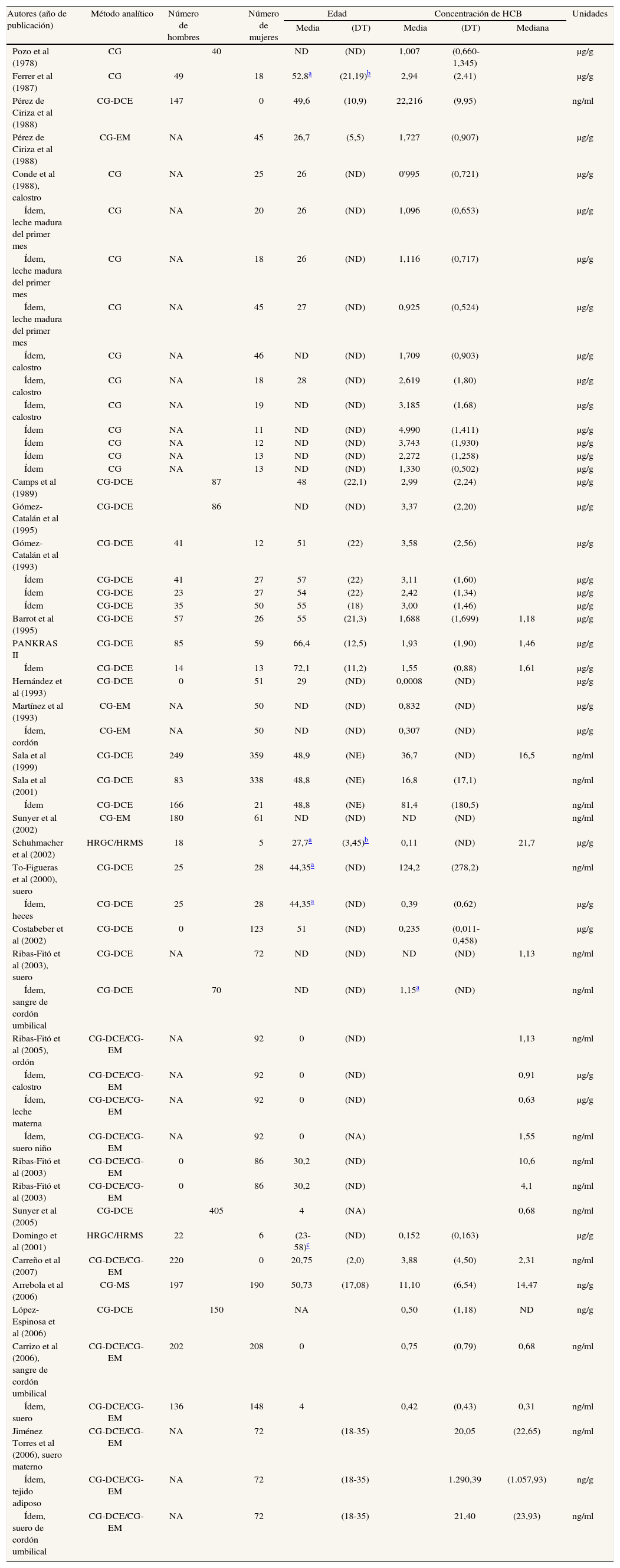
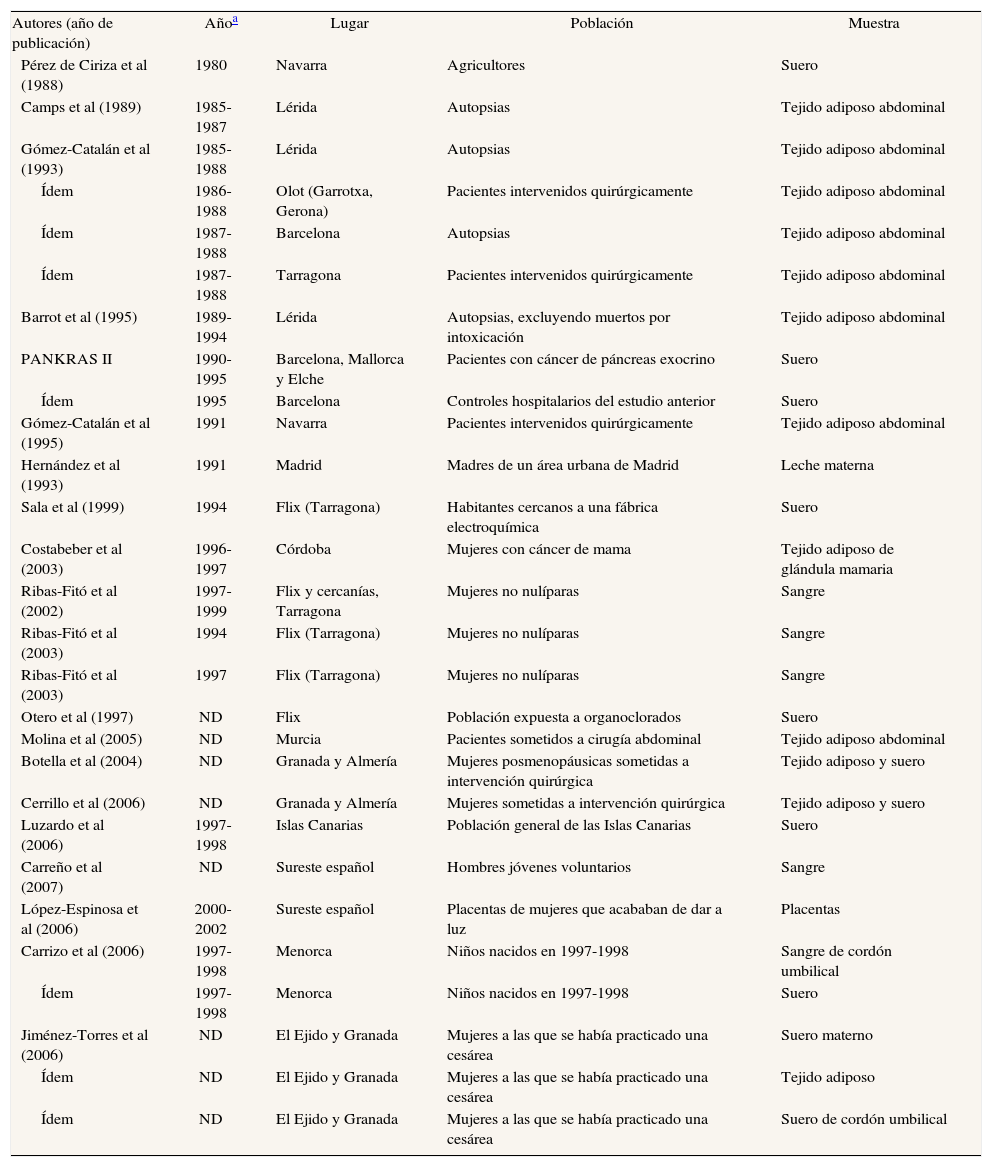
HexaclorobencenoLas publicaciones que han analizado el hexaclorobenceno (HCB) se especifican en las tablas 2a y 2b48,51-53,55,61,63,65,67-69,72,75,77,79-88. Un 45% de los estudios analizan sangre, un 32% leche materna y un 21% tejido adiposo. Un estudio analizó HCB en heces humanas86. Las concentraciones de HCB en los 3 tipos de muestra biológica han tendido a disminuir desde finales de los años setenta. En sangre, se pasa de 22,2 μg/g en agricultores navarros de los años ochenta52 a 0,152 μg/g en 28 trabajadores voluntarios de una incineradora de Constantí (Tarragona)87. En grasa, los primeros estudios detectaban 2,94 μg/g en autopsias83, y los últimos 0,23 μg/g en mujeres sometidas a intervención quirúrgica67. En leche materna, aunque no se dispone de muchos datos, casi no se aprecia un descenso de las concentraciones. También para el HCB hay grandes diferencias entre los estudios en los valores detectados.
Principales características de los estudios españoles que analizan concentraciones de hexaclorobenceno en humanos
| Autores (año de publicación) | Añoa | Lugar | Población | Muestra |
| Pozo et al (1978) | ND | Madrid | Individuos sometidos a intervención quirúrgica | Tejido adiposo |
| Ferrer et al (1987) | ND | Zaragoza | Autopsias | Tejido adiposo abdominal |
| Pérez de Ciriza et al (1988) | 1980 | Navarra | Agricultores | Suero |
| Pérez de Ciriza et al (1988) | 1980 | Navarra | Madres que habían alumbrado 4-5 días antes | Leche materna |
| Conde et al (1988) | 1984 | Madrid | Mujeres residentes en el centro | Calostro |
| Ídem | 1984 | Madrid | Mujeres residentes en el centro | Leche madura del primer mes |
| Ídem | 1987 | Madrid | Mujeres residentes en el centro | Leche madura del primer mes |
| Ídem | 1986 | Valencia | Mujeres residentes en zona agrícola | Leche madura del primer mes |
| Ídem | 1987 | Pamplona | Mujeres representativas de la población navarra | Calostro |
| Ídem | 1987 | Barcelona | Mujeres residentes en la zona industrial del Llobregat | Calostro |
| Ídem | 1987 | Bilbao | Mujeres residentes en zona agrícola e industrial | Calostro |
| Ídem | 1984 | San Esteban de Gormaz (Soria) | Mujeres de una comunidad agrícola | ND |
| Ídem | 1987 | San Esteban de Gormaz (Soria) | Mujeres de una comunidad agrícola | ND |
| Ídem | ND | Arévalo (Ávila) | Mujeres de una comunidad agrícola | ND |
| Ídem | ND | Pedro Bernardo (Ávila) | Mujeres de una comunidad agrícola | ND |
| Camps et al (1989) | 1985-1987 | Lérida | Autopsias | Tejido adiposo abdominal |
| Gómez-Catalán et al (1995) | 1985-1987 | Lérida | Autopsias | Tejido adiposo abdominal |
| Gómez-Catalán et al (1993) | 1985-1988 | Lérida | Autopsias | Tejido adiposo abdominal |
| Ídem | 1986-1988 | Olot (Garrotxa, Gerona) | Pacientes intervenidos quirúrgicamente | Tejido adiposo abdominal |
| Ídem | 1987-1988 | Barcelona | Autopsias | Tejido adiposo abdominal |
| Ídem | 1987-1988 | Tarragona | Pacientes intervenidos quirúrgicamente | Tejido adiposo abdominal |
| Barrot et al (1995) | 1989-1994 | Lérida | Autopsias, excluyendo muertos por intoxicación | Tejido adiposo abdominal |
| PANKRAS II | 1990-1995 | Barcelona, Mallorca y Elche | Pacientes con cáncer de páncreas exocrino | Suero |
| Ídem | 1995 | Barcelona | Controles hospitalarios del estudio anterior | Suero |
| Hernández et al (1993) | 1991 | Madrid | Madres de un área urbana de Madrid | Leche materna |
| Martínez et al (1993) | 1992 | Huelva | Madres y sus hijos recién nacidos | Sangre materna y de cordón umbilical |
| Sala et al (1999) | 1994 | Flix (Tarragona) | Habitantes cercanos a una fábrica electroquímica | Suero |
| Sala et al (2001) | 1994 | Flix (Tarragona) | Población que nunca ha trabajado | Suero |
| Ídem | 1994 | Flix (Tarragona) | Población trabajadora de una electroquímica | Suero |
| Sunyer et al (2002) | 1994 | Flix (Tarragona) | Individuos potencialmente expuestos a HCB | Suero |
| Schuhmacher et al (2002) | ND | Constantí (Tarragona) | Voluntarios trabajadores de una incineradora | Sangre |
| To-Figueras et al (2000) | ND | Flix (Tarragona) | Voluntarios y personas seleccionadas aleatoriamente | Suero y heces |
| Costabeber et al (2003) | 1996-1997 | Córdoba | Mujeres sometidas a intervención quirúrgica | Tejido adiposo mamario |
| Ribas-Fitó et al (2003) | 1997-1999 | Flix y cercanías (Tarragona) | Mujeres no nulíparas | Sangre |
| Ribas-Fitó et al (2005) | 1997-1999 | Flix y cercanías | Madres e hijos de 13 meses | Suero del hijo y del cordón umbilical. Calostro y leche de la madre |
| Ribas-Fitó et al (2003) | 1997-1999 | Flix y cercanías (Tarragona) | Mujeres que acaban de dar a luz | Suero |
| Ídem | 1997-1999 | Flix y cercanías (Tarragona) | Cordón umbilical | Sangre de cordón umbilical |
| Sunyer et al (2005) | 1997 | Menorca | Madres y sus hijos recién nacidos | Suero de cordón umbilical, sangre materna y del hijo |
| Domingo et al (2001) | 1999 | Constantí (Tarragona) | Voluntarios trabajadores de una incineradora | Plasma |
| Carreño et al (2007) | ND | Sureste español | Hombres jóvenes voluntarios | Sangre |
| Arrebola et al (2006) | 2003-2004 | Granada ciudad y costa | Población adulta mayor de 16 años | Tejido adiposo |
| López-Espinosa et al (2006) | 2000-2002 | Sureste español | Placentas de mujeres que acababan de dar a luz | Placentas |
| Carrizo et al (2006) | 1997-1998 | Menorca | Niños nacidos en 1997-1998 | Sangre de cordón umbilical |
| Ídem | 1997-1998 | Menorca | Niños nacidos en 1997-1998 | Suero |
| Jiménez Torres et al (2006) | ND | El Ejido y Granada | Mujeres a las que se había practicado una cesárea | Suero materno |
| Ídem | ND | El Ejido y Granada | Mujeres a las que se había practicado una cesárea | Tejido adiposo |
| Ídem | ND | El Ejido y Granada | Mujeres a las que se había practicado una cesárea | Suero de cordón umbilical |
HCB: hexaclorobenceno; ND: no disponible.
Resultados de estudios españoles que analizan concentraciones de hexaclorobenceno en humanos
| Autores (año de publicación) | Método analítico | Número de hombres | Número de mujeres | Edad | Concentración de HCB | Unidades | ||||
| Media | (DT) | Media | (DT) | Mediana | ||||||
| Pozo et al (1978) | CG | 40 | ND | (ND) | 1,007 | (0,660-1,345) | μg/g | |||
| Ferrer et al (1987) | CG | 49 | 18 | 52,8a | (21,19)b | 2,94 | (2,41) | μg/g | ||
| Pérez de Ciriza et al (1988) | CG-DCE | 147 | 0 | 49,6 | (10,9) | 22,216 | (9,95) | ng/ml | ||
| Pérez de Ciriza et al (1988) | CG-EM | NA | 45 | 26,7 | (5,5) | 1,727 | (0,907) | μg/g | ||
| Conde et al (1988), calostro | CG | NA | 25 | 26 | (ND) | 0'995 | (0,721) | μg/g | ||
| Ídem, leche madura del primer mes | CG | NA | 20 | 26 | (ND) | 1,096 | (0,653) | μg/g | ||
| Ídem, leche madura del primer mes | CG | NA | 18 | 26 | (ND) | 1,116 | (0,717) | μg/g | ||
| Ídem, leche madura del primer mes | CG | NA | 45 | 27 | (ND) | 0,925 | (0,524) | μg/g | ||
| Ídem, calostro | CG | NA | 46 | ND | (ND) | 1,709 | (0,903) | μg/g | ||
| Ídem, calostro | CG | NA | 18 | 28 | (ND) | 2,619 | (1,80) | μg/g | ||
| Ídem, calostro | CG | NA | 19 | ND | (ND) | 3,185 | (1,68) | μg/g | ||
| Ídem | CG | NA | 11 | ND | (ND) | 4,990 | (1,411) | μg/g | ||
| Ídem | CG | NA | 12 | ND | (ND) | 3,743 | (1,930) | μg/g | ||
| Ídem | CG | NA | 13 | ND | (ND) | 2,272 | (1,258) | μg/g | ||
| Ídem | CG | NA | 13 | ND | (ND) | 1,330 | (0,502) | μg/g | ||
| Camps et al (1989) | CG-DCE | 87 | 48 | (22,1) | 2,99 | (2,24) | μg/g | |||
| Gómez-Catalán et al (1995) | CG-DCE | 86 | ND | (ND) | 3,37 | (2,20) | μg/g | |||
| Gómez-Catalán et al (1993) | CG-DCE | 41 | 12 | 51 | (22) | 3,58 | (2,56) | μg/g | ||
| Ídem | CG-DCE | 41 | 27 | 57 | (22) | 3,11 | (1,60) | μg/g | ||
| Ídem | CG-DCE | 23 | 27 | 54 | (22) | 2,42 | (1,34) | μg/g | ||
| Ídem | CG-DCE | 35 | 50 | 55 | (18) | 3,00 | (1,46) | μg/g | ||
| Barrot et al (1995) | CG-DCE | 57 | 26 | 55 | (21,3) | 1,688 | (1,699) | 1,18 | μg/g | |
| PANKRAS II | CG-DCE | 85 | 59 | 66,4 | (12,5) | 1,93 | (1,90) | 1,46 | μg/g | |
| Ídem | CG-DCE | 14 | 13 | 72,1 | (11,2) | 1,55 | (0,88) | 1,61 | μg/g | |
| Hernández et al (1993) | CG-DCE | 0 | 51 | 29 | (ND) | 0,0008 | (ND) | μg/g | ||
| Martínez et al (1993) | CG-EM | NA | 50 | ND | (ND) | 0,832 | (ND) | μg/g | ||
| Ídem, cordón | CG-EM | NA | 50 | ND | (ND) | 0,307 | (ND) | μg/g | ||
| Sala et al (1999) | CG-DCE | 249 | 359 | 48,9 | (NE) | 36,7 | (ND) | 16,5 | ng/ml | |
| Sala et al (2001) | CG-DCE | 83 | 338 | 48,8 | (NE) | 16,8 | (17,1) | ng/ml | ||
| Ídem | CG-DCE | 166 | 21 | 48,8 | (NE) | 81,4 | (180,5) | ng/ml | ||
| Sunyer et al (2002) | CG-EM | 180 | 61 | ND | (ND) | ND | (ND) | ng/ml | ||
| Schuhmacher et al (2002) | HRGC/HRMS | 18 | 5 | 27,7a | (3,45)b | 0,11 | (ND) | 21,7 | μg/g | |
| To-Figueras et al (2000), suero | CG-DCE | 25 | 28 | 44,35a | (ND) | 124,2 | (278,2) | ng/ml | ||
| Ídem, heces | CG-DCE | 25 | 28 | 44,35a | (ND) | 0,39 | (0,62) | μg/g | ||
| Costabeber et al (2002) | CG-DCE | 0 | 123 | 51 | (ND) | 0,235 | (0,011-0,458) | μg/g | ||
| Ribas-Fitó et al (2003), suero | CG-DCE | NA | 72 | ND | (ND) | ND | (ND) | 1,13 | ng/ml | |
| Ídem, sangre de cordón umbilical | CG-DCE | 70 | ND | (ND) | 1,15a | (ND) | ng/ml | |||
| Ribas-Fitó et al (2005), ordón | CG-DCE/CG-EM | NA | 92 | 0 | (ND) | 1,13 | ng/ml | |||
| Ídem, calostro | CG-DCE/CG-EM | NA | 92 | 0 | (ND) | 0,91 | μg/g | |||
| Ídem, leche materna | CG-DCE/CG-EM | NA | 92 | 0 | (ND) | 0,63 | μg/g | |||
| Ídem, suero niño | CG-DCE/CG-EM | NA | 92 | 0 | (NA) | 1,55 | ng/ml | |||
| Ribas-Fitó et al (2003) | CG-DCE/CG-EM | 0 | 86 | 30,2 | (ND) | 10,6 | ng/ml | |||
| Ribas-Fitó et al (2003) | CG-DCE/CG-EM | 0 | 86 | 30,2 | (ND) | 4,1 | ng/ml | |||
| Sunyer et al (2005) | CG-DCE | 405 | 4 | (NA) | 0,68 | ng/ml | ||||
| Domingo et al (2001) | HRGC/HRMS | 22 | 6 | (23-58)c | (ND) | 0,152 | (0,163) | μg/g | ||
| Carreño et al (2007) | CG-DCE/CG-EM | 220 | 0 | 20,75 | (2,0) | 3,88 | (4,50) | 2,31 | ng/ml | |
| Arrebola et al (2006) | CG-MS | 197 | 190 | 50,73 | (17,08) | 11,10 | (6,54) | 14,47 | ng/g | |
| López-Espinosa et al (2006) | CG-DCE | 150 | NA | 0,50 | (1,18) | ND | ng/g | |||
| Carrizo et al (2006), sangre de cordón umbilical | CG-DCE/CG-EM | 202 | 208 | 0 | 0,75 | (0,79) | 0,68 | ng/ml | ||
| Ídem, suero | CG-DCE/CG-EM | 136 | 148 | 4 | 0,42 | (0,43) | 0,31 | ng/ml | ||
| Jiménez Torres et al (2006), suero materno | CG-DCE/CG-EM | NA | 72 | (18-35) | 20,05 | (22,65) | ng/ml | |||
| Ídem, tejido adiposo | CG-DCE/CG-EM | NA | 72 | (18-35) | 1.290,39 | (1.057,93) | ng/g | |||
| Ídem, suero de cordón umbilical | CG-DCE/CG-EM | NA | 72 | (18-35) | 21,40 | (23,93) | ng/ml | |||
CG: cromatografía de gases; CG-DCE: cromatografía de gases con detección por captura de electrones; CG-EM: cromatografía de gases con espectrometría de masas; DT: desviación típica; HCB: hexaclorobenceno; NA: no aplicable; ng/ml equivale a partes por billón (ppb) (billón: en la acepción anglosajona, es decir, mil millones); ND: no disponible; μg/g equivale a partes por millón (ppm).
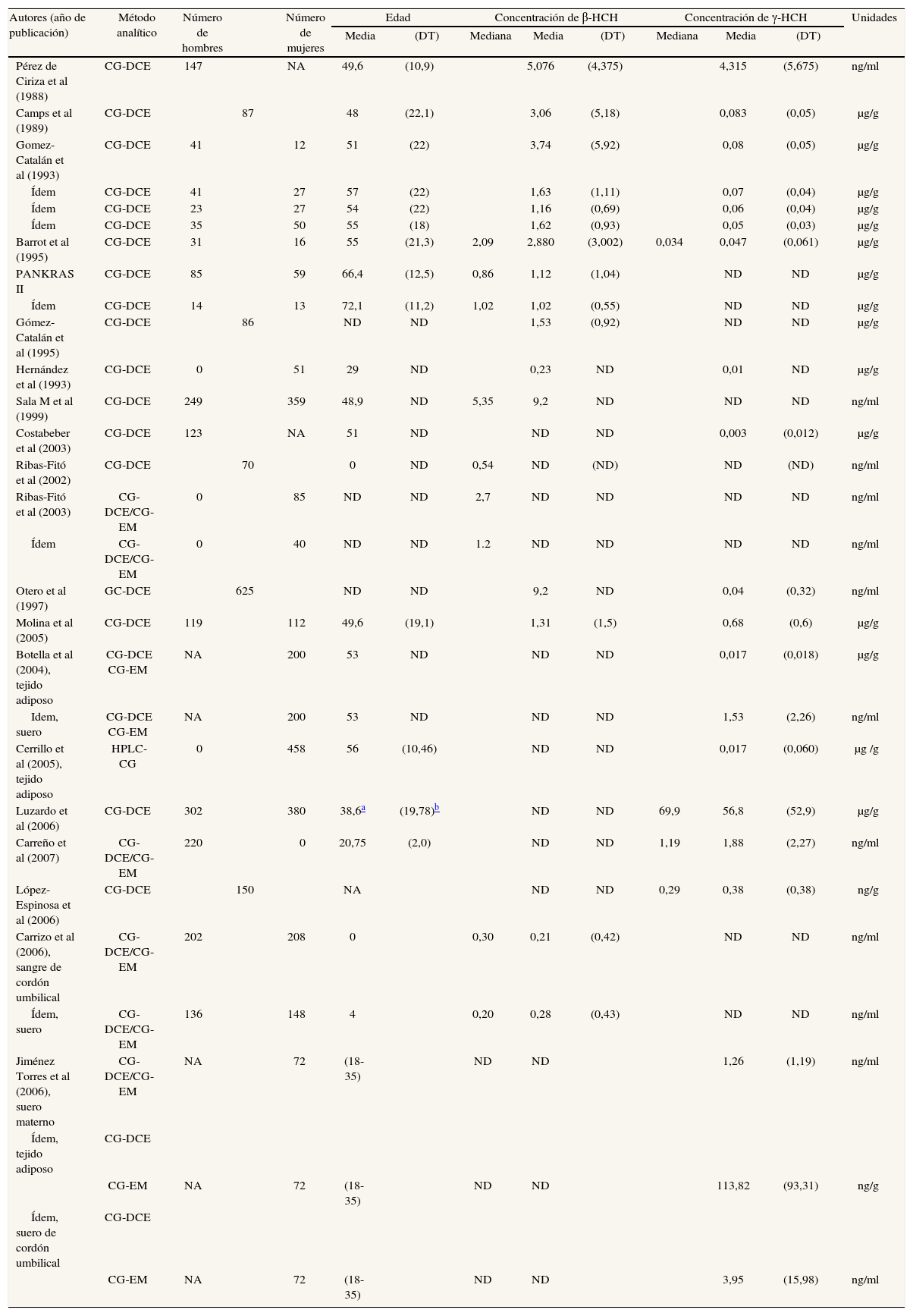
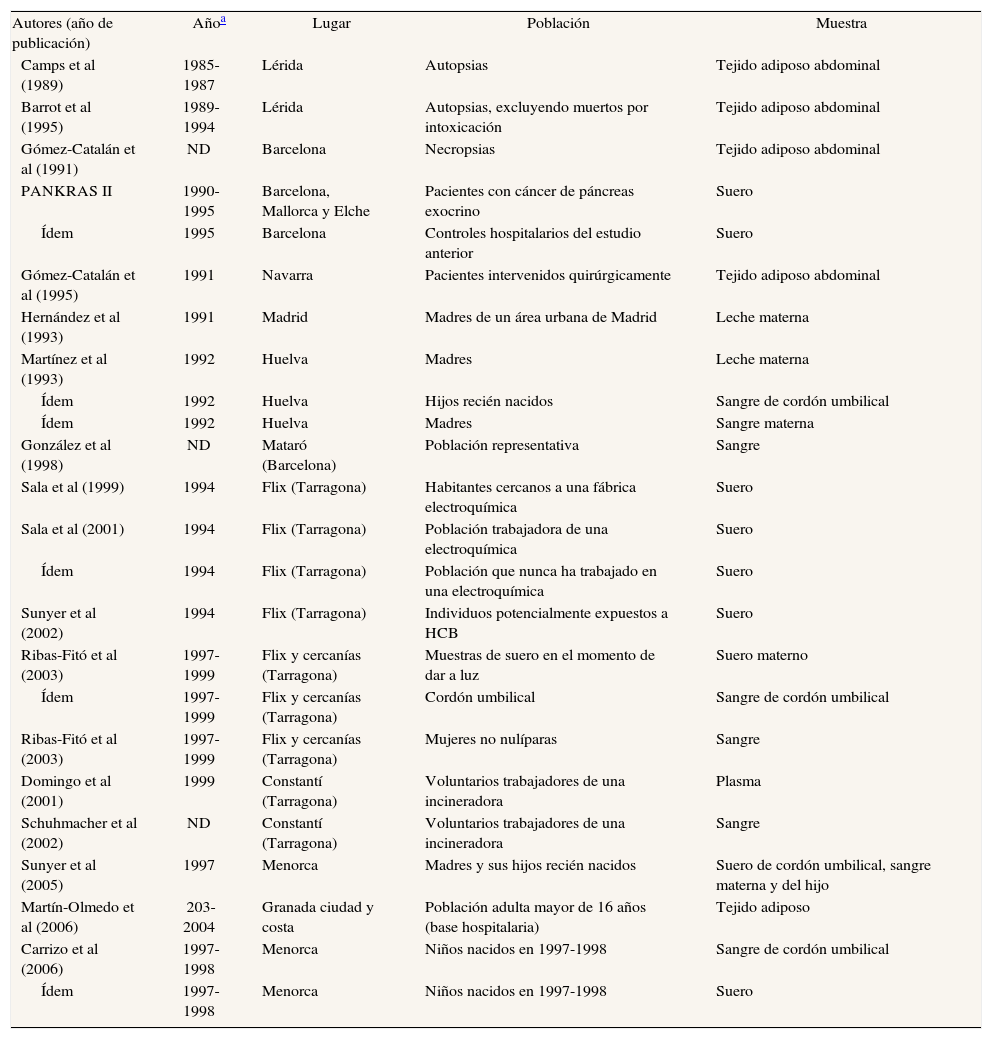
Los estudios que determinan concentraciones de hexaclorociclohexanos (HCH) se especifican en las tablas 3a y 3b48,49,53,55-61,67,70,72,73,76,77,89. Se ha realizado casi el mismo porcentaje de estudios en tejido adiposo (46%) y en sangre (50%), mientras que sólo un 4% son en leche materna. El número de sujetos que participan en los estudios ha aumentado con los años. No es evidente que las concentraciones de los 2 isómeros disminuyan con el paso de los años, especialmente en el caso del β-HCH en suero. En los años ochenta se hallaban concentraciones de 5,076 ng/ml en agricultores navarros52, mientras que a finales de los noventa, en la población tarraconense de Flix (cabe decir que es sede de una fábrica de CTP), se determinaron concentraciones de 9,2 ng/ml89. Para el γ-HCH, o lindano, se han hallado concentraciones entre 4,31 ng/ ml52 y 0,04 ng/ml89 (tabla 3b). Una observación consistentemente efectuada en muchos estudios en todo el mundo es que las concentraciones de β-HCH son, a menudo, claramente superiores a las de γ-HCH. Todos los estudios sobre HCH identificados en esta revisión (y resumidos en la tabla 3b) que estudiaron a la vez β-HCH γ-HCH hallaron valores superiores del isómero β que del γ.
Principales características de estudios españoles que analizan concentraciones de hexaclorociclohexanos en humanos
| Autores (año de publicación) | Añoa | Lugar | Población | Muestra |
| Pérez de Ciriza et al (1988) | 1980 | Navarra | Agricultores | Suero |
| Camps et al (1989) | 1985-1987 | Lérida | Autopsias | Tejido adiposo abdominal |
| Gómez-Catalán et al (1993) | 1985-1988 | Lérida | Autopsias | Tejido adiposo abdominal |
| Ídem | 1986-1988 | Olot (Garrotxa, Gerona) | Pacientes intervenidos quirúrgicamente | Tejido adiposo abdominal |
| Ídem | 1987-1988 | Barcelona | Autopsias | Tejido adiposo abdominal |
| Ídem | 1987-1988 | Tarragona | Pacientes intervenidos quirúrgicamente | Tejido adiposo abdominal |
| Barrot et al (1995) | 1989-1994 | Lérida | Autopsias, excluyendo muertos por intoxicación | Tejido adiposo abdominal |
| PANKRAS II | 1990-1995 | Barcelona, Mallorca y Elche | Pacientes con cáncer de páncreas exocrino | Suero |
| Ídem | 1995 | Barcelona | Controles hospitalarios del estudio anterior | Suero |
| Gómez-Catalán et al (1995) | 1991 | Navarra | Pacientes intervenidos quirúrgicamente | Tejido adiposo abdominal |
| Hernández et al (1993) | 1991 | Madrid | Madres de un área urbana de Madrid | Leche materna |
| Sala et al (1999) | 1994 | Flix (Tarragona) | Habitantes cercanos a una fábrica electroquímica | Suero |
| Costabeber et al (2003) | 1996-1997 | Córdoba | Mujeres con cáncer de mama | Tejido adiposo de glándula mamaria |
| Ribas-Fitó et al (2002) | 1997-1999 | Flix y cercanías, Tarragona | Mujeres no nulíparas | Sangre |
| Ribas-Fitó et al (2003) | 1994 | Flix (Tarragona) | Mujeres no nulíparas | Sangre |
| Ribas-Fitó et al (2003) | 1997 | Flix (Tarragona) | Mujeres no nulíparas | Sangre |
| Otero et al (1997) | ND | Flix | Población expuesta a organoclorados | Suero |
| Molina et al (2005) | ND | Murcia | Pacientes sometidos a cirugía abdominal | Tejido adiposo abdominal |
| Botella et al (2004) | ND | Granada y Almería | Mujeres posmenopáusicas sometidas a intervención quirúrgica | Tejido adiposo y suero |
| Cerrillo et al (2006) | ND | Granada y Almería | Mujeres sometidas a intervención quirúrgica | Tejido adiposo y suero |
| Luzardo et al (2006) | 1997-1998 | Islas Canarias | Población general de las Islas Canarias | Suero |
| Carreño et al (2007) | ND | Sureste español | Hombres jóvenes voluntarios | Sangre |
| López-Espinosa et al (2006) | 2000-2002 | Sureste español | Placentas de mujeres que acababan de dar a luz | Placentas |
| Carrizo et al (2006) | 1997-1998 | Menorca | Niños nacidos en 1997-1998 | Sangre de cordón umbilical |
| Ídem | 1997-1998 | Menorca | Niños nacidos en 1997-1998 | Suero |
| Jiménez-Torres et al (2006) | ND | El Ejido y Granada | Mujeres a las que se había practicado una cesárea | Suero materno |
| Ídem | ND | El Ejido y Granada | Mujeres a las que se había practicado una cesárea | Tejido adiposo |
| Ídem | ND | El Ejido y Granada | Mujeres a las que se había practicado una cesárea | Suero de cordón umbilical |
ND: no disponible.
Resultados de los estudios españoles que analizan concentraciones de hexaclorociclohexanos en humanos
| Autores (año de publicación) | Método analítico | Número de hombres | Número de mujeres | Edad | Concentración de β-HCH | Concentración de γ-HCH | Unidades | ||||||
| Media | (DT) | Mediana | Media | (DT) | Mediana | Media | (DT) | ||||||
| Pérez de Ciriza et al (1988) | CG-DCE | 147 | NA | 49,6 | (10,9) | 5,076 | (4,375) | 4,315 | (5,675) | ng/ml | |||
| Camps et al (1989) | CG-DCE | 87 | 48 | (22,1) | 3,06 | (5,18) | 0,083 | (0,05) | μg/g | ||||
| Gomez-Catalán et al (1993) | CG-DCE | 41 | 12 | 51 | (22) | 3,74 | (5,92) | 0,08 | (0,05) | μg/g | |||
| Ídem | CG-DCE | 41 | 27 | 57 | (22) | 1,63 | (1,11) | 0,07 | (0,04) | μg/g | |||
| Ídem | CG-DCE | 23 | 27 | 54 | (22) | 1,16 | (0,69) | 0,06 | (0,04) | μg/g | |||
| Ídem | CG-DCE | 35 | 50 | 55 | (18) | 1,62 | (0,93) | 0,05 | (0,03) | μg/g | |||
| Barrot et al (1995) | CG-DCE | 31 | 16 | 55 | (21,3) | 2,09 | 2,880 | (3,002) | 0,034 | 0,047 | (0,061) | μg/g | |
| PANKRAS II | CG-DCE | 85 | 59 | 66,4 | (12,5) | 0,86 | 1,12 | (1,04) | ND | ND | μg/g | ||
| Ídem | CG-DCE | 14 | 13 | 72,1 | (11,2) | 1,02 | 1,02 | (0,55) | ND | ND | μg/g | ||
| Gómez-Catalán et al (1995) | CG-DCE | 86 | ND | ND | 1,53 | (0,92) | ND | ND | μg/g | ||||
| Hernández et al (1993) | CG-DCE | 0 | 51 | 29 | ND | 0,23 | ND | 0,01 | ND | μg/g | |||
| Sala M et al (1999) | CG-DCE | 249 | 359 | 48,9 | ND | 5,35 | 9,2 | ND | ND | ND | ng/ml | ||
| Costabeber et al (2003) | CG-DCE | 123 | NA | 51 | ND | ND | ND | 0,003 | (0,012) | μg/g | |||
| Ribas-Fitó et al (2002) | CG-DCE | 70 | 0 | ND | 0,54 | ND | (ND) | ND | (ND) | ng/ml | |||
| Ribas-Fitó et al (2003) | CG-DCE/CG-EM | 0 | 85 | ND | ND | 2,7 | ND | ND | ND | ND | ng/ml | ||
| Ídem | CG-DCE/CG-EM | 0 | 40 | ND | ND | 1.2 | ND | ND | ND | ND | ng/ml | ||
| Otero et al (1997) | GC-DCE | 625 | ND | ND | 9,2 | ND | 0,04 | (0,32) | ng/ml | ||||
| Molina et al (2005) | CG-DCE | 119 | 112 | 49,6 | (19,1) | 1,31 | (1,5) | 0,68 | (0,6) | μg/g | |||
| Botella et al (2004), tejido adiposo | CG-DCE CG-EM | NA | 200 | 53 | ND | ND | ND | 0,017 | (0,018) | μg/g | |||
| Idem, suero | CG-DCE CG-EM | NA | 200 | 53 | ND | ND | ND | 1,53 | (2,26) | ng/ml | |||
| Cerrillo et al (2005), tejido adiposo | HPLC-CG | 0 | 458 | 56 | (10,46) | ND | ND | 0,017 | (0,060) | μg /g | |||
| Luzardo et al (2006) | CG-DCE | 302 | 380 | 38,6a | (19,78)b | ND | ND | 69,9 | 56,8 | (52,9) | μg/g | ||
| Carreño et al (2007) | CG-DCE/CG-EM | 220 | 0 | 20,75 | (2,0) | ND | ND | 1,19 | 1,88 | (2,27) | ng/ml | ||
| López-Espinosa et al (2006) | CG-DCE | 150 | NA | ND | ND | 0,29 | 0,38 | (0,38) | ng/g | ||||
| Carrizo et al (2006), sangre de cordón umbilical | CG-DCE/CG-EM | 202 | 208 | 0 | 0,30 | 0,21 | (0,42) | ND | ND | ng/ml | |||
| Ídem, suero | CG-DCE/CG-EM | 136 | 148 | 4 | 0,20 | 0,28 | (0,43) | ND | ND | ng/ml | |||
| Jiménez Torres et al (2006), suero materno | CG-DCE/CG-EM | NA | 72 | (18-35) | ND | ND | 1,26 | (1,19) | ng/ml | ||||
| Ídem, tejido adiposo | CG-DCE | ||||||||||||
| CG-EM | NA | 72 | (18-35) | ND | ND | 113,82 | (93,31) | ng/g | |||||
| Ídem, suero de cordón umbilical | CG-DCE | ||||||||||||
| CG-EM | NA | 72 | (18-35) | ND | ND | 3,95 | (15,98) | ng/ml | |||||
CG: cromatografía de gases; CG-DCE: cromatografía de gases con detección por captura de electrones; CG-EM: cromatografía de gases con espectrometría de masas; DT: desviación típica; NA: no aplicable; ND: no disponible.
En tejido adiposo, las concentraciones de γ-HCH y β-HCH parecen descender ligeramente con los años. A mediados de los ochenta el β-HCH se encontraba en concentraciones de 3,06 μg/g en autopsias53, y a principios de este siglo se determina en valores de 1,31 μg/g en pacientes sometidos a cirugía abdominal70. El lindano se encontraba en grasa en unas concentraciones de 0,08 μg/g53, mientras que los estudios más recientes realizados en mujeres almerienses y granadinas sometidas a intervención quirúrgica hallan lindano en tejido adiposo en concentraciones de 0,017 μg/g73. Sólo hallamos un estudio que analizase HCH en leche materna, realizado en 199160.
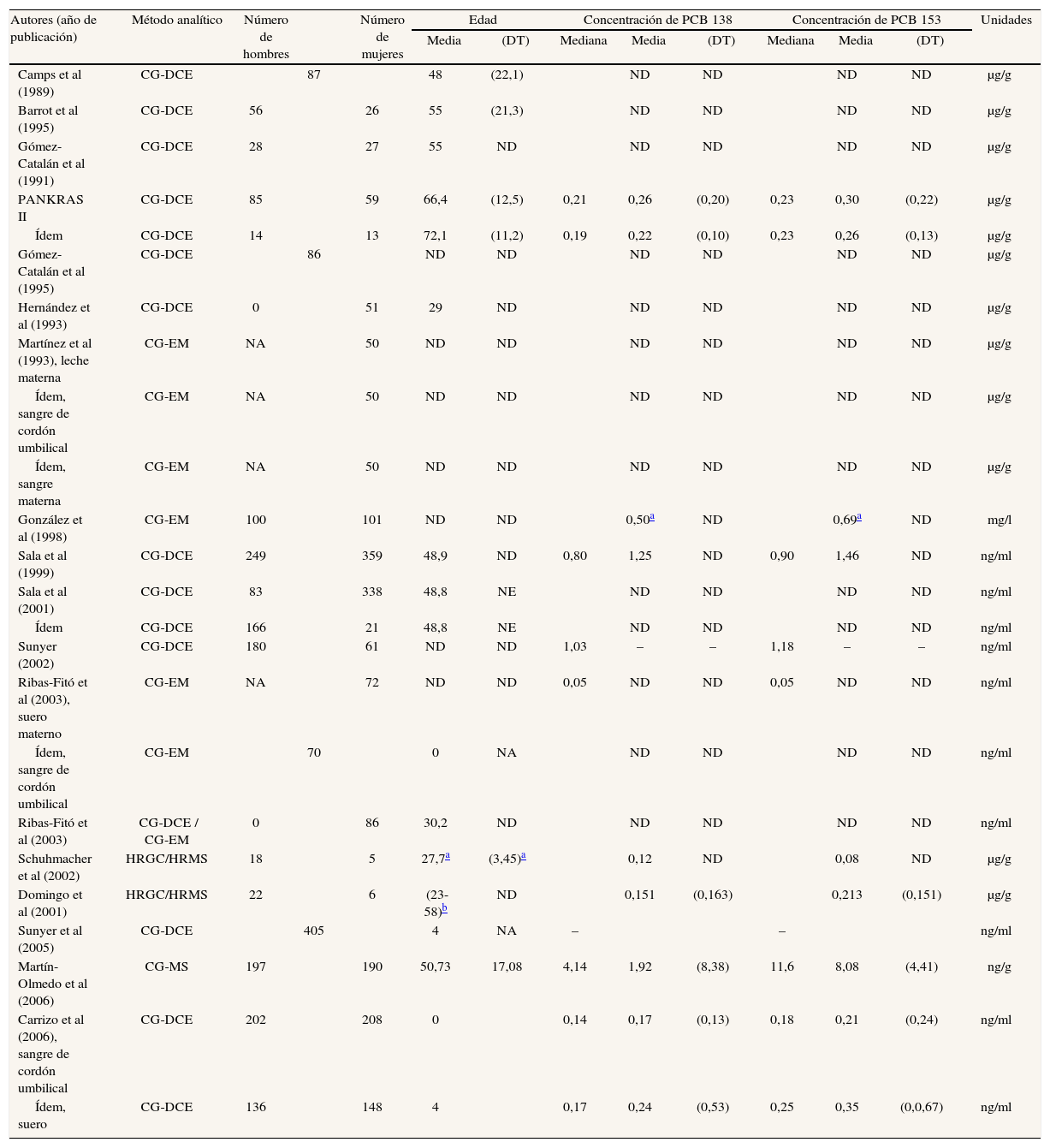
Bifenilos policlorados o policlorobifenilosLos estudios que miden las concentraciones de bifenilos policlorados, o policlorobifenilos (PCB), en la población española se detallan en las tablas 4a y 4b51,53,55-61,63,65,68,72,75,78,79,85,87. En ella sólo se especifican las concentraciones de los congéneres 138, 153 y 180, ya que numerosos estudios los señalan como los que se encuentran con mayor frecuencia en las muestras biológicas analizadas en humanos4,90-92. La mayoría de ellos ha determinado las concentraciones de PCB en sangre, y unos pocos en tejido adiposo y leche materna.
Principales características de los estudios españoles que analizan concentraciones de policlorobifenilos en humanos
| Autores (año de publicación) | Añoa | Lugar | Población | Muestra |
| Camps et al (1989) | 1985-1987 | Lérida | Autopsias | Tejido adiposo abdominal |
| Barrot et al (1995) | 1989-1994 | Lérida | Autopsias, excluyendo muertos por intoxicación | Tejido adiposo abdominal |
| Gómez-Catalán et al (1991) | ND | Barcelona | Necropsias | Tejido adiposo abdominal |
| PANKRAS II | 1990-1995 | Barcelona, Mallorca y Elche | Pacientes con cáncer de páncreas exocrino | Suero |
| Ídem | 1995 | Barcelona | Controles hospitalarios del estudio anterior | Suero |
| Gómez-Catalán et al (1995) | 1991 | Navarra | Pacientes intervenidos quirúrgicamente | Tejido adiposo abdominal |
| Hernández et al (1993) | 1991 | Madrid | Madres de un área urbana de Madrid | Leche materna |
| Martínez et al (1993) | 1992 | Huelva | Madres | Leche materna |
| Ídem | 1992 | Huelva | Hijos recién nacidos | Sangre de cordón umbilical |
| Ídem | 1992 | Huelva | Madres | Sangre materna |
| González et al (1998) | ND | Mataró (Barcelona) | Población representativa | Sangre |
| Sala et al (1999) | 1994 | Flix (Tarragona) | Habitantes cercanos a una fábrica electroquímica | Suero |
| Sala et al (2001) | 1994 | Flix (Tarragona) | Población trabajadora de una electroquímica | Suero |
| Ídem | 1994 | Flix (Tarragona) | Población que nunca ha trabajado en una electroquímica | Suero |
| Sunyer et al (2002) | 1994 | Flix (Tarragona) | Individuos potencialmente expuestos a HCB | Suero |
| Ribas-Fitó et al (2003) | 1997-1999 | Flix y cercanías (Tarragona) | Muestras de suero en el momento de dar a luz | Suero materno |
| Ídem | 1997-1999 | Flix y cercanías (Tarragona) | Cordón umbilical | Sangre de cordón umbilical |
| Ribas-Fitó et al (2003) | 1997-1999 | Flix y cercanías (Tarragona) | Mujeres no nulíparas | Sangre |
| Domingo et al (2001) | 1999 | Constantí (Tarragona) | Voluntarios trabajadores de una incineradora | Plasma |
| Schuhmacher et al (2002) | ND | Constantí (Tarragona) | Voluntarios trabajadores de una incineradora | Sangre |
| Sunyer et al (2005) | 1997 | Menorca | Madres y sus hijos recién nacidos | Suero de cordón umbilical, sangre materna y del hijo |
| Martín-Olmedo et al (2006) | 203-2004 | Granada ciudad y costa | Población adulta mayor de 16 años (base hospitalaria) | Tejido adiposo |
| Carrizo et al (2006) | 1997-1998 | Menorca | Niños nacidos en 1997-1998 | Sangre de cordón umbilical |
| Ídem | 1997-1998 | Menorca | Niños nacidos en 1997-1998 | Suero |
ND: no determinado.
Resultados de los estudios españoles que analizan concentraciones de policlorobifenilos en humanos
| Autores (año de publicación) | Método analítico | Número de hombres | Número de mujeres | Edad | Concentración de PCB 138 | Concentración de PCB 153 | Unidades | ||||||
| Media | (DT) | Mediana | Media | (DT) | Mediana | Media | (DT) | ||||||
| Camps et al (1989) | CG-DCE | 87 | 48 | (22,1) | ND | ND | ND | ND | μg/g | ||||
| Barrot et al (1995) | CG-DCE | 56 | 26 | 55 | (21,3) | ND | ND | ND | ND | μg/g | |||
| Gómez-Catalán et al (1991) | CG-DCE | 28 | 27 | 55 | ND | ND | ND | ND | ND | μg/g | |||
| PANKRAS II | CG-DCE | 85 | 59 | 66,4 | (12,5) | 0,21 | 0,26 | (0,20) | 0,23 | 0,30 | (0,22) | μg/g | |
| Ídem | CG-DCE | 14 | 13 | 72,1 | (11,2) | 0,19 | 0,22 | (0,10) | 0,23 | 0,26 | (0,13) | μg/g | |
| Gómez-Catalán et al (1995) | CG-DCE | 86 | ND | ND | ND | ND | ND | ND | μg/g | ||||
| Hernández et al (1993) | CG-DCE | 0 | 51 | 29 | ND | ND | ND | ND | ND | μg/g | |||
| Martínez et al (1993), leche materna | CG-EM | NA | 50 | ND | ND | ND | ND | ND | ND | μg/g | |||
| Ídem, sangre de cordón umbilical | CG-EM | NA | 50 | ND | ND | ND | ND | ND | ND | μg/g | |||
| Ídem, sangre materna | CG-EM | NA | 50 | ND | ND | ND | ND | ND | ND | μg/g | |||
| González et al (1998) | CG-EM | 100 | 101 | ND | ND | 0,50a | ND | 0,69a | ND | mg/l | |||
| Sala et al (1999) | CG-DCE | 249 | 359 | 48,9 | ND | 0,80 | 1,25 | ND | 0,90 | 1,46 | ND | ng/ml | |
| Sala et al (2001) | CG-DCE | 83 | 338 | 48,8 | NE | ND | ND | ND | ND | ng/ml | |||
| Ídem | CG-DCE | 166 | 21 | 48,8 | NE | ND | ND | ND | ND | ng/ml | |||
| Sunyer (2002) | CG-DCE | 180 | 61 | ND | ND | 1,03 | – | – | 1,18 | – | – | ng/ml | |
| Ribas-Fitó et al (2003), suero materno | CG-EM | NA | 72 | ND | ND | 0,05 | ND | ND | 0,05 | ND | ND | ng/ml | |
| Ídem, sangre de cordón umbilical | CG-EM | 70 | 0 | NA | ND | ND | ND | ND | ng/ml | ||||
| Ribas-Fitó et al (2003) | CG-DCE / CG-EM | 0 | 86 | 30,2 | ND | ND | ND | ND | ND | ng/ml | |||
| Schuhmacher et al (2002) | HRGC/HRMS | 18 | 5 | 27,7a | (3,45)a | 0,12 | ND | 0,08 | ND | μg/g | |||
| Domingo et al (2001) | HRGC/HRMS | 22 | 6 | (23-58)b | ND | 0,151 | (0,163) | 0,213 | (0,151) | μg/g | |||
| Sunyer et al (2005) | CG-DCE | 405 | 4 | NA | – | – | ng/ml | ||||||
| Martín-Olmedo et al (2006) | CG-MS | 197 | 190 | 50,73 | 17,08 | 4,14 | 1,92 | (8,38) | 11,6 | 8,08 | (4,41) | ng/g | |
| Carrizo et al (2006), sangre de cordón umbilical | CG-DCE | 202 | 208 | 0 | 0,14 | 0,17 | (0,13) | 0,18 | 0,21 | (0,24) | ng/ml | ||
| Ídem, suero | CG-DCE | 136 | 148 | 4 | 0,17 | 0,24 | (0,53) | 0,25 | 0,35 | (0,0,67) | ng/ml | ||
CG: cromatografía de gases; CG-DCE: cromatografía de gases con detección por captura de electrones; CG-EM: cromatografía de gases con espectrometría de masas; DT: desviación típica; NA: no aplicable; ND: no disponible.
Las dosis internas de PCB no presentan un patrón discernible. En el caso del PCB 138 la diferencia entre los valores máximo y mínimo es de 0,08 μg/g (0,20 μg/g en controles hospitalarios a principios de los noventa57,59 y 0,12 μg/g en voluntarios trabajadores de una incineradora hacia el año 200085). Tomando como referencia los mismos estudios, la diferencia máxima para el PCB 153 sería de 0,15 μg/g, mientras que los valores máximo y mínimo del PCB 180 en los estudios mencionados serían de 0,26 y 0,08 μg/g. Los estudios realizados en tejido adiposo o en leche materna son escasos; por ello, y por la heterogeneidad de las metodologías, es preferible evitar conclusiones.
DiscusiónLa valoración de los resultados de los estudios identificados en esta revisión se halla limitada fundamentalmente por los siguientes factores: los cambios experimentados por las técnicas de análisis de CTP en las últimas décadas (cromatografía de gases con detección por captura de electrones, espectrometría de masas); la heterogeneidad de los parámetros estadísticos y de las unidades de cálculo; las diferentes matrices biológicas en que se analizan los compuestos; la ausencia de criterios claros de selección de las personas participantes en los estudios, o la selección de grupos heterogéneos y sin representatividad poblacional, y el escaso número de sujetos participantes en la mayoría de los estudios.
Las dos limitaciones principales de esta revisión son, a nuestro juicio, las siguientes: en primer lugar, el período temporal analizado, que no abarca la década de lo sesenta ni los principios de la década siguiente, a pesar de que no se excluyó deliberadamente ningún trabajo efectuado en esas épocas; no obstante, el intervalo de 30 años es notable, teniendo en cuenta que se trata de la primera revisión sistemática realizada hasta la fecha en España. La segunda limitación se refiere al número de CTP analizados: aunque priorizamos compuestos de amplia prevalencia en humanos, es evidente que las revisiones ulteriores deberán analizar los estudios sobre otros CTP, como las dioxinas y los furanos, los PBDE y los PBB, y otros (metales pesados, hidrocarburos aromáticos policíclicos, etc.)13,22-25,46,47,93. Tampoco podemos tener certeza alguna de haber incluido la totalidad de los trabajos efectuados, pues alguno realizado hace más de 30 años (p. ej., tesis doctoral, monografía) puede no estar registrado en las bases bibliográficas utilizadas o no haber sido citado en las bibliografías de los demás trabajos. Además, hay testimonios acerca de la no difusión pública de algunos estudios realizados o encargados hace años por organismos públicos y privados.
A pesar de que la vigilancia epidemiológica de los CTP es competencia de las administraciones públicas, la mayoría de los estudios fueron realizados por grupos de investigación. Mas la investigación sobre los efectos de los CTP mediante estudios ad hoc, necesariamente parciales y en grupos de población especiales, no puede ser un sustituto de los programas de vigilancia sobre las concentraciones de CTP, que deben tener la máxima cobertura poblacional y regularidad temporal posibles5,94. Afortunadamente, diversas autoridades sanitarias y ambientales españolas están impulsando programas de vigilancia que permitirán conocer de forma técnicamente rigurosa las concentraciones de CTP en la población general, observar las tendencias en el tiempo, analizar las desigualdades sociales y geográficas, y en su día empezar a evaluar la eficiencia de las medidas encaminadas a disminuir las exposiciones5. Cabe decir que los estudios de seguimiento de la contaminación química en seres humanos, basados en muestras representativas de la población, son todavía poco frecuentes en el mundo94. Sin embargo, la legislación ya existente ha sido reforzada en fechas recientes por el Plan Nacional de Aplicación del Convenio de Estocolmo sobre contaminantes orgánicos persistentes. Este tratado internacional, en vigor en España desde el 26 de agosto de 2004, incentiva la realización de programas de biovigilancia sobre CTP en la población general20,95. Tales programas permitirán mejorar la capacidad de: a) observar variaciones espacio-temporales y desigualdades sociales en las concentraciones; b) identificar grupos expuestos a niveles superiores al resto de la sociedad; c) evaluar las medidas de eliminación y control adoptadas por administraciones, empresas y otras organizaciones, y d) contribuir a controlar el impacto en la salud humana de los compuestos. Así pues, es necesario que los gobiernos central y autonómicos, en colaboración con las instituciones sociales y académicas, impulsen programas de vigilancia y biomonitorización para poder valorar la exposición de la población general a los CTP94. Para ello, son una referencia los programas emprendidos en Alemania96-99, Bélgica100-102, Suecia3,10,103,104, Nueva Zelanda105,106 y Estados Unidos107-110.
Con la información disponible en España hasta la fecha, es difícil valorar cuantitativamente en qué medida ciertos factores, como la edad, la dieta, la ocupación o el lugar de residencia, explican la variabilidad interindividual en los valores de CTP10,67,104. Aunque necesaria, dicha valoración supera el ámbito del presente trabajo. Tampoco consideramos factible incluir entre los objetivos la realización de una comparación de los valores observados en España con los hallados en otros países durante las últimas décadas. Estas comparaciones deberán ser objeto de otros trabajos; el nuestro podría ser, simplemente, un referente interno para los investigadores y autoridades españolas.
Asimismo, hay otras cuestiones técnicamente complejas y socialmente relevantes, en las que sería deseable la implicación de los profesionales de la salud. Así, por ejemplo, una observación consistentemente efectuada en estudios en todo el mundo, aunque de causas poco conocidas, es que las concentraciones de β-HCH son a menudo claramente superiores a las de γ-HCH. Todos los estudios sobre HCH identificados en esta revisión (resumidos en la tabla 3b) que estudiaron a la vez β-HCH y γ-HCH hallaron valores superiores del isómero β que del γ. Otro fenómeno común, de causas poco claras y que también implica al β-HCH, es la alta correlación de las concentraciones corporales de dicho compuesto y del HCB111. Analizar las causas y las consecuencias de la habitual presencia en humanos de mezclas de CTP es otra de las tareas necesarias43,44,92.
La revisión comprobó que hasta la fecha, en España, sólo se ha efectuado un estudio basado en una muestra representativa de la población general: en la Comunidad Autónoma de las Islas Canarias se determinaron CTP en muestras de sangre que habían sido obtenidas anteriormente con motivo de una encuesta poblacional de nutrición48,49. Todos los demás estudios determinaron las concentraciones en una población institucionalizada, en poblaciones más expuestas a CTP por razones laborales o residenciales, en pacientes sometidos a intervenciones quirúrgicas o en voluntarios. La información obtenida a partir de estas muestras no es extrapolable a otros conjuntos de población. Por tanto, en la actualidad no hay una «fotografía» representativa de los valores de CTP en humanos en España. Tampoco se dispone de datos con la suficiente validez y cobertura geográficas para valorar la evolución temporal de las concentraciones durante las últimas décadas, en particular desde que –presumiblemente hacia finales de los años cincuenta– los CTP empezaron a contaminar de forma amplia la cadena alimentaria. A pesar de las dificultades para evaluar la variación temporal de las cifras, los datos apuntan ciertas tendencias a la disminución de las concentraciones corporales de algunos CTP. No obstante, es patente que la magnitud real de la contaminación humana por CTP y sus tendencias a lo largo del territorio español, así como su diversidad geográfica y social, siguen siendo profundamente desconocidas. Un análisis particularmente relevante es estimar la distribución poblacional de las concentraciones de CTP en las distintas cohortes de españoles nacidos antes y después de mediados del siglo xx5,45.
Finalmente, un proceso especialmente necesitado de aportaciones desde la medicina y la salud pública es valorar la significación clínica y sanitaria (individual y colectiva) de las distribuciones poblacionales de CTP4,5,12,43,112. Los resultados de tales análisis deberían ser referentes fundamentales en otros debates de índole económica y cultural. Es evidente que los CTP están profundamente enraizados en las sociedades contemporáneas, y que varios de ellos han cumplido funciones sociales positivas; sin embargo, también lo es que no hay sustancias ni tecnologías libres de inconvenientes. Conocer las concentraciones de CTP en humanos es uno de los principales requisitos para saber qué parte de la carga de enfermedad contribuyen a causar.
Este trabajo fue financiado parcialmente mediante una ayuda del Centro Nacional de Sanidad Ambiental (Instituto de Salud Carlos III) y del Ministerio de Medio Ambiente (Proyectos EG042007 y SEG1251/07). Su realización fue asimismo posible gracias al apoyo de la Red Temática de Investigación Cooperativa de Centros en Epidemiología y Salud Pública (C03/09), del CIBER de Epidemiología y Salud Pública (Instituto de Salud Carlos III); de la Oficina de Ciencia y Tecnología de la Generalitat Valenciana (Grupos 03/136); de la Dirección General de Salud Pública de la Generalitat de Cataluña, y de la Agencia de Salud Pública de Barcelona. Los autores agradecen también la colaboración científica y técnica de Tomas López, José Pumarega y Silvia Geeraerd.