Estimar el valor del número de reproducción básico durante la onda pandémica de gripe A(H1N1)2009 en España y evaluar su impacto en la mortalidad de la población española, en comparación con el de las temporadas de gripe estacional previas.
MétodosLos datos sobre la incidencia de gripe y las detecciones de virus se han obtenido del Sistema de Vigilancia de Gripe en España. Las defunciones por el virus pandémico se obtuvieron del Registro de casos graves y defunciones del Centro de Coordinación de Alertas y Emergencias del Ministerio de Sanidad y Política Social, y las producidas por la gripe estacional, durante el periodo 2003-2008, del Registro de Mortalidad del Instituto Nacional de Estadística. El número de reproducción se estimó por dos métodos: el primero utilizando la tasa de crecimiento de la incidencia acumulada de gripe durante la fase de crecimiento exponencial de la onda pandémica, y el segundo (estimación de máxima verosimilitud) mediante el análisis de las fechas de inicio de los síntomas observadas en pares de casos en función de la distribución del tiempo de generación. Se calcularon la tasa de letalidad y de mortalidad por gripe, comparando los años potenciales de vida perdidos de la temporada pandémica con anteriores temporadas interpandémicas.
ResultadosEl inicio de la onda pandémica en España se produjo precozmente en la semana 40/2009 (del 4 al 10 de octubre), con un absoluto predominio de la nueva cepa en el patrón de virus circulantes. El valor de R0 en la fase de crecimiento de la onda fue de 1,29 (IC95%: 1,25-1,33) estimado con el primer método, y de 1,01 (IC95%: 0,99-1,03) con el segundo método. Durante la temporada pandémica se registraron 318 defunciones por gripe, afectando a grupos de edad más jóvenes que en temporadas interpandémicas anteriores. Ello ha supuesto que el número de años potenciales de vida perdidos en la temporada pandémica (11.612) se estime en seis veces el promedio anual ajustado de las temporadas interpandémicas de comparación (1.802).
ConclusionesLos valores estimados de R0 durante la fase de crecimiento de la onda pandémica se encuentran en el rango inferior de estimaciones de ese parámetro en pandemias anteriores. Los indicadores de mortalidad calculados en el periodo pandémico señalan un aumento de las defunciones, en comparación con temporadas interpándemicas previas, más acusado en edades jóvenes.
To estimate the value of the basic reproduction number for the pandemic wave of influenza A (H1N1) 2009 in Spain and to assess its impact on morbidity and mortality in the Spanish population compared with those in the previous influenza season.
MethodsData on the incidence of influenza and viral detections were obtained from the Spanish Influenza Surveillance System. Deaths from pandemic influenza were obtained from the Coordinating Center for Health Alerts and Emergencies of the Spanish Ministry of Health and Social Policy, and deaths from seasonal influenza during the period 2003-2008 were obtained from the National Statistics Institute. The reproduction number was estimated by two methods: firstly, by using the growth rate of the cumulative incidence of influenza during the exponential growth phase of the pandemic wave, and secondly (maximum likelihood estimation), through analysis the dates of onset of symptoms observed in pairs of cases based on generation time distribution. We calculated the fatality rate and mortality from influenza by comparing potential years of life lost in the pandemic season with those in previous interpandemic seasons.
ResultsThe start of the pandemic wave occurred in Spain earlier in week 40/2009 (from 4 to 10 October), with an absolute predominance of the new strain in the pattern of circulating viruses. The value of R0 in the growth phase of the wave was 1.29 (95% CI: 1.25-1.33), estimated with the first method, and was 1.01 (95% CI: 0.99-1.03) with the second method. During the pandemic season, there were 318 deaths from pandemic influenza, affecting younger age groups than in previous interpandemic seasons. Consequently, the number of potential years of life lost in the pandemic season (11,612) was estimated at six times the adjusted annual average of the interpandemic influenza seasons for comparison (1,802).
ConclusionsThe estimates of R0 for the growth phase of the pandemic wave were in the lower range of estimates of this parameter in previous pandemics. Mortality indicators calculated in the pandemic period showed an increase in deaths compared with previous interpandemic seasons, which was most pronounced in young patients.
La aparición de casos de infección humana por un nuevo virus de la gripe A(H1N1)2009 en abril de 2009, en México y Estados Unidos1, junto a la comprobación de su transmisión interhumana, llevó a la Organización Mundial de la Salud (OMS) a elevar a fase 6 el nivel de alerta pandémico el 11 de junio, como respuesta a una transmisión mantenida del mismo virus en dos de las regiones mundiales2. El primer caso confirmado en España fue declarado el 27 de abril en un viajero procedente de México3, experimentando posteriormente, como la mayoría de países del hemisferio Norte, una circulación del virus durante el verano de 2009, fuera del periodo habitual de actividad gripal, que evolucionó de forma creciente hasta la presentación, a principios del otoño de 2009, de una destacada onda pandémica en nuestro territorio.
La tasa de crecimiento de una epidemia viene determinada fundamentalmente por dos factores: el número de nuevas personas infectadas por cada caso (número de reproducción) y el periodo de tiempo desde el comienzo del estado de infeccioso en una persona hasta el comienzo de ese mismo estado en los casos secundarios producidos por la primera persona (tiempo de generación)4. Desde un punto de vista teórico, el primer factor es a su vez el producto de cuatro términos: el riesgo de transmisión en un único contacto entre una persona infecciosa y otra susceptible, la frecuencia de esos contactos en la población, la duración del periodo de infecciosidad y la proporción de población susceptible5. Con la aparición de un nuevo microorganismo, como el virus de la gripe A(H1N1)2009, se considera que al principio toda la población es susceptible, y el factor anterior es conocido como «número básico de reproducción» (R0). La estimación de este número es de gran interés porque permite determinar el potencial de diseminación de una epidemia y conocer la intensidad de los esfuerzos a aplicar en su control6. Valores de este parámetro inferiores a 1 indicarían que hay un progresivo declive de la infección, mientras que con valores superiores a 1 sería probable su difusión epidémica5,6. Desde la aparición de casos humanos de infección por el nuevo virus se han dedicado muchas investigaciones al cálculo de este indicador epidemiológico, en diferentes ámbitos y países7–12, y su comparación con los valores obtenidos en pandemias previas o en situaciones de ondas estacionales interpándemicas ha permitido valorar la intensidad de la propagación de la actual pandemia por gripe A(H1N1)200913.
Junto a la evaluación de la intensidad de la transmisión, es importante valorar también la gravedad de la pandemia desde un punto de vista poblacional, que a su vez es el resultado de la patogenicidad del nuevo virus y de la tasa de ataque clínica, entre otras variables. Desde un principio, la gravedad de la enfermedad causada por el virus pandémico fue calificada de moderada14,15, con tasas de hospitalización y letalidad bajas, similares a las vistas en situaciones de epidemias estacionales interpandémicas16,17, si bien se ha observado que un alto porcentaje de las defunciones confirmadas por el nuevo virus se ha dado en personas más jóvenes que con la gripe estacional18.
Los objetivos de este trabajo fueron estimar el valor del número básico de reproducción durante la onda pandémica en el territorio sujeto a vigilancia en España, y evaluar el impacto de la nueva gripe en la mortalidad de la población española, en comparación con el de las temporadas de gripe estacional previas.
Material y métodosLos datos sobre incidencia de la gripe en el periodo estudiado se obtuvieron del Sistema de Vigilancia de la Gripe en España (SVGE), que está coordinado por el Centro Nacional de Epidemiología (CNE) y el Centro Nacional de Referencia de Gripe (Centro Nacional de Gripe de la OMS del Centro Nacional de Microbiología de Majadahonda), y está formado por una serie de redes autonómicas de médicos de familia y pediatras centinela voluntarios, así como por un conjunto de laboratorios de microbiología con capacidad para detectar el virus de la gripe. A comienzos de la temporada 2009-2010 participaban en el sistema 850 médicos centinela, con una población vigilada de 1.131.012 habitantes, aproximadamente un 2,5% de la población correspondiente a las 17 comunidades autónomas con redes centinela de vigilancia de gripe (todas a excepción de Galicia y Murcia, donde sólo se lleva a cabo una vigilancia virológica). Los médicos centinela notifican semanalmente, de forma individualizada, los casos de gripe detectados en sus poblaciones de referencia, siguiendo una definición de caso homogénea propuesta por la Unión Europea19 que comprende la aparición súbita de los síntomas y al menos uno de los siguientes cuatro síntomas generales: fiebre o febrícula, malestar general, cefalea, mialgia; y al menos uno de los siguientes tres síntomas respiratorios: tos, dolor de garganta, disnea; junto a la ausencia de otra sospecha diagnóstica. La información individualizada de los casos de gripe notificados incluye habitualmente datos demográficos, datos clínicos y de laboratorio, y estado de vacunación de los casos diagnosticados de gripe, pero en la temporada pandémica se añadió una recogida más detallada de síntomas y signos clínicos, así como de la presencia de enfermedades crónicas subyacentes y embarazo.
A partir de esta base de datos individualizada se calcularon las tasas de incidencia de gripe semanales y acumuladas por periodos, utilizando como denominador la población sujeta a vigilancia. Para el cálculo de lo que se denomina número de casos estimados confirmados de gripe pandémica, las anteriores tasas de incidencia por grupos de edad se corrigieron por las tasas de detección del virus A(H1N1)2009 y se aplicaron al conjunto de la población española para esos mismos grupos de edad.
Por otra parte, la disponibilidad de la fecha de notificación de los casos y de la fecha de inicio de los síntomas, recogida dentro del apartado de datos clínicos, permitió estimar el retraso de notificación (tiempo transcurrido entre la fecha del inicio de los síntomas y la fecha de notificación) mediante el ajuste de una distribución gamma a los datos individualizados observados. Esta distribución se usó para imputar la fecha de inicio de los síntomas a todos los casos notificados de gripe, cuando sólo se disponía de la fecha de notificación.
El número de reproducción básico se estimó en primer lugar (método 1) usando la tasa de crecimiento de la incidencia acumulada (r) durante la fase de crecimiento exponencial de la onda epidémica (calculada como la pendiente de la recta ajustada al logaritmo natural del número acumulado de casos en esa fase)20,21 y el denominado «tiempo de generación» (T). Este último parámetro sólo puede inferirse de otras observaciones y se refiere al intervalo entre el comienzo de la capacidad de infectar de un caso y ese comienzo en un caso secundario derivado del anterior22; es equivalente al «intervalo de serie medio», el tiempo directamente observable entre las fechas de inicio de los síntomas de un caso primario y uno secundario derivado del primero23. La ecuación lineal que relaciona el número reproductivo básico con la tasa de crecimiento (r) y el tiempo de generación (T) puede expresarse como5: R=1+rT. La determinación de la fase de crecimiento exponencial de la onda epidémica se realizó seleccionando el modelo con el mejor ajuste según el coeficiente de determinación (R2).
Como segundo método de estimación del número reproductivo se usó un procedimiento descrito por Wallinga y Teunis24 (método 2), mediante el cual se calcula un estimador de máxima verosimilitud del parámetro, a través del análisis de las fechas de inicio de los síntomas observadas en pares de casos, estimando la probabilidad de que un caso infecte a otro por la diferencia de tiempo en la aparición de síntomas de esos casos en función de la distribución del tiempo de generación.
Para ambos métodos se usaron estimaciones del intervalo de serie medio publicadas con datos de Reino Unido25 y de España26.
Las defunciones por el virus pandémico durante la temporada pandémica completa 2009-2010 se obtuvieron del Registro de casos graves y defunciones del Centro de Coordinación de Alertas y Emergencias del Ministerio de Sanidad y Política Social, y las debidas a la gripe estacional (CIE-10: J09-J11), durante el periodo 2003-2008, del Registro de Mortalidad del Instituto Nacional de Estadística (INE). La letalidad del virus pandémico en la última temporada se calculó utilizando el número de casos estimados de gripe pandémica como denominador, mientras que para las tasas de mortalidad, tanto de gripe estacional como pandémica, se usaron las proyecciones de población del INE. En ambos casos se obtuvieron estimaciones puntuales y de intervalo de las tasas, asumiendo una distribución de Poisson. Para una cuantificación más sensible de la mortalidad precoz se calcularon los años potenciales de vida perdidos27,28 en cada temporada como la esperanza de vida a la edad del fallecimiento (utilizando para este último indicador las estimaciones del año 2008 en la población española del INE). Se utilizó un método directo de ajuste para comparar las defunciones por gripe y los años potenciales de vida perdidos de la temporada pandémica con las temporadas interpándemicas.
Los programas estadísticos utilizados para el análisis de los datos fueron Stata v11.1 y R v2.9.1.
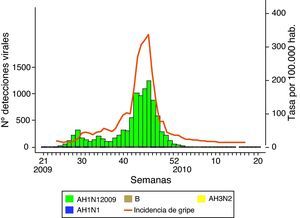
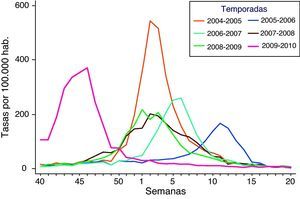
ResultadosEn la figura 1 se muestra la incidencia semanal (tasas por 100.000 habitantes) de gripe notificada al SVGE, junto al número de detecciones de virus de la gripe, atendiendo al subtipo identificado, desde la aparición de la cepa pandémica a finales de abril de 2009 hasta el final de la onda pandémica. Durante todo el verano, periodo de muy baja actividad gripal en temporadas interpandémicas en nuestro país, se notificaron casos y brotes por el virus A(H1N1)2009, especialmente asociados a instituciones juveniles, y se considera que el inicio de la onda pandémica se produjo en la semana 40/2009 (del 4 al 10 de octubre), periodo en el que los valores de la tasa global de incidencia de gripe y de la tasa de detección viral (porcentaje de muestras analizadas positivas a virus de la gripe) sobrepasaron los umbrales de esos indicadores considerados basales. Dos hechos llamaron la atención en comparación con temporadas precedentes: el absoluto predominio de la nueva cepa en el patrón de virus circulantes (figura 1), y el inicio precoz de la onda epidémica (ver figura 2).
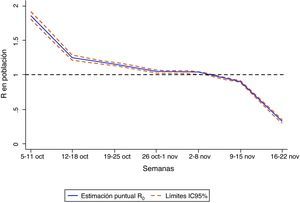
Durante siete semanas (4 de octubre al 22 de noviembre de 2009) se constató una fase de crecimiento en la onda pandémica y el valor de R0 estimado en ese periodo con el método 1 fue de 1,29 (intervalo de confianza del 95% [IC95%]: 1,25–1,33), con un tiempo de generación asumido de 2,9 días. Si se considera como estimador de ese tiempo el intervalo de serie medio descrito para la pandemia en España (3,5 días), el valor de R0 se situaría en 1,35 (IC95%: 1,31–1,40). Un valor más bajo de ese número de reproducción se obtiene con el método 2, que aplicado al mismo periodo de ascenso nos proporciona un valor no significativamente diferente de 1 (R=1,01; IC95%: 0,99–1,03), lo cual indicaría el bajo nivel de difusión de la enfermedad. De hecho, la estimación semanal de R0 con este segundo método (figura 3) sólo indicaría valores significativamente superiores a 1 en las primeras cuatro semanas del periodo, cayendo posteriormente a cifras inferiores a 1, indicativas del declive de la difusión de la enfermedad. En ambos métodos se trabajó con la base de datos individualizada que permitió imputar la fecha de inicio de los síntomas, a partir de la fecha de notificación disponible en todos los casos. En el 57% de los 15.846 casos incluidos en el análisis se desconocía la fecha de inicio de los síntomas.
Ciñéndonos al periodo de crecimiento de la onda pandémica que mejor se ajustaba al modelo exponencial, la estimación de R0 en el conjunto del territorio vigilado por el método 1 asciende a 1,32 (IC95%: 1,29-1,36), asumiendo un tiempo de generación de 2,9 días y discriminando el intervalo de tiempo 14 de octubre-4 de noviembre como el periodo de ajuste exponencial con mayor coeficiente de determinación. Similar procedimiento se hizo con cada una de las redes centinela, valorando en sus curvas epidémicas el periodo de mejor ajuste al modelo exponencial, y los valores obtenidos de R0 (tabla 1) se encontraron en el rango 1,15-1,61, abarcando un periodo de tiempo más extenso (4 de octubre-21 de noviembre) el conjunto de las fases de crecimiento exponencial de las curvas.
Valores puntuales y de intervalo de R0 en las comunidades autónomas. Fuente: Redes Centinelas españolas
| Comunidad Autónoma | Periodo de mejor ajuste a la fase de crecimiento de la onda epidémica | R0a (IC95%) |
| Andalucía | 20/10/2009 – 10/11/2009 | 1,18 (1,17–1,19) |
| Aragón | 14/10/2009 – 04/11/2009 | 1,42 (1,40–1,45) |
| Asturias | 20/10/2009 – 10/11/2009 | 1,18 (1,17–1,20) |
| Baleares | 20/10/2009 – 10/11/2009 | 1,20 (1,19–1,22) |
| Canarias | 18/10/2009 – 08/11/2009 | 1,29 (1,26–1,31) |
| Cantabria | 14/10/2009 – 04/11/2009 | 1,29 (1,26–1,32) |
| Castilla-La Mancha | 13/10/2009 – 03/11/2009 | 1,42 (1,40–1,45) |
| Castilla y León | 10/10/2009 – 31/10/2009 | 1,40 (1,36–1,45) |
| Cataluña | 13/10/2009 – 03/11/2009 | 1,42 (1,40–1,45) |
| Comunidad Valenciana | 18/10/2009 – 10/11/2009 | 1,27 (1,26–1,28) |
| Extremadura | 20/10/2009 – 10/11/2009 | 1,17 (1,16–1,18) |
| Madrid | 05/10/2009 – 28/10/2009 | 1,61 (1,54–1,69) |
| Navarra | 18/10/2009 – 08/11/2009 | 1,36 (1,34–1,37) |
| País Vasco | 05/10/2009 – 26/10/2009 | 1,60 (1,50–1,70) |
| La Rioja | 10/10/2009 – 31/10/2009 | 1,40 (1,37–1,40) |
| Ceuta | 26/10/2009 – 16/11/2009 | 1,46 (1,40–1,53) |
| Melilla | 18/10/2009 – 10/11/2009 | 1,15 (1,14–1,15) |
IC95%: intervalo de confianza del 95%.
De cara a la evaluación de la gravedad de la onda pandémica, en la tabla 2 se exponen las defunciones notificadas por gripe A(H1N1)2009 confirmada durante la temporada pandémica, por grupos de edad, así como el número estimado de casos de esta nueva gripe. Entre los meses de mayo de 2009 y abril de 2010 se registraron 318 defunciones, lo que ha permitido estimar una tasa de letalidad global de 0,43 defunciones por 1.000 casos (IC95%:0,38-0,48). La menor tasa de letalidad se observó en el grupo de 5-14 años (0,05 por 1.000; IC95%:0,03-0,09), grupo con la mayor incidencia estimada de gripe confirmada por el virus pandémico, mientras que la mayor tasa de letalidad se registró en los mayores de 64 años, con cuatro defunciones por 1.000 casos (IC95%:3,10-5,09).
Casos estimados confirmados de gripe pandémica por grupos de edad. Mortalidad y letalidad registrada en España por gripe A(H1N1)2009 durante el periodo pandémico
| Grupo de edad, años | N° casos estimados confirmados de gripe pandémica | N° defunciones | Letalidad, defunciones por 1000 casos confirmados (IC95%) | Mortalidad, defunciones por 1.000.000 habitantes (IC95%) |
| 0-4 | 64.347 | 16 | 0,25 (0,14-0,40) | 6,75 (3,86-10,96) |
| 5-14 | 241.058 | 13 | 0,05 (0,03-0,09) | 3,00 (1,60- 5,13) |
| 15-64 | 422.904 | 223 | 0,53 (0,46-0,60) | 7,27 (6,35- 8,29) |
| > 64 | 16.486 | 66 | 4,00 (3,10-5,09) | 8,55 (6,61-10,88) |
| Total | 744.795 | 318 | 0,43 (0,38-0,48) | 7,05 (6,30- 7,87) |
IC95%: intervalo de confianza del 95%.
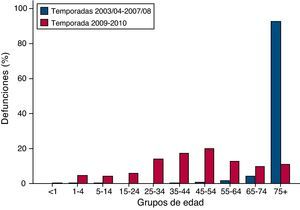
De forma paralela también se presentan en la tabla 2 las tasas de mortalidad por gripe para los mismos grupos de edad. La tasa de mortalidad global se ha estimado en 7,05 por 1.000.000 habitantes (IC95%: 6,30-7,87), no apreciándose diferencias significativas en las tasas de mortalidad por grupos de edad, salvo en el grupo de 5-14 años donde se registró la mínima tasa (3,00; IC95%: 1,60-5,13). Cuando se compara la distribución por edad de las defunciones de la temporada pandémica con anteriores temporadas de gripe estacional (2003-2008), llama la atención su diferente patrón (figura 4). Frente al elevado porcentaje que suponen las defunciones por gripe en los mayores de 60 años en las temporadas de gripe estacional (98%), en la temporada pandémica sólo un 28% de las muertes se registraron en ese grupo de edad.
Distribución porcentual de las defunciones debidas a gripe por grupos de edad. España. Comparación temporadas 2009/2010 y 2003/2008. Fuente: Registro de Mortalidad del Instituto Nacional de Estadística y Centro de Coordinación de Alertas y Emergencias del Ministerio de Sanidad y Política Social.
Por último, en la tabla 3 se comparan el número de defunciones, su edad media y el número de años potenciales de vida perdidos en la temporada pandémica y el promedio anual de las temporadas 2003-2008. Frente al promedio ajustado de 231 defunciones de las temporadas de gripe estacional, en la temporada pandémica se registraron 318 (38% de aumento), con una edad media (46,4 años) sensiblemente inferior a la de las defunciones de las temporadas 2003-2008 (86,1 años). Ello ha supuesto que el número de años potenciales de vida perdidos en la temporada pandémica (11.612) multiplique por más de seis el promedio anual ajustado de las temporadas de comparación (1.802).
Número de defunciones, edad media y años potenciales de vida perdidos por gripe durante la temporada pandémica y en cinco temporadas anteriores a efectos comparativos
| N° defunciones (ajustadas a población de 2009) | Edad media de defunciones, años | Años potenciales de vida perdidos (ajustados a población de 2009) | |
| Pandemia 2009-2010 | 318 | 46,4 | 11.611,6 |
| Media de las temporadas 2003/04 a 2007/08 | 231 | 86,1 | 1.802,3 |
Habitualmente, el número básico de reproducción se calcula al inicio de una pandemia para estimar su posible difusión. En el presente trabajo se calculó en una fase ligeramente avanzada de la pandemia, cuando las medidas informativas y de intervención sanitaria se hallaban en plena aplicación, y ello podría haber redundado en la obtención de valores más bajos que si se hubiera estimado en la fase de diseminación inicial. Así, el valor obtenido de R0 para el conjunto del territorio sujeto a vigilancia durante el periodo de crecimiento exponencial de la onda pandémica (1,32; IC95%: 1,29-1,36) es ligeramente inferior que las primeras determinaciones del parámetro en el brote inicial de México7,8, pero similar a lo reportado por otros estudios realizados en diversas zonas y países10–13. También se han hallado cifras parecidas en situaciones de gripe estacional29, y se encuentran en el rango inferior de estimaciones de R0 realizadas en pandemias anteriores30,31,21, por lo que se confirma que, desde el punto de vista de su transmisibilidad, la pandemia de gripe A(H1N1)2009 en España no difirió de las anteriores pandemias.
Por otra parte, la disminución de la población susceptible desde el comienzo de la transmisión del virus A(H1N1)2009 en España hasta el inicio de la onda pandémica podría haber ocasionado una sobrestimación del valor de R0 obtenido. En este sentido, hubiera sido más adecuado utilizar el número reproductivo efectivo (R=R0 × proporción de susceptibles), pero la falta de estudios serológicos impedía determinar con precisión la tasa de ataque del nuevo virus en la población durante el periodo anterior al estudio, que suponemos que fue baja, como apuntan los datos de incidencia notificada de gripe en ese periodo.
De todas formas, las características de las poblaciones sujetas a vigilancia y las situaciones epidemiológicas estudiadas influyen mucho en los valores del número de reproducción. Pueden hallarse cifras altas cuando se estudian poblaciones infantiles o brotes en instituciones cerradas, tal y como se observó en uno de los primeros estudios realizados en Japón9, al principio de la actual pandemia, en el cual la inclusión de los brotes en las escuelas fue uno de los principales determinantes del elevado valor de R encontrado.
Otras diferencias en las estimaciones de R pueden deberse a la metodología empleada en su cálculo, así como a la distinta procedencia y calidad de los datos manejados. El método 1, de los dos que se han empleado en este trabajo, permite estimar de forma global el valor de R para la fase de expansión de la epidemia, si bien asume implícitamente un crecimiento exponencial que pudiera no ser adecuado. Entre sus ventajas cabe citar no sólo la sencillez de cálculo, sino que las necesidades de información son mínimas, por lo que todavía muchos estudios aplican métodos de este tipo, basados en la tasa de crecimiento de una curva epidémica, para el cálculo de los números reproductivos de forma fiable32. Además, las estimaciones usando estos métodos no suelen estar influidas por la subdeclaración de casos de enfermedad, algo habitual en los sistemas de vigilancia33,34, puesto que la tasa de crecimiento del número acumulado de los casos notificados debería ser prácticamente idéntica a la del verdadero número de casos acumulados en la población, salvo que el grado de notificación cambie con el transcurso del tiempo35. El método 2 no necesita mucha más información que el método anterior para el cálculo del número de reproducción, ya que sólo son necesarias las fechas de inicio de los síntomas de los casos, pero el procedimiento es más complejo y tiene limitaciones derivadas de asumir la independencia de la transmisión entre los casos y el hecho de que las posibles intervenciones que pueden llevarse a cabo no afecten al tiempo de generación36.
La mayoría de los estudios dedicados al análisis del potencial de transmisión de las enfermedades usan datos que provienen de su vigilancia pasiva, y muchas de las limitaciones de esta información34 son aplicables en este contexto. No sólo es habitual la infradeclaración de casos, sino que son frecuentes los sesgos en la información por la inclusión preferencial o deficitaria de determinados tipos de casos, o por la aplicación de nuevas definiciones de caso, como ocurrió esta temporada con la nueva definición de la Unión Europea de caso de gripe19, o por la falta de información en los casos notificados. A este respecto cabe citar el elevado número de casos que omitían la fecha de inicio de los síntomas en la base de datos manejada en nuestro estudio. La imputación de esa fecha, aplicando diferentes tipos de distribución del retraso de notificación, es un procedimiento muy común y aceptado37, pero se trata de correcciones aproximadas que pueden inducir a error.
Las cifras calculadas de letalidad, basadas en estimaciones de las tasas de ataque de esta primera onda pandémica por el virus A(H1N1)2009 como denominadores, seguramente están sobrestimadas. Es difícil determinar la verdadera tasa de ataque de la gripe pandémica, ya que tanto la gripe estacional como la pandémica muestran una amplia variedad de presentaciones clínicas, con una mayoría de infecciones asintomáticas o leves para las que la población no demanda atención médica13,38. Estudios serológicos recientes sugieren tasas de ataque de esta nueva gripe, en su primera onda pandémica, de hasta un 21% en los niños menores de 5 años39 y de hasta un 45% en la población de 10 a 19 años de edad40, mientras que con nuestras estimaciones no sobrepasa el 10% en el grupo de edad más afectado, que fue el de 5 a 14 años de edad. Aun así, si comparamos nuestras cifras de letalidad con las estimadas por otros autores16,17, vemos que son similares.
La falta de datos sobre mortalidad por causas en la población sujeta a vigilancia durante esta última temporada hizo que nos centráramos en caracterizar la gravedad de la pandemia por el virus A(H1N1)2009, comparando las defunciones por el virus pandémico confirmadas con las debidas a la gripe en las temporadas interpandémicas inmediatamente anteriores. Sin embargo, los resultados de estas comparaciones deben interpretarse con mucha cautela. La mortalidad relacionada con la gripe estacional se determina indirectamente, utilizando modelos que estiman el exceso de defunciones globales, o por algunos grupos de causas, observadas en los periodos invernales por encima de un nivel basal de mortalidad esperada en ausencia de circulación de virus de la gripe41,42. Las defunciones atribuidas a la gripe pandémica, sin embargo, no son estimaciones sino defunciones confirmadas producidas por infección por el virus A(H1N1)2009 notificadas a las autoridades sanitarias. Tanto en uno como en otro caso, las cifras infraestiman la carga real de enfermedad atribuible a la gripe18,41,42. Por una parte, el diagnóstico de gripe aparece con escasa frecuencia en el apartado de la causa fundamental de los certificados de defunción. Por otra parte, muchas muertes relacionadas con la infección gripal ocurren por complicaciones secundarias, cuando ya es muy difícil detectar la causa que motivó la descompensación de la enfermedad de base del paciente. En el caso de la gripe pandémica es posible que los datos notificados infraestimen el número real de defunciones por el virus A(H1N1)2009 que se produjeron en España43. Con estas limitaciones y para estimar el impacto global de la gripe en la mortalidad de la población española, comparamos las defunciones debidas a la gripe pandémica con las defunciones exclusivamente debidas a la gripe en las temporadas de gripe estacional, en vez de con las debidas a gripe y neumonía utilizadas habitualmente. En relación con las temporadas anteriores de gripe estacional, se observa una diferencia sustancial en la distribución por edad de las defunciones. Así, mientras que más de un 90% de las muertes por gripe se producen en mayores de 64 años en las temporadas estacionales previas, en el periodo pandémico se invierte esa proporción y un 80% de las muertes son en menores de 65 años. El alto porcentaje de defunciones ocurridas durante el periodo de la onda pandémica a edades más jóvenes apoya el uso de otros indicadores18, como el utilizado en este trabajo (años potenciales de vida perdidos), que resumen de forma más apropiada la mortalidad prematura observada durante la temporada pandémica en España. Desde esa perspectiva, sí podríamos decir que la pandemia tuvo un impacto significativo en la mortalidad de nuestra población.
En cualquier caso, la información aportada en este estudio supone una aproximación a la caracterización de la gravedad de la pandemia por virus A(H1N1)2009 y su comparación con la de temporadas estacionales de gripe. La disponibilidad de la mortalidad por causas en el periodo interpandémico permitirá una comparación más rigurosa de la reciente pandemia con las epidemias de gripe interpandémicas previas.
Contribuciones de autoríaL. Simón y S. de Mateo realizaron las estimaciones de R0. A. Larrauri y S. Jiménez-Jorge analizaron la información epidemiológica y virológica referente a la actividad gripal. L. Simón, S. de Mateo, A. Larrauri y S. Jiménez-Jorge analizaron los indicadores de gravedad. J. Vaqué y S. Pérez-Hoyos participaron en la discusión, la optimización y la interpretación de los modelos matemáticos. S. de Mateo escribió la primera versión del artículo. Todos los autores aportaron ideas, interpretaron los resultados y revisaron los borradores del artículo.
FinanciaciónPrograma de Investigación de la Gripe A(H1N1), Instituto de Salud Carlos III (GR09/0018).
Conflictos de interesesNinguno.
Los autores agradecen la valiosa contribución del Centro de Coordinación de Alertas y Emergencias del Ministerio de Sanidad y Política Social, responsable del Registro de casos graves y defunciones debidas a gripe pandémica, que nos proporcionaron la información necesaria para este trabajo.
Integrantes del SVGE: Médicos y pediatras de las redes centinela de vigilancia de gripe de Andalucía, Aragón, Asturias, Baleares, Canarias, Cantabria, Castilla-La Mancha, Castilla y León, Cataluña, Comunitat Valenciana, Extremadura, Madrid, Navarra, País Vasco, La Rioja, Ceuta y Melilla. Epidemiólogos miembros del SVGE pertenecientes al Servicio de Vigilancia Epidemiológica y Evaluación, Consejería de Salud, Junta de Andalucía; Servicio de Vigilancia en Salud Pública, Dirección General de Salud Pública, Aragón; Dirección General de Salud Pública y Planificación, Consejería de Salud y Servicios Sanitarios, Asturias; Servicio de Epidemiología, Dirección General de Salud Pública, Baleares; Servicio de Epidemiología y Prevención, Consejería de Sanidad de Canarias; Sección de Epidemiología, Consejería de Sanidad, Trabajo y Servicios Sociales de Cantabria; Servicio de Epidemiología, Consejería de Sanidad de Castilla-La Mancha; Dirección General de Salud Pública e Investigación, Desarrollo e Innovación, Consejería de Sanidad de Castilla y León; Servicio de Vigilancia Epidemiológica, DGSP, Departament de Salut, Generalitat de Catalunya; Àrea d’Epidemiologia, Conselleria de Sanitat, Comunitat Valenciana; Servicio de Epidemiología, Consejería de Bienestar Social, Junta de Extremadura; Dirección General de Atención Primaria de la Comunidad de Madrid; Sección de Vigilancia de Enfermedades Transmisibles, Instituto de Salud Pública de Navarra; Servicio de Vigilancia Epidemiológica, Consejería de Sanidad del País Vasco; Servicio de Epidemiología, Subdirección de Salud Pública de La Rioja; Sección de Vigilancia Epidemiológica, Consejería de Sanidad y Bienestar Social de Ceuta; Dirección General de Sanidad y Consumo de Melilla; y Centro Nacional de Epidemiología. Virólogos miembros del SVGE pertenecientes a: Centro Nacional de Referencia de Gripe (Centro Nacional de Gripe de la OMS del Centro Nacional de Microbiología [CNM], Instituto de Salud Carlos III, Majadahonda, Madrid); Hospital Virgen de las Nieves de Granada, Andalucía; Laboratorio del Hospital Miguel Servet de Zaragoza, Aragón; Laboratorio del Hospital Ntra. Sra. de Covadonga de Oviedo, Asturias; Laboratorio del Hospital Son Dureta de Palma de Mallorca, Baleares; Laboratorio del Hospital Dr. Negrín de Las Palmas de Gran Canaria, Canarias; Laboratorio del Hospital Universitario Marqués de Valdecilla de Santander; Centro Nacional de Gripe de la Facultad de Medicina de Valladolid; Instituto Valenciano de Microbiología, Valencia, Comunitat Valenciana; Centro Nacional de Gripe del Hospital Clínico de Barcelona; Hospital San Pedro de Alcántara de Cáceres, Extremadura; Servicio de Microbiología del Hospital Universitario Ramón y Cajal de Madrid, Comunidad de Madrid; Laboratorio de la Clínica Universitaria de Navarra, Pamplona; Laboratorio de Microbiología del Hospital Donostia, País Vasco; Hospital San Pedro de la Rioja de Logroño, La Rioja; Laboratorio de Microbiología del Hospital de INGESA, Ceuta; Laboratorios de Microbiología CH de Vigo y de Ourense (Galicia); y Hospital Virgen de la Arrixaca de Murcia.