Analizar el patrón espacial de la legionelosis en España para hombres y mujeres durante el periodo 2003-2007, e identificar agrupamientos espaciales del riesgo.
MétodosSe identificó el patrón espacial de la distribución de las tasas de legionelosis a partir del cálculo de las tasas por municipio por el método directo. Se realizó el suavizado de estas tasas por el método Empirical Bayes para estudiar el patrón espacial de la enfermedad, para ambos sexos. Se utilizó el índice de correlación espacial de Moran para analizar la autocorrelación global de las tasas. Localmente se utilizó el índice local de Moran (LISA) para analizar los agrupamientos (clusters) de municipios con mayor riesgo.
ResultadosUna vez suavizado el riesgo, las mayores tasas (más de 50 por 100.000 habitantes) se agrupan en las zonas costeras del Mediterráneo oriental y en el norte de la Península, así como en los territorios insulares del Mediterráneo. El índice de Moran de las tasas suavizadas es 0,15 para los hombres y 0,23 para las mujeres. Las agrupaciones espaciales de las tasas más altas estadísticamente significativas calculadas mediante el LISA se distribuyen en el eje norte-levante para ambos sexos.
ConclusionesEstos métodos de análisis espacial permiten identificar los patrones de distribución de la enfermedad. Los métodos empleados presentan resultados similares. Estas técnicas son una herramienta complementaria para la vigilancia epidemiológica de las enfermedades infecciosas.
To analyze the spatial pattern of legionellosis in Spain for men and women during the period 2003-2007 and to identify spatial clustering of risk.
MethodsWe identified the spatial pattern of the distribution of legionellosis rates based on calculation of rates by municipality through the direct method. Smoothing of these rates was performed by the Empirical Bayes method for studying the spatial pattern of disease for both sexes. We used Moran¿s index to analyze spatial autocorrelation rates globally. To calculate local rates, the Local Moran's Index [known as local indicators of spatial association (LISA)], was used to analyze the clusters of municipalities with the highest risk.
ResultsAfter smoothing the risk, the highest rates (over 50 per 100,000 inhabitants) were grouped in the eastern Mediterranean coastal areas and the north of the mainland, as well as in the Mediterranean islands. Moran's index smoothed rates were 0.15 for men and 0.23 for women. The spatial clusters of statistically significant higher rates calculated by the LISA index were distributed in the north and east for both sexes.
ConclusionsThese methods of spatial analysis allow patterns of disease distribution to be identified. All the methods used yielded similar results. These techniques are a complementary tool for epidemiological surveillance of infectious diseases.
La legionelosis fue identificada por primera vez en 1976, tras el estudio de un brote de neumonía en Filadelfia1. Desde entonces se ha avanzado mucho en el estudio de la enfermedad, y se ha constatado un aumento de su incidencia en los países desarrollados, atribuido en gran parte a la introducción de pruebas rápidas para el diagnóstico, como la prueba de detección del antígeno de este microorganismo en la orina2.
La enfermedad está causada por Legionella, una bacteria que se encuentra en ambientes acuáticos naturales y artificiales, desde donde pasa a colonizar los sistemas de abastecimiento de agua de las ciudades y, a través de la red de distribución, se incorpora a las instalaciones de agua doméstica o a aquellos equipamientos que requieren agua para su funcionamiento, como los sistemas de refrigeración3, entre otros.
El modo de transmisión es por vía aérea. Los hombres padecen más la enfermedad que las mujeres, y el grupo más afectado es el de 50 a 59 años de edad. La enfermedad puede ser mortal hasta en el 10% de los casos3,4.
La legionelosis es una enfermedad de declaración obligatoria en España desde el año 19955. España está entre los países de la Unión Europea con una incidencia más alta. En 2005 y 2006 se registraron tasas de incidencia de 2,84 y de 3 casos por 100.000 habitantes, respectivamente. La incidencia media europea se situaba en 2006 en 1,12 casos por 100.000 habitantes4.
Las tasas de incidencia en España se han mantenido estables desde el año 2002, aunque con algunos repuntes anuales. La distribución espacial de la enfermedad no es homogénea en el territorio, con grandes diferencias en la incidencia entre las comunidades autónomas2.
El objetivo de este estudio es describir un método de análisis para establecer el patrón de la distribución espacial de la legionelosis en España, para ambos sexos, durante el periodo 2003-2007, e identificar agrupamientos espaciales del riesgo.
Material y métodosÉste es un estudio ecológico retrospectivo de casos confirmados de legionelosis en España durante un periodo de 5 años (de 2003 a 2007).
CasosLos datos de legionelosis se obtuvieron del Centro Nacional de Epidemiología, procedentes de la declaración individualizada de casos declarados (RENAVE) durante los años 2003 a 2007. Se consideraron los casos comunitarios no asociados a viajes y cuyo lugar de residencia fuera el mismo que el de la infección (casos esporádicos no asociados a viajes). No se incluyeron en el estudio aquellos casos en que las variables municipio, sexo, edad o fecha de inicio de los síntomas faltaban o estaban mal codificadas. Los casos se agregaron a nivel municipal.
PoblaciónSe utilizó la población del padrón de 2005 del Instituto Nacional de Estadística estratificada por sexo y cuatro grupos de edad (0-14,15-45, 45-65 y más de 65 años), por municipios.
Análisis espacial1) Suavizado de tasasLos casos se geocodificaron según el municipio de residencia y se agregaron por sexo. Las tasas de incidencia para cada sexo se estandarizaron ajustándolas por la edad aplicando el método directo. Como población estándar se utilizó la del padrón de 2005 para toda España.
Para reducir la variabilidad de las áreas pequeñas (municipios con poca población y pocos casos, con tasas muy elevadas) se utilizó el enfoque Empirical Bayes (EB), para suavizar el riesgo local6. Este suavizado del riesgo local se realiza para obtener estimaciones más fiables del patrón de riesgo de la enfermedad que el que proporciona la tasa cruda. Las tasas crudas, cuando analizamos áreas pequeñas, como municipios, producen una imagen distorsionada por la inestabilidad y la variabilidad de dichas tasas7–9. Este enfoque EB es una estimación estadística basada en los datos observados y en el conocimiento a priori de los parámetros de interés6. El grado de suavizado refleja el nivel de confianza en el riesgo local observado en función de la población y de la variabilidad de las tasas de incidencia.
La magnitud del ajuste aumenta cuando la población disminuye. En áreas con poca población (es decir, con tasas inestables), las tasas de incidencia observadas se reducen de acuerdo con la media de las tasas de incidencia observadas en las áreas vecinas, teniendo como resultado la tasa de incidencia estimada. En las áreas con poblaciones grandes, la confianza en la tasa de incidencia observada es mayor, y la tasa de incidencia estimada será similar a la tasa observada6,10.
La tasa de incidencia estimada refleja mejor el verdadero riesgo de un área, ya que elimina el efecto que produce el que haya altas tasas observadas debidas a unos pocos casos en una población pequeña y su variabilidad6.
Para calcular la contigüidad espacial de los municipios se calculó la matriz de pesos Queen de primer orden11,12, en la cual se consideran vecinas de un área i todas aquellas áreas que comparten un lado o un vértice con el área i.
2) Análisis de riesgo globalUna vez ajustadas las tasas de incidencia por el método EB, se calculó el índice I de Moran para medir la autocorrelación espacial entre las tasas de incidencia en los diferentes municipios. Este índice se basa en el cálculo de los productos cruzados13. La agrupación de valores próximos dará como resultado unos productos que tenderán a ser positivos, mientras que en un modelo de alternancias los productos tenderán a ser negativos.
El índice de Moran puede tomar valores positivos y negativos dependiendo del signo de la correlación espacial, de tal forma que si la correlación es positiva obtendremos valores positivos, y viceversa, si la correlación espacial es negativa obtendremos valores negativos. Este estadístico, bajo la hipótesis de independencia de las observaciones sobre la superficie, tiene una distribución asintótica normal y un primer orden definido por las fronteras comunes de los municipios. Resulta muy útil para caracterizar la región de estudio. Proporciona un valor único para cada conjunto de datos. Se construye un test que permite medir la significación estadística de la autocorrelación espacial. Este índice se interpreta de forma similar al coeficiente de correlación r en una correlación lineal. Los valores cercanos a 0 indican que no hay correlación espacial y que la distribución de la ocurrencia de la enfermedad se debe al azar. Los valores cercanos a 1 y –1 indican una fuerte autocorrelación espacial y que hay una dependencia espacial en la ocurrencia de la enfermedad, esto es, un área está correlacionada con lo que ocurre en las áreas vecinas, y la ocurrencia de la enfermedad no se debe al azar. Una autocorrelación positiva significa que los valores encontrados en una zona son similares a los de las zonas adyacentes, mientras que la autocorrelación negativa significa que una zona tiene una alta tasa de incidencia y las zonas adyacentes tienen bajas tasas de incidencia, o que una zona tiene una baja tasa de incidencia y en las zonas adyacentes se observan altas tasas de incidencia, en comparación con el promedio de la región.
3) Análisis del riesgo localSin embargo, cuando tenemos un gran número de áreas, como es nuestro caso, es posible que haya diferencias en la asociación espacial. Para hacer frente a esas diferencias espaciales se utilizó el índice I local de Moran, conocido como el índice local de autocorrelación espacial (LISA)14. El LISA indica la presencia de dependencia espacial (clusters) en algunas áreas, es decir, las zonas donde las tasas de incidencia se correlacionan significativamente (p<0,05) con las tasas de incidencia de sus vecinos. Los municipios fueron clasificados y asignados en cuatro clases de acuerdo con la autocorrelación: alta-alta (zonas con una alta tasa rodeadas de otras con una tasa alta), baja-baja (zonas con una baja tasa rodeadas de otras con una tasa baja), baja-alta (zonas con una tasa baja rodeadas de otras con una alta tasa) y alta-baja (el inverso de baja-alta). El valor p para ambas pruebas se calcula utilizando el test de permutaciones de Monte Carlo.
Los análisis se realizaron con el programa estadístico R (Free Software Fundation's GNU General Public License, Boston) y el programa de análisis exploratorio de datos espaciales Geoda 0.9.5i, y los mapas resultantes con Arcgis 9.3. (Esri 2009).
ResultadosCasosEn el análisis de los datos se incluyeron los 8112 municipios de España. En total se registraron 4327, de los cuales el 78% eran hombres y el 22% mujeres, y el 80% tenían más de 45 años de edad en los 5 años estudiados.
Las tasas de incidencia para todo el periodo estudiado son más altas en los hombres que en las mujeres: 4,02 y 0,70 por 100.000 habitantes, respectivamente. Además, son más altas en los mayores de 45 años. La tasa de incidencia más alta por grupos de edad y sexo es de 10 por 100.000 habitantes para hombres de 45 a 65 años, y la más baja para mujeres menores de 15 años, con 0,008 por 100.000 habitantes.
Las tasas anuales globales tienen una tendencia ascendente, con picos bianuales, y la más alta fue 2,28 en 2007.
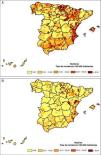
Análisis espacial1) Suavizado de tasasLas tasas de incidencia ajustadas por edad y municipio, suavizadas mediante el método EB, muestran el patrón espacial de la legionelosis en España tanto para hombres como para mujeres en los 5 años estudiados. Una vez suavizadas, las mayores tasas (mas de 50 por 100.000 habitantes) se encuentran en las zonas costeras del Mediterráneo oriental y del norte de la Península, así como en los territorios insulares del Mediterráneo, y de forma dispersa aparecen algunos municipios interiores y del sur. La figura 1A muestra el mapa de tasas medias de incidencia por 100.000 habitantes, ajustadas por edad y suavizadas mediante el método EB para hombres durante el periodo estudiado; se observa un patrón de riesgo que se concentra en la parte norte y hacia el este de la Península siguiendo un eje norte-este. La figura 1B muestra el mapa de las tasas medias de incidencia por 100.000 habitantes para el periodo estudiado, ajustadas por edad y suavizadas mediante el método EB para mujeres, y se observa un riesgo mayor en la zona de la costa mediterránea, así como en las Islas Baleares y en la parte nororiental de la Península. Las tasas de incidencia suavizadas para mujeres se distribuyen en áreas más concentradas y de menor extensión geográfica que las de los hombres, agrupando un menor número de municipios.
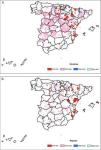
2) Análisis global y localEl índice de Moran de las tasas suavizadas fue de 0,15 para los hombres y de 0,23 para las mujeres, en ambos casos significativo (p<0,05). Las figura 2A y B muestran aquellas agrupaciones de alta y baja incidencia calculadas mediante el LISA que son significativas (p<0,05) tanto para los hombres como para las mujeres. Las agrupaciones espaciales de las tasas más altas se distribuyen en el eje norte-este para ambos casos. En el mapa de las mujeres aparece una agrupación de tasas altas en la zona nororiental de la Península.
A: Autocorrelación espacial: mapa LISA. Clusters espaciales de las tasas de incidencia estandarizadas por edad suavizadas por municipio. 2003-2007. Hombres. B: Autocorrelación espacial: mapa LISA. Clusters espaciales de las tasas de incidencia estandarizadas por edad suavizadas por municipio. 2003-2007. Mujeres.
La técnica de análisis de agrupaciones locales (LISA) permite confirmar la heterogeneidad espacial14 en cuanto a la presentación de la enfermedad.
En los dos mapas se observan en la zona norte lo que se denominan «islas», es decir, municipios con tasas altas significativas rodeados de municipios con tasas bajas significativas.
DiscusiónÉste es el primer estudio que analiza la distribución espacial del riesgo de legionelosis por municipios en España. Su metodología nos permite describir el riesgo de la enfermedad en unidades geográficas más pequeñas que las habitualmente utilizadas, es decir, la provincia o la comunidad autónoma.
CasosEntre las limitaciones del estudio podemos señalar que los casos se obtuvieron de un sistema de notificación pasivo5, lo que puede asociarse con diferencias geográficas en la exhaustividad de la declaración. Este aspecto no se ha evaluado en la Red Nacional de Vigilancia para Legionelosis, pero cada año se notifican casos y brotes que nos sitúan entre los países con las más altas tasas de Europa4,15,16, lo que indica una buena práctica de identificación, diagnóstico y notificación de casos en nuestro país. El municipio de asignación del caso corresponde al municipio donde se sospecha que se produjo la infección. En la realidad, cuando no se puede identificar un lugar de infección, el caso se asigna al municipio de residencia. Puesto que se han excluido del estudio los casos de brotes y los asociados a viajes, creemos que el sesgo de clasificación de los casos en cuanto al lugar de la infección es mínimo, pues a todos se les pregunta por los antecedentes de viajes en el periodo de incubación de la enfermedad.
Análisis espacialEn nuestro estudio, los mapas obtenidos describen de manera consistente zonas de mayor riesgo en un eje norte-este, tanto al aplicar el patrón que muestra el análisis de suavizado de tasas EB como en las agrupaciones de municipios con altas y bajas tasas encontrados con el método LISA. Las zonas identificadas coinciden, en general, con las comunidades autónomas que presentan altas tasas de incidencia, pero se matiza la magnitud del riesgo debido a las técnicas de suavizado que se han empleado. En algunas comunidades autónomas cuyas tasas son más altas aparecen suavizadas en el mapa, ya que estas tasas altas se concentran en un solo municipio que puede coincidir con la capital de la provincia donde se han declarado los casos, pero si en los municipios de alrededor de ésta la tasa es muy baja, su efecto desaparece al tener en cuenta lo que ocurre en los municipios vecinos.
En los mapas suavizados de las tasas de incidencia en hombres y en mujeres se observan diferencias. Las tasas en los hombres son más altas y su distribución geográfica, aunque es similar a la de las mujeres, ocupa más extensión territorial y afecta a más municipios. La legionelosis es una enfermedad que afecta mayoritariamente a hombres y cuya incidencia aumenta con la edad. En todo el mundo17, la proporción entre hombres y mujeres es de 2,5:1. Esto concuerda con lo declarado a la RENAVE, ya el 78% de los casos son hombres, y con los resultados encontrados en nuestro análisis.
Los modelos propuestos nos permiten controlar la gran variabilidad de las tasas calculadas para áreas pequeñas que tienen poca población y muchos casos, lo que hace que sean inestables. El mapa suavizado mediante el método EB tiende a eliminar parte de esta variabilidad aleatoria. Una de las limitaciones que tiene el método es que en aquellas zonas donde se concentra el riesgo podría considerarse que el exceso se debe al elevado riesgo de sus vecinos, y viceversa. Esto podría dar lugar a falsos positivos (aumentando el riesgo de algunas ciudades) o a falsos negativos (atenuando el riesgo de otros).
El método de análisis global del índice de Moran nos permite medir la asociación o autocorrelación espacial global de todo el territorio, así como el comportamiento espacial de las tasas respecto a los municipios vecinos. Esta autocorrelación es positiva, lo que muestra que hay una correlación espacial en las tasas de legionelosis. Los valores no son muy altos, debido a la variabilidad de las tasas de los municipios y al alto número de municipios analizados (8112), por lo que es necesario aplicar una técnica local para la búsqueda de estas agrupaciones. Este análisis más detallado de la autocorrelación espacial se realiza mediante el reconocimiento de patrones locales de identificación espacial LISA, que nos muestran la existencia de agrupaciones locales de riesgo. Las «islas» geográficas que aparecen en algunos puntos de la zona norte del país, es decir, municipios con tasas altas rodeados de municipios con tasas bajas, muestran que hay zonas donde la autocorrelación espacial entre las tasas es alta y significativa, pero esto no implica que la tasa sea alta en los municipios vecinos. En los mapas realizados con el método EB, este efecto queda suavizado. Por ello, mientras el método EB nos muestra el patrón espacial de la distribución de la enfermedad, el método LISA nos permite identificar los clusters espaciales, tanto de tasas altas como de bajas.
Otros estudios, en otros países, han utilizado estas técnicas para ver la distribución espacial de la incidencia o de la mortalidad de las enfermedades6,13,18–23. Birch et al18 estudiaron la distribución espacial de la enfermedad criónica de las ovejas mediante un análisis exploratorio con el índice de Moran y el LISA, en Gran Bretaña, mientras que Heisterkamp et al20 utilizaron el método EB para estudiar el patrón de distribución espacial de la mortalidad en Holanda.
Dado que la mayor parte de los casos de legionelosis notificados son esporádicos y no pueden relacionarse con una fuente de infección, la identificación de diferencias geográficas es la base para generar hipótesis para futuras investigaciones en aquellas zonas en que se concentran los riesgos. Una posible hipótesis derivada de este análisis con casos esporádicos y no asociados a viajes puede ser que algunos factores ambientales, como la temperatura y la humedad, estuvieran influyendo en esta distribución del riesgo. En la literatura podemos encontrar algunos estudios que relacionan la distribución de la legionelosis con factores ambientales24–27. Otra posible hipótesis puede ser la situación de las torres de refrigeración o de otros dispositivos que producen aerosoles empleados en procesos industriales, como reflejan algunos autores28. Por último, estos modelos también permitirían hacer el seguimiento y la evaluación de la introducción de medidas de control y preventivas, como la aplicación de legislación o de programas específicos de control en ámbitos de riesgo.
Se propone introducir en los modelos variables ambientales, tales como la temperatura o la humedad, así como la distribución geográfica de las torres de refrigeración, para explicar en profundidad estos patrones espaciales.
Estas técnicas de análisis espacial son una herramienta útil para las autoridades de salud pública, pues permiten identificar el patrón geográfico del riesgo de una enfermedad y sus cambios en el tiempo, y proporcionan un valor añadido a la vigilancia epidemiológica de las enfermedades infecciosas.
Contribuciones de autoríaD. Gómez-Barroso, R. Cano y M.F. Pina concibieron el estudio y supervisaron todos los aspectos de su realización. F. Nogareda obtuvo los datos y participó en la redacción. D. Gómez-Barroso realizó el análisis y la redacción del artículo. F. Simon, J.L. del Barrio y R. Cano interpretaron los resultados y contribuyeron a la redacción del manuscrito. Todos los autores aportaron ideas, revisaron los borradores del manuscrito y aprobaron la versión final. D. Gómez-Barroso es la responsable del artículo.
FinanciaciónNinguna.
Conflicto de interesesNinguno.