La finalización del despliegue de los programas de detección precoz de cáncer de mama en todas las comunidades autónomas de España ha facilitado el inicio de una investigación conjunta, con información procedente de varios programas, orientada a mejorar su efectividad.
MétodosSe ha construido una cohorte de más de 1 millón de mujeres cribadas para evaluar el riesgo y los determinantes de los resultados falsos positivos. Se ha evaluado el impacto del cambio de técnica de mamografía analógica a digital y se está estudiando el cáncer de intervalo y los resultados falsos negativos.
ResultadosLos resultados ofrecen información muy útil, desde el punto de vista de salud pública, para identificar e informar mejor a las mujeres con mayor riesgo de presentar efectos adversos, a la vez que ayudará a identificar características ligadas a los programas y a las mujeres que permitan establecer mejores estrategias de prevención.
ConclusionesEstos resultados se incorporarán a los modelos matemáticos sobre evaluación de la eficiencia de los programas que se están desarrollando actualmente. Modelos que pueden ser de gran utilidad como herramienta dirigida a informar y guiar las decisiones clínicas y de planificación sanitaria sobre el control del cáncer.
The consolidation of breast cancer screening programs, with full coverage of the target population in all Spanish regions, has encouraged the beginning of a joint research strategy. This strategy aims to improve the effectiveness of breast cancer screening by gathering information from distinct screening programs.
MethodsA retrospective cohort with information on over 1.5 million screened women was constructed to evaluate risk factors for a false-positive result. The impact of the change from digital mammography to screen-film mammography was evaluated, while results for interval cancers and false negatives are currently being studied.
ResultsThe results are highly useful from the perspective of public health, as they can be used to identify and improve the information provided to women with a higher risk of experiencing an adverse effect. These results will also be helpful to identify screening program-related characteristics and women's personal characteristics, which will allow better prevention strategies to be developed.
ConclusionsThe results obtained will be included in mathematical models currently under development to evaluate the efficiency of breast cancer screening. These models could be highly useful to provide information and guide clinical and health policy decisions on cancer prevention and control.
En la evaluación de la efectividad de los programas poblacionales de detección precoz del cáncer actualmente existe un debate sobre el equilibrio entre beneficios (reducción de la mortalidad, tratamientos menos agresivos, mejora de calidad de vida, etc.) y riesgos o efectos adversos (falsos positivos, falsos negativos, sobrediagnóstico, etc.).
La evolución del cáncer de mama favorece la posibilidad de la detección precoz mediante el cribado mamográfico. Su efectividad ha sido valorada en diversos ensayos clínicos aleatorizados1–4, donde se demostró una reducción de la mortalidad de entre un 20% y un 35%, variable según la edad, los años de seguimiento, el número de mujeres cribadas y la periodicidad del estudio mamográfico. Sin embargo, persiste el debate sobre cuáles son las estrategias de cribado con mejor balance beneficio/riesgo, teniendo en cuenta tanto la introducción de nuevas técnicas de cribado como los avances en los tratamientos5. Además, no todas las mujeres se benefician por igual del cribado poblacional. Así, aquellas con tumores de crecimiento rápido tienen menor probabilidad de que éste sea detectado en el cribado, mientras que la detección de tumores de crecimiento muy lento puede representar un sobrediagnóstico. Este último es un efecto indeseado del cribado de difícil cuantificación, en parte por los sesgos de adelanto diagnóstico, que conlleva el sobretratamiento de tumores que nunca se habrían manifestado clínicamente6.
En el contexto de los nuevos avances tecnológicos y de conocimiento, factores como el coste, el tiempo necesario para obtener resultados en términos de impacto en mortalidad, cuestiones éticas, y la más que probable contaminación entre los grupos de estudio, dificultan la puesta en marcha de ensayos aleatorizados para evaluar tanto los beneficios (reducción de la mortalidad) como los efectos adversos de distintas estrategias de cribado.
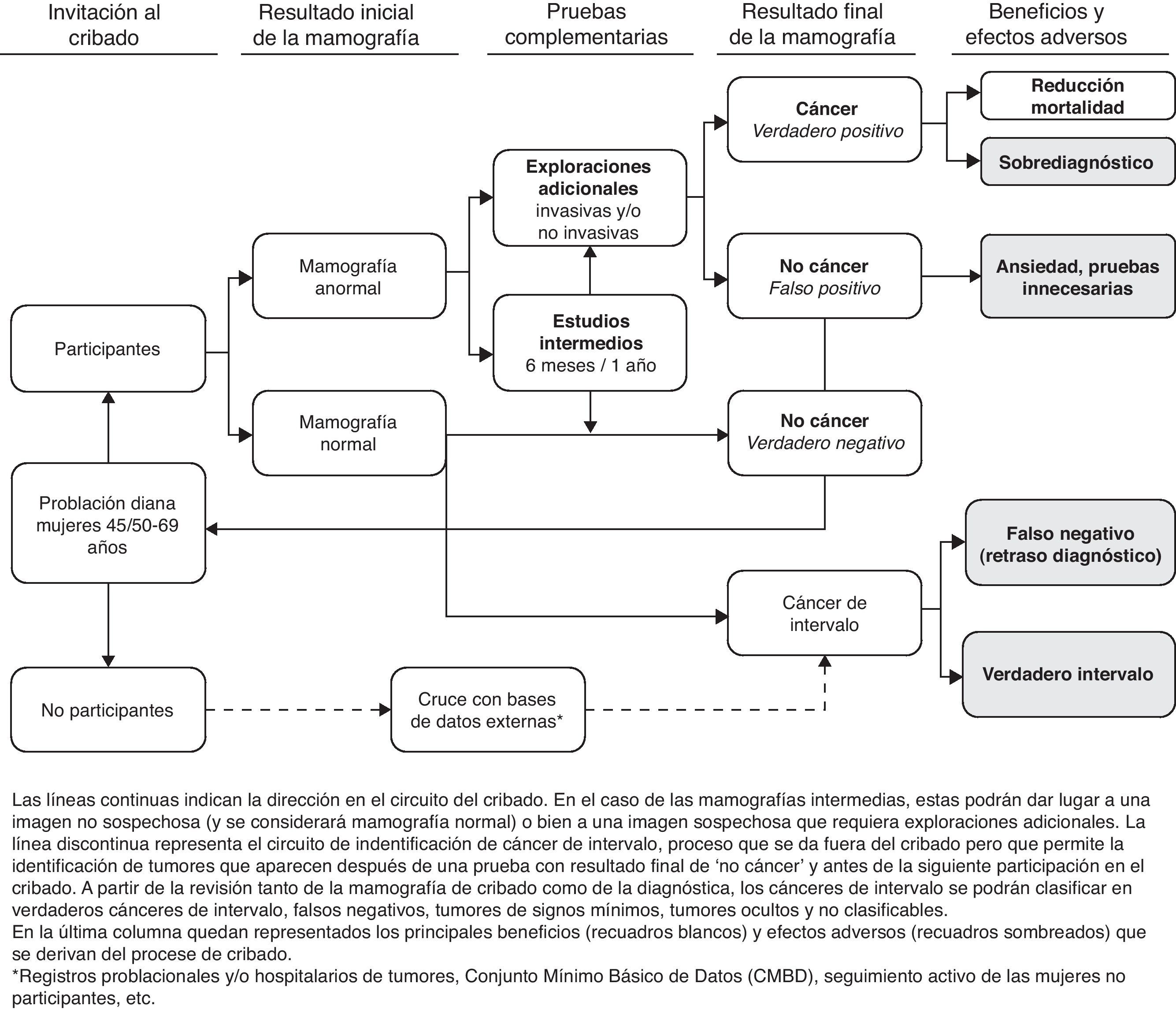
Esta realidad obliga a revisar los actuales modelos de cribado que quizá con los nuevos conocimientos puedan optimizarse y hacerse más efectivos y/o personalizados. Actualmente, el cribado de cáncer de mama en España se ofrece al 100% de la población objetivo (casi 5 millones de mujeres). Todos los programas invitan a mujeres de entre 45/50 y 69 años de edad y utilizan como prueba de cribado la mamografía con doble proyección cada 2 años7. La figura 1 esquematiza el funcionamiento de un programa de detección precoz, los resultados que pueden obtenerse de la mamografía de cribado, los beneficios y los efectos adversos. Los programas de todas las comunidades autónomas se coordinan en el contexto de la Red de programas españoles de cribado. Esta red ha permitido unificar criterios y estándares, compartir herramientas, incorporar innovaciones, gestionar la información para la evaluación conjunta de resultados, etc. La investigación se ha realizado generalmente en el marco de programas o áreas concretas, y sobre todo relacionada con la participación y acceso al cribado, descripción de indicadores e impacto sobre la mortalidad8–18.
A continuación se presenta la cronología y los avances de la investigación conjunta en España en el cribado de cáncer de mama, desde el primer estudio, diseñado para evaluar el riesgo de resultados falsos positivos, hasta la búsqueda de marcadores biológicos que puedan resultar útiles en un futuro para personalizar el cribado y la creación de modelos matemáticos que ayuden a evaluar el impacto de distintos escenarios de detección precoz.
Inicio de la investigación conjunta en España en el cribado del cáncer de mama: estudio RAFP (Riesgo Acumulado de Falso Positivo) y DIGIRAFP (impacto de la introducción de la mamografía digital)Varias instituciones internacionales recomiendan incorporar y proporcionar información a las mujeres participantes19,20 sobre los efectos adversos del cribado. Hay un porcentaje en el cual el resultado de la prueba no es el correcto, bien por clasificar como posible lesión maligna una imagen que luego no se confirma con las pruebas de diagnóstico posteriores (falso positivo), o por no detectar una lesión maligna existente (falso negativo). Algunos estudios han investigado los resultados falsos positivos y sus efectos en programas de cribado americanos, europeos y en el contexto español21–24. No obstante, los determinantes del riesgo ligados a las características de la mujer (edad, menopausia, uso de tratamiento hormonal sustitutivo, antecedentes personales o familiares, etc.) o a las características del programa de cribado (número de proyecciones, tipo de lectura mamográfica, técnica, experiencia del radiólogo, etc.) han sido poco estudiados. Tampoco está bastante evaluado el impacto de la introducción de la mamografía digital en el contexto de programas poblacionales, aunque sí en el de ensayos clínicos24–26. En cualquier caso, es una realidad que varios programas o unidades radiológicas han sustituido la mamografía analógica por la digital en la primera mitad de la pasada década, y muchos otros van a implantar esta técnica próximamente.
En este contexto, en el año 2007 se obtuvo un proyecto del Fondo de Investigaciones Sanitarias para evaluar el riesgo acumulado de falso positivo en el conjunto de 10 programas de cribado de ocho comunidades autónomas (proyecto RAFP), y en 2008 otro para evaluar el impacto de la introducción de la mamografía digital (proyecto DIGIRAFP). Las características de estos proyectos y los resultados principales disponibles se resumen en la tabla 1. El primero ha puesto de manifiesto una gran variabilidad en el riesgo de presentar un resultado falso positivo debido tanto a las características propias de la mujer como a las características del protocolo de lectura mamográfica. También ha permitido evaluar el efecto de la experiencia del radiólogo, demostrando que una mayor experiencia, tanto en volumen de mamografías leídas el año anterior como en años totales de experiencia en el programa, conlleva una menor proporción de resultados falsos positivos27,28. En cuanto a la edad de inicio del cribado, a pesar de que no hay evidencias concluyentes sobre el beneficio del cribado por debajo de los 50 años, algunos programas empiezan a los 45. En el proyecto RAFP se ha observado que las mujeres que inician el cribado con una edad entre 45 y 50 años presentan un riesgo acumulado de falso positivo a lo largo de 10 rondas superior en un tercio al de las mujeres que lo iniciaron a los 50 años de edad, sin que el incremento del riesgo se acompañe de un aumento en la tasa de detección29. De la misma forma, a pesar de que las guías recomiendan no hacer mamografías intermedias (mujeres a las que se les realiza una mamografía de seguimiento a los 6 o 12 meses, antes de la secuencia habitual), algunos programas las realizan de manera habitual. El efecto de estas pruebas sobre la tasa de detección y sobre el riesgo de resultado falso positivo también ha sido evaluado30. El segundo proyecto ha permitido poner de manifiesto que la mamografía digital, con la misma precisión diagnóstica, reduce los falsos positivos y el número de pruebas adicionales, aumentando así el valor predictivo positivo de las pruebas adicionales31,32.
Resumen de los proyectos colaborativos de investigación en el cribado de cáncer de mama y de los resultados disponibles
| Programas/centros participantes | Período de estudio | Diseño y población de estudio | Objetivos | Resultados principales |
| Evaluación del riesgo acumulado de falso positivo y de sus determinantes (proyecto RAFP) | ||||
| AsturiasCanariasCataluña (PSM-Barcelona, Sabadell, Tarragona)GaliciaLa RiojaNavarraValencia | Inicio de los programas (1990-1999) hasta 31/12/2006 | Cohorte1.565.364 mujeres4.739.498 mamografías | Objetivo principalEstimar la probabilidad acumulada de presentar un falso positivo en el cribado mamográfico (bienal), durante el período de tiempo que la mujer es invitada a participar en un programa poblacional de detección precoz de cáncer de mamaObjetivos específicosEvaluar la asociación entre un resultado falso positivo y sus determinantes (características del protocolo de lectura, características propias de la mujer y la experiencia de los radiólogos)Evaluar el efecto de los resultados falsos positivos sobre la adherencia de las mujeres a los programas de cribado y sobre la tasa de detección del cáncer en posteriores convocatorias de cribado | Riesgo acumulado de FP global: 20,39% (rango de 51,4-7,5) y FP en pruebas invasivas 1,76% (rango de 1,6-12,0). Alta variabilidad en función de perfiles de riesgo. Mayor riesgo de FP en mujeres de 40-45 años frente a 50-55 (OR = 1,20)Menor riesgo de FP a mayor número de lecturas anuales y años de experienciaMenor adherencia al cribado en las mujeres que han sufrido un FP (79,3% frente a 85,3%) |
| Evaluación del impacto de la introducción de la mamografía digital (proyecto RAFP digital) | ||||
| CantabriaCataluña (Girona, PSM-Barcelona)Valencia | Inicio de los programas con unidades digitalizadas (1996-1999) hasta 31/12/2007 | Cohorte103.613 mujeres242.838 mamografías | Objetivo principalEvaluar el impacto de la introducción de la técnica de la mamografía digital sobre la tasa de reconvocatoria y la de detección del cáncer en programas de diagnóstico precoz de cáncer de mama en EspañaObjetivos específicosEvaluar si los determinantes de falso positivo son los mismos utilizando la técnica analógica y la digitalComparar las características de los tumores detectados con ambas técnicas | Mayor riesgo de FP en mamografía analógica que en mamografía digital (OR = 1,32) |
| Evaluación de la tasa de cánceres de intervalo y sus determinantes (proyecto INCA) | ||||
| CanariasCataluña (Girona, PSM-Barcelona, Sabadell)GaliciaPaís VascoValencia | Mamografías de cribado realizadas entre 1/1/2000 y 31/12/2006Seguimiento para la identificación de cánceres de intervalo, hasta 30/06/2009 | Cohorte646,639 mujeres1,511,165 mamografías | Objetivo principalEstimar la tasa global y específica de cáncer de intervalo (verdaderos cánceres de intervalo, falsos negativos, tumores ocultos, de signos mínimos) y sus determinantesObjetivos específicosEvaluar la asociación entre cáncer de intervalo y características propias de la mujer y del protocolo de lectura de los programasComparar las características biológicas de los cánceres de intervalo y los tumores detectados en el cribado | En proceso |
| PSM-BarcelonaUniversitat de Lleida y datos de programas específicos a determinar | Modelos probabilísticos y de simulaciónSe utilizarán los resultados de efectos adversos publicados de los proyectos anteriores | Objetivo principalDiseñar modelos matemáticos que evalúen el impacto en salud y el coste de distintas estrategias de cribado, incluyendo información tanto de los beneficios como de los efectos adversos evaluados y características de la población | En proceso | |
FP: falso positivo; OR: odds ratio.
Los retos que supusieron estos proyectos fueron, en primer lugar, crear una base de datos conjunta (fig. 2) a partir de las bases de datos propias de cada programa. Esta realidad, la fragmentación de la información en el territorio, con codificaciones que aunque siguen las mismas guías y recomendaciones nunca son iguales, supuso un trabajo de consenso, transformación y validación muy laborioso que ha permitido construir la cohorte más grande de mujeres cribadas existente, con más de 1 millón y medio de mujeres, con información de cada prueba de cribado realizada y el resultado de la misma. La información recogida ha permitido evaluar también la relación entre un resultado falso positivo y la adherencia posterior al programa33,34, observándose que un resultado falso positivo disminuye la probabilidad de que la mujer vuelva en la siguiente convocatoria. Se está estudiando también la asociación entre un resultado falso positivo y la probabilidad posterior de sufrir cáncer de mama.
Sin embargo, para una evaluación más completa era necesario el estudio de los cánceres de intervalo y de los falsos negativos. Hasta la fecha, muy pocos estudios han evaluado la influencia de los factores relacionados con las características de los programas y de las mujeres con riesgo de padecer un cáncer de intervalo o un resultado falso negativo.
El reto de estudiar el cáncer de intervalo: el uso de distintas fuentes de información de base hospitalaria y poblacional. Estudio INCAUna de las razones por las que hay relativamente pocos estudios que evalúen el cáncer de intervalo es la dificultad que supone su identificación. Según las guías europeas20, se considera un cáncer de intervalo un tumor primario de mama diagnosticado en una mujer a la que se le ha realizado una prueba de cribado, con o sin valoración adicional, cuyo resultado de malignidad fue negativo y el diagnóstico de cáncer se produce antes de la siguiente invitación al programa, o bien en un plazo igual al intervalo de cribado si la mujer ya ha alcanzado la edad máxima de participación en el programa. Para la identificación de este cáncer es imprescindible determinar todos los casos incidentes de cáncer de mama en la población diana de los programas. Las fuentes de datos que deben utilizarse para la identificación de los cánceres de intervalo son registros de tumores de base poblacional en las zonas en que existan, registros de tumores hospitalarios, conjunto mínimo básico de datos hospitalario (CMBD-H), registros propios de los programas de cribado de cáncer de mama y de los laboratorios de anatomía patológica, así como los datos que provienen del seguimiento activo de las mujeres que participan en los programas. En el marco de la red de programas de cribado de cáncer, se ha definido un protocolo de identificación de los cánceres de intervalo35 y existen experiencias de identificación en varios programas que garantizan una identificación de más del 95% de los casos existentes, aunque pocos programas hasta la fecha han realizado un seguimiento sistemático de los cánceres de intervalo.
Además de su identificación, otro reto es la clasificación de éstos. Existen cinco categorías:201) verdaderos cánceres de intervalo, que son los cánceres que en la última mamografía de cribado aún no eran visibles; 2) cánceres de signos mínimos, aquellos que presentaban alteraciones mínimas en la mamografía de cribado; 3) cánceres radiológicamente ocultos o los que cursaron sin alteraciones mamográficas sugestivas de malignidad incluso en el momento del diagnóstico; 4) los falsos negativos, cánceres que eran ya visibles en la mamografía de cribado, y 5) tumores no clasificables, cuando no se dispone de la mamografía de cribado o de la mamografía de diagnóstico. Esta clasificación requiere que radiólogos experimentados revisen la mamografía de cribado negativa justo anterior al diagnóstico de cáncer y la mamografía obtenida en el proceso del diagnóstico. La guía radiológica de las guías europeas20 propone que tres radiólogos con experiencia revisen en dos fases las mamografías de los cánceres de intervalo. En el estudio INCA se clasificarán los cánceres de intervalo en las cinco categorías citadas y, además de una submuestra, se evaluará la densidad mamaria utilizando la clasificación propuesta por Boyd, que consiste en una clasificación cuantitativa en seis grupos, según los porcentajes de tejido graso y tejido fibroglandular en relación con la superficie de la mama36. La densidad mamaria es otro factor relevante para el cáncer de mama, ya que una mayor densidad mamográfica se asocia a un mayor riesgo de cáncer37. Esta densidad, relacionada con la edad y el uso de tratamientos hormonales, influye a su vez en la sensibilidad de la mamografía38. Así, últimamente se está proponiendo la utilización de la densidad mamográfica como una variable intermedia en la valoración del riesgo en los programas de cribado. En fechas recientes se han publicado resultados de distintos métodos de evaluación de la densidad en el contexto del estudio multicéntrico español DDM-Spain39,40.
Las características y variables del estudio INCA se detallan en la tabla 1 y en la figura 2, respectivamente. Aunque los cánceres de intervalo son inevitables en un programa de cribado, su número debe ser tan pequeño como sea posible, ya que una alta proporción de éstos reduciría su efectividad con una menor reducción de la mortalidad. En Europa, algunos programas han evaluado los cánceres de intervalo41–49. En general, las incidencias que reportan no superan los límites recomendados por las guías europeas (incidencia proporcional < 0,30 el primer año tras la mamografía de cribado negativa y < 0,50 el segundo año). Se ha evaluado el efecto del tiempo transcurrido desde la mamografía de cribado o el efecto del cribado inicial y sucesivo sobre la tasa del cáncer de intervalo. En cambio, otros aspectos que relacionan los cánceres de intervalo con otras características de los programas, como el tipo de mamografía o el número de proyecciones mamográficas, han sido menos evaluados.
Del cribado a la biología molecular: investigación translacionalEntre los subtipos de cáncer de intervalo destacan los falsos negativos (en torno al 20%) y los verdaderos cánceres de intervalo (en torno al 45%)41,44,50,51. Esta distinción es importante ya que, en teoría, los falsos negativos deberían y podrían reducirse, mientras que los verdaderos cánceres de intervalo son inevitables y menos susceptibles de ser diagnosticados mediante el cribado. Desde el punto de vista biológico, los cánceres de intervalo constituyen un grupo heterogéneo de tumores que presentan un peor pronóstico en comparación con los cánceres detectados durante el cribado44,51,52. El peor pronóstico observado en los cánceres de intervalo que han sido falsos negativos se explica por el efecto del retraso diagnóstico. En cambio, el peor pronóstico asociado a los tumores que son verdaderos intervalos parece estar relacionado con sus características biológicas. Entre los verdaderos cánceres de intervalo se ha descrito una mayor tasa de proliferación celular (sobrexpresión del biomarcador Ki-67)53 y una mayor frecuencia de tumores con patrones de biomarcadores más agresivos, como el fenotipo triple negativo (tumores que no expresan ni receptores de estrógenos, ni de progesterona, ni el factor de crecimiento HER-2)50,54. El estudio INCA permitirá analizar, con una muestra importante, los marcadores biológicos de los distintos tipos de cáncer de intervalo. Los resultados esperados pueden aportar información útil para abrir nuevas líneas de investigación que quizá permitan, en un futuro, personalizar las estrategias de prevención del cáncer de mama, al mejorar la identificación de mujeres con perfiles de riesgo diferentes, por ejemplo ligado a la densidad mamaria, y buscar nuevas opciones terapéuticas para grupos específicos de tumores.
Modelos probabilísticos y de simulación: desarrollo de nuevas líneas de investigación para la evaluación de los programas de cribadoLos avances en el conocimiento de los efectos adversos y su posible minimización, la introducción de nuevas tecnologías y nuevos enfoques terapéuticos, el envejecimiento de la población, etc., contribuyen al mantenimiento de la controversia sobre cuáles son las estrategias de cribado con mejor balance beneficio/riesgo. En la introducción se han apuntado los factores que hacen difícil la realización de ensayos aleatorizados para evaluar cuestiones relevantes de la detección precoz. Los modelos matemáticos (analíticos o de simulación) son una alternativa a los ensayos poblacionales para responder a muchas de las cuestiones que se plantean sobre el impacto en la reducción de la mortalidad y el coste de la detección precoz. Los modelos utilizan información de los ensayos clínicos, metaanálisis, estudios observacionales y registros demográficos o sanitarios, e incluyen información sobre beneficios y costes. Sin embargo, hasta la fecha, la inclusión de los efectos adversos en los modelos ha sido muy limitada. En Estados Unidos, el National Cancer Institute puso en marcha una iniciativa, la Cancer Intervention and Surveillance Modeling Network (CISNET), que utiliza modelización para informar y guiar las decisiones clínicas y de planificación sanitaria sobre el control del cáncer. Entre los modelos analíticos utilizados por CISNET destaca el modelo probabilístico desarrollado por Lee y Zelen55. Este modelo se basa en la estimación de la mortalidad por cáncer de mama que se observaría en una cohorte de mujeres en diferentes escenarios de cribado (diferentes periodicidades y edades de inicio y fin de las pruebas). Este modelo se ha utilizado para evaluar el coste-efectividad del cribado en Corea56. Con la consolidación de los distintos programas de cribado de cáncer de mama en España, se realizaron algunas evaluaciones económicas de ellos a finales de la década de 199057,58. Actualmente se han comenzado a realizar estimaciones de costes de distintas estrategias de cribado en las que se incluyen también algunos efectos adversos59.
Estos modelos son una herramienta de gestión sanitaria que permite ofrecer previsiones a medio y largo plazo de la necesidad de recursos y del impacto presupuestario. Así mismo, tienen un elevado potencial para la toma de decisiones de manera dinámica, ya que permiten tener en cuenta la evolución de la población y las características de los programas de cribado. Los resultados de los proyectos RAFP e INCA permitirán incorporar información más detallada sobre los efectos adversos de los programas de nuestro entorno en los modelos matemáticos, proporcionando de esta manera estimaciones más acordes a la realidad de nuestra población y nuestro sistema.
ConclusionesLa situación actual de los programas de detección precoz del cáncer de mama en España ha permitido iniciar proyectos de investigación con información procedente de diferentes programas, creando una de las mayores cohortes de mujeres cribadas. La posibilidad de evaluar el riesgo de resultados falsos positivos, de cáncer de intervalo y de resultados falsos negativos de los programas de detección precoz y de conocer mejor sus determinantes, ofrecerá información muy útil, desde el punto de vista de salud pública, para identificar e informar mejor a las mujeres con mayor riesgo de presentar efectos adversos, a la vez que ayudará a identificar características ligadas a los programas y a las mujeres que permitan establecer mejores estrategias de prevención. Estos resultados se incorporarán a los modelos matemáticos sobre evaluación de la efectividad de los programas que se están desarrollando actualmente y serán de elevada utilidad como herramienta dirigida a informar y guiar las decisiones clínicas y de planificación sanitaria sobre el control del cáncer.
Esta investigación ha puesto de manifiesto una vez más las dificultades derivadas de la inexistencia de bases de datos comunes que permitan evaluar globalmente algunos servicios sanitarios. Sin embargo, está siendo una experiencia enriquecedora, útil para los programas, con una producción científica que se espera relevante y que ya ha dado sus primeros frutos.
Además, en el contexto actual de despliegue del programa de detección precoz del cáncer colorrectal, la experiencia adquirida en estos proyectos de investigación sobre los programas de cáncer de mama puede ser de utilidad para identificar y planificar desde el principio los proyectos de investigación necesarios para ofrecer el mejor programa, de acuerdo con la mejor evidencia científica disponible.
A pesar de la demostrada reducción de la mortalidad por cáncer de mama en la población de mujeres cribadas, en la actualidad existe un activo debate sobre el balance entre riesgos y beneficios del cribado mamográfico. El impacto de los efectos adversos del cribado y sus determinantes están poco evaluados y son esenciales para mejorar la efectividad de esta práctica preventiva.
¿Qué añade el estudio realizado a la literatura?Por primera vez se está desarrollando en España una estrategia conjunta de investigación para el estudio y la evaluación del cribado mamográfico. Los distintos estudios realizados ofrecen una visión global y representativa del contexto español, y aportan información de gran validez para la mejora y la comprensión del cribado.
M. Sala y X. Castells han redactado y elaborado el manuscrito. N. Ascunce, D. Salas, R. Zubizarreta y M. Rué han estado estrechamente ligados como investigadores principales a los distintos proyectos desarrollados en el manuscrito, y han revisado y aportado comentarios en la redacción del mismo para conseguir dar un enfoque común a toda la información sintetizada y presentada en el manuscrito.
FinanciaciónInstituto de Salud Carlos III-FEDER: PI061230; PI09/90251; PI07/90293; PS09/ 01153.
Conflictos de interesesNinguno.
Los autores quieren agradecer su dedicación y compromiso a todos los investigadores participantes en los proyectos RAFP, RAFP-Digital e INCA (ver Anexo), y la contribución de Laia Domingo, Marta Román, Andrea Burón, Mercè Comas y Francesc Cots en la elaboración de este manuscrito.
IMIM-Hospital del Mar, Parc de Salut Mar, Barcelona: Xavier Castells, Francesc Macià, Marta Román, María Sala. Servicio de programas poblacionales de cribado, Xunta de Galicia: Raquel Almazán, Ana Belén Fernández, María Teresa Queiro, Raquel Zubizarreta. Programa de Detección Precoz de Cáncer de Mama de Navarra, Instituto de Salud Pública, Pamplona: Nieves Ascunce, María Ederra, Nieves Erdozain, Iosu Delfrade. Dirección General de Salud Pública y Centro Superior de Investigación en Salud Pública (CSISP), Generalitat Valenciana: Dolores Cuevas, Josefa Ibáñez, Josefa Miranda, Dolores Salas. Servicio Canario de la Salud, Islas Canarias: María Obdulia de la Vega, Isabel Díez de la Lastra. Fundació Lliga per a la Recerca i Prevenció del Càncer, Institut d’Investigació Sanitària Pere Virgili, Reus, Tarragona: Jaume Galceran. Unidad de Análisis y Programas, Departamento de Salud, Asturias: Carmen Natal. Programa de Detección Precoz de Cáncer de Mama, La Rioja. Fundación Rioja Salud, Logroño: Araceli Baroja. Sección de Promoción y Protección de la Salud. Corporació Parc Taulí-Institut Universitari Parc Taulí (UAB), Sabadell: Marisa Baré. Castilla-León Programa de Detección Precoz de Cáncer de Mama. Dirección General de Salud Pública ID e I. SACYL. Castilla y León: Isabel González-Román.
IMIM-Hospital del Mar, Parc de Salut Mar, Barcelona: Francesc Belvis, Xavier Castells, María Sala. Hospital Santa Caterina, Girona: Joana Ferrer. Dirección General de Salud Pública y Centro Superior de Investigación en Salud Pública (CSISP), Generalitat Valenciana: Josefa Ibáñez, María Soledad Laso, Dolores Salas. Cantabria: Mar Sánchez, Alfonso Vega.
IMIM-Hospital del Mar, Parc de Salut Mar, Barcelona: Jordi Blanch, Xavier Castells, Mercè Comas, Laia Domingo, Francesc Macià, Juan Martínez, Marta Román, Anabel Romero, María Sala. Dirección General de Salud Pública y Centro Superior de Investigación en Salud Pública (CSISP), Generalitat Valenciana: Carmen Alberich, Josefa Ibáñez, Amparo Lluch, Josefa Miranda, Dolores Salas, Ana Torrella. Servicio de Programas Poblacionales de Cribado, Xunta de Galicia: Raquel Almazán, Miguel Conde, Montserrat Corujo, Ana Belén Fernández, Raquel Zubizarreta. Servicio de Programas Oncológicos, Servicio Canario de la Salud: Teresa Barata, Isabel Díez de la Lastra, Juana María Reyes. Programa de Detección Precoz del Cáncer de Mama-Osakidetza, País Vasco: Arantza Otegi, Garbiñe Sarriugarte. Hospital Parc Taulí, Sabadell: Marisa Baré, Núria Torà. Hospital Santa Caterina, Girona: Joana Ferrer, Gemma Renart. Registro de Cáncer de Girona, Institut Català d’Oncologia: Rafael Marcos-Gragera, Montserrat Puig. Universitat de Lleida: Carles Forné, Montse Martínez-Alonso, Albert Roso, Montse Rué, Ester Vilaprinyó. Universitat Rovira i Virgili, Tarragona: Misericordia Carles, Aleix Gregori, María José Pérez. Regió Sanitària Terres de l’Ebre: Roger Pla.