Los resultados de diversos estudios sugieren la existencia de un período crítico en el desarrollo del individuo en el cual la experiencia de maltrato y abuso sexual puede conllevar cambios neurobiológicos permanentes o muy duraderos, afectando especialmente a la respuesta del eje neuroendocrino hipotálamico-hipofisario-adrenal. El objetivo de este trabajo es ofrecer una revisión actualizada de las principales consecuencias neurobiológicas del abuso sexual infantil.
MétodosSe seleccionaron aquellas publicaciones de enero de 1999 a enero de 2010, en inglés o español, centradas en las consecuencias neurobiológicas relacionadas con la experiencia de abuso sexual infantil mediante las bases de datos Medline, Scopus, Psycinfo y Web of Science. También se examinaron las listas de referencias de estudios publicados acerca de las consecuencias neurobiológicas de la victimización en la infancia.
ResultadosSe incluyeron 34 estudios sobre consecuencias neurobiológicas del abuso sexual infantil, de los cuales se extraen alteraciones neuroendocrinas, estructurales, funcionales y neuropsicológicas que afectan a un importante número de víctimas.
ConclusionesLos trabajos que hasta ahora han explorado los efectos neurobiológicos del maltrato muestran que es necesario considerar a éste y al abuso sexual infantil como problemas de salud que afectan a diferentes áreas de la vida de sus víctimas, favoreciendo así el desarrollo de programas de intervención y tratamiento teniendo en cuenta sus múltiples efectos.
The results of several studies suggest that there is a critical timeframe during development in which experiences of maltreatment and sexual abuse may lead to permanent or long-lasting neurobiological changes that particularly affect the hypothalamus-pituitary-adrenal axis response. The aim of the present study was to provide an updated review on the main neurobiological consequences of child sexual abuse.
MethodsWe selected articles published between January 1999 and January 2010 in English or Spanish that focused on the neurobiological consequences of child sexual abuse available through Medline, Scopus and Web of Science. We also examined the references in published articles on the consequences of sexual victimization in childhood.
ResultsIn this review we included 34 studies on neurobiological consequences, indicating different kinds of effects, namely: neuroendocrine, structural, functional and neuropsychological consequences, which affect a large number of victims.
ConclusionsThe existing body of work on the neurobiological consequences of maltreatment shows the need to consider maltreatment and child sexual abuse as health problems that affect different areas of victims’ lives, which would in turn favor the development of intervention and treatment programs that take these multiple effects into account.
El abuso sexual ha sido uno de los tipos de maltrato infantil más tardíamente estudiado, si bien su revelación como maltrato frecuente, y con importantes y perdurables efectos psicológicos para sus víctimas, ha dado lugar en las últimas décadas a un notable crecimiento en el interés profesional sobre la detección de estos casos y la intervención posterior con estas víctimas1. Estudios nacionales2 e internacionales3,4 han constatado la amplia extensión de este problema en el mundo occidental, con una prevalencia que oscila entre un 10% y un 20% de la población5.
Recientemente se ha producido una especial sensibilidad hacia este tema, tanto por los investigadores como por parte de la sociedad, y se observa un notable esfuerzo e interés de las administraciones en el campo de la atención y la protección del menor en este aspecto. Sin embargo, la ausencia, en la mayoría de las ocasiones, de un daño físico visible, así como la inexistencia de un conjunto de síntomas psicológicos que permitan su detección y diagnóstico unívoco, han hecho que el abuso sexual infantil sea difícil de detectar por los profesionales de la salud6.
Diferentes estudios constatan consecuencias que afectan a todas las áreas de la vida de la víctima, tanto en la infancia7 como en la edad adulta8-10, y que impiden hablar de un síndrome del abuso sexual infantil. Así, los trabajos publicados al respecto demuestran que no hay un patrón de síntomas único, y sí una extensa variedad de síntomas en estas víctimas e incluso la ausencia total de síntomas que presentan algunas de ellas, lo cual impide establecer un síndrome que defina y englobe los problemas físicos, emocionales, cognitivos y sociales que se relacionan con la experiencia de abuso sexual11.
Una de las áreas de estudio actual más importante en casos de abuso sexual infantil, más allá de la psicopatología, es la relacionada con las consecuencias neurobiológicas de esta experiencia, dadas sus repercusiones en el individuo12, centrándose en el estudio del eje hipotalámico-hipofisario-adrenal debido a su importante función en la respuesta al estrés13, aunque se ha observado que otros sistemas neurofuncionales también pueden verse implicados14.
Los resultados de diversos estudios sugieren que hay un período crítico en el desarrollo del individuo en el cual la experiencia de estrés puede conllevar cambios neurobiológicos permanentes o muy duraderos, que aumentan la probabilidad de desarrollar trastornos del estado de ánimo y de ansiedad como respuesta a la experiencia de otros estresores posteriores en la vida del individuo15,16. Esta perspectiva se relaciona con el concepto de alostasis, definido como la capacidad de conseguir estabilidad a través del cambio y referido a la respuesta que los sistemas nervioso e hipotalámico-hipofisario-adrenal del individuo proporcionan ante un estresor, y que tiene como finalidad el retorno a la estabilidad fisiológica. No obstante, si el estresor perdura durante largos períodos de tiempo y la respuesta de los sistemas implicados resulta infructífera para estabilizar al individuo, se produce una sobrerreactividad crónica que puede conllevar consecuencias fisiopatológicas12. Esto es especialmente grave si se produce en el período de desarrollo del individuo, es decir, durante la infancia17, pues las regiones cerebrales sensibles al estrés se encontrarían en un momento de máxima sensibilidad18-20.
En este sentido, y relacionado con lo ya expuesto, resulta especialmente útil conocer las consecuencias neurobiológicas y su variedad de formas, ya que ello nos permite aproximarnos al concepto de resiliencia psicobiológica21. Así, ser portador de determinados alelos puede conferir una cierta protección durante los períodos críticos que acabamos de comentar22.
Aunque hay algunas revisiones previas sobre este tema23-28, ninguna de ellas se ha centrado exclusivamente en el área del abuso sexual infantil. Además, es necesaria una actualización en lengua española de las investigaciones publicadas al respecto. En esta línea, el objetivo del presente trabajo es ofrecer una revisión actualizada de las principales consecuencias neurobiológicas del abuso sexual infantil, que permita a los profesionales de la salud conocer las nuevas líneas de trabajo y los nuevos hallazgos experimentales que, en un futuro, podrían facilitar su prevención o el tratamiento de sus consecuencias.
MétodosSelección de los estudiosSe llevó a cabo una búsqueda bibliográfica exhaustiva, entre los meses de febrero y marzo de 2010, y se seleccionaron aquellas publicaciones centradas en las consecuencias neurobiológicas relacionadas con la experiencia de abuso sexual infantil de los últimos 10 años (de enero de 1999 a enero de 2010), por los relevantes cambios llevados a cabo en este tema en la última década.
Se consultaron las bases de datos internacionales Medline, Scopus, Psycinfo e ISI Web of Science, utilizando los siguientes términos: (consequences OR effects) (consecuencias OR efectos) AND (sexual abuse OR child sexual abuse) (abuso sexual OR abuso sexual infantil) AND (neurobiological OR neurobiology OR biology OR endocrine) (neurobiológico OR neurobiología OR biología OR endocrino) AND (hippocampus OR amygdala) (hipocampo OR amígdala). Como complemento a lo anterior también se examinaron las listas de referencias de los estudios publicados acerca de las consecuencias neurobiológicas de la victimización en la infancia, especialmente revisiones sobre el tema.
Criterios de inclusión y exclusiónSe revisaron los resultados de cada búsqueda y sólo se incluyeron artículos empíricos, no revisiones de artículos. Los artículos incluidos podían estar escritos en español, dada la importancia de considerar trabajos en esta lengua en una revisión dirigida a población hispanoparlante, o inglés, idioma en que se publican la mayoría de los trabajos empíricos. Se incluyeron trabajos cuyas muestras estuvieran formadas exclusivamente por casos de abuso sexual infantil, o por casos de malos tratos infantiles que contuvieran subgrupos de abuso sexual.
Como criterio de exclusión, se descartaron todos aquellos estudios en cuyo título o resumen no se incluyeran los temas de la revisión. Asimismo, tampoco se incluyeron los que hacían referencia a temas relacionados, pero no directamente vinculados, como la violencia sexual en la edad adulta, o las consecuencias psicológicas del abuso sexual infantil.
Análisis de la revisión de la literatura científicaSe tuvieron en cuenta diferentes variables de los trabajos incluidos, como son el tipo de alteraciones analizadas en el estudio (neuroendocrinas, estructurales, funcionales o neuropsicológicas) y sus principales hallazgos; la existencia de grupo experimental y de grupo control; el tamaño muestral de cada grupo; las características de la muestra experimental (p. ej., casos de abuso sexual infantil o casos de maltrato, incluyendo el abuso sexual como subgrupo); el sexo de los participantes y el grupo de edad (mayores o menores de 18 años).
La revisión de las publicaciones se llevó a cabo por los autores del presente estudio, de forma independiente y con un valor de acuerdo inicial kappa del 97,05%. En los pocos casos en que se produjo discrepancia, se llegó finalmente a un consenso.
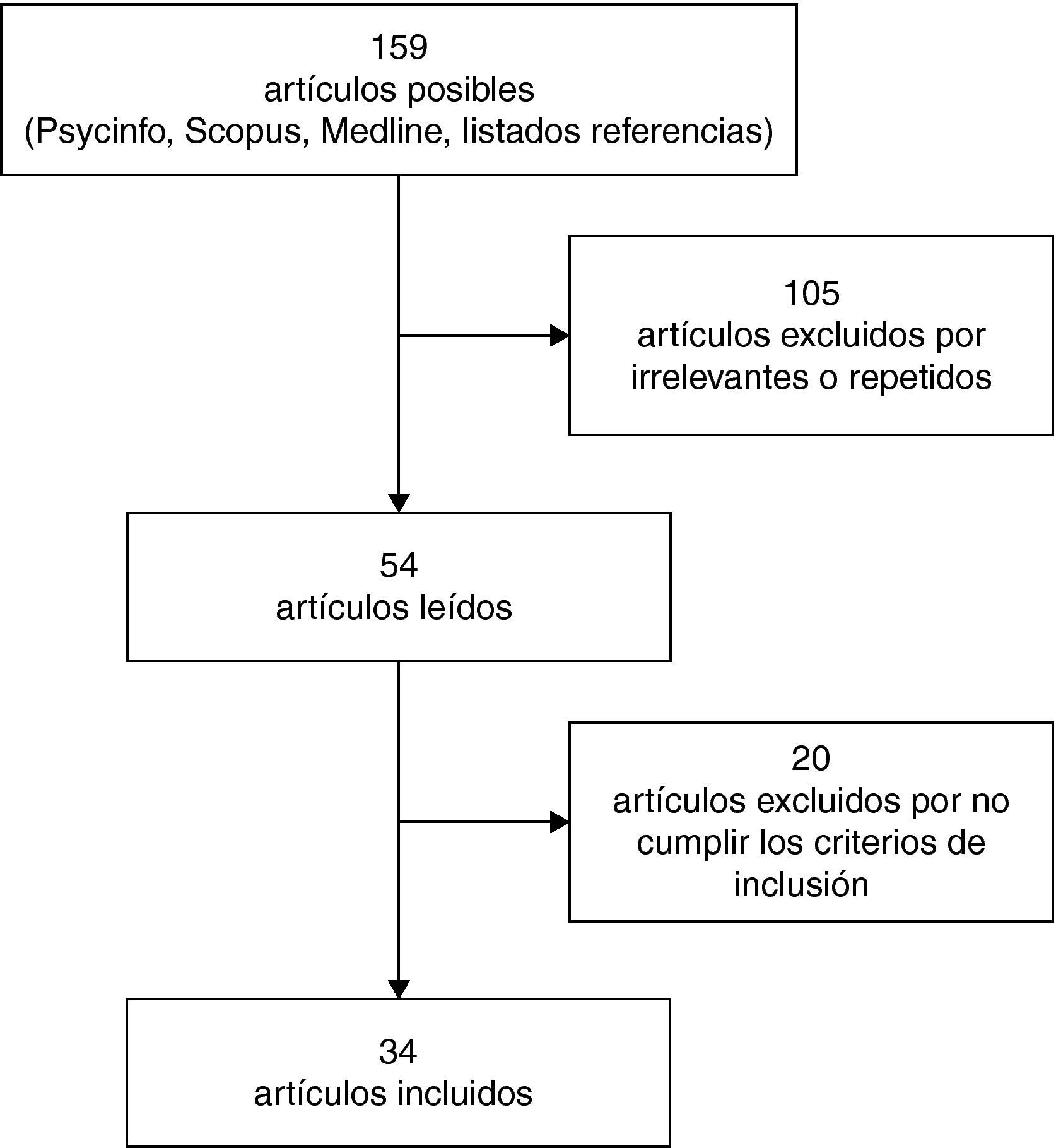
ResultadosSe identificaron 159 artículos, de los cuales tras su revisión se seleccionaron 34 (figura 1). Los estudios revisados son, principalmente, trabajos relativos a las alteraciones neuroendocrinas (11 estudios, un 32,3% de los incluidos) y estructurales (14 estudios, un 41,2% de los incluidos) que se han vinculado con la experiencia de maltrato y abuso sexual infantil, así como en menor medida a alteraciones funcionales (4 estudios, un 11,8% de los incluidos) y neuropsicológicas (5 estudios, un 14,7% de los incluidos). Cabe destacar que algunos estudios analizan tanto los efectos del maltrato infantil sobre la estructura como sobre la función cerebral, por lo que los porcentajes referidos a los estudios no son mutuamente excluyentes. En la tabla 1 se presentan los estudios que han mostrado resultados significativos al comparar grupos de víctimas.
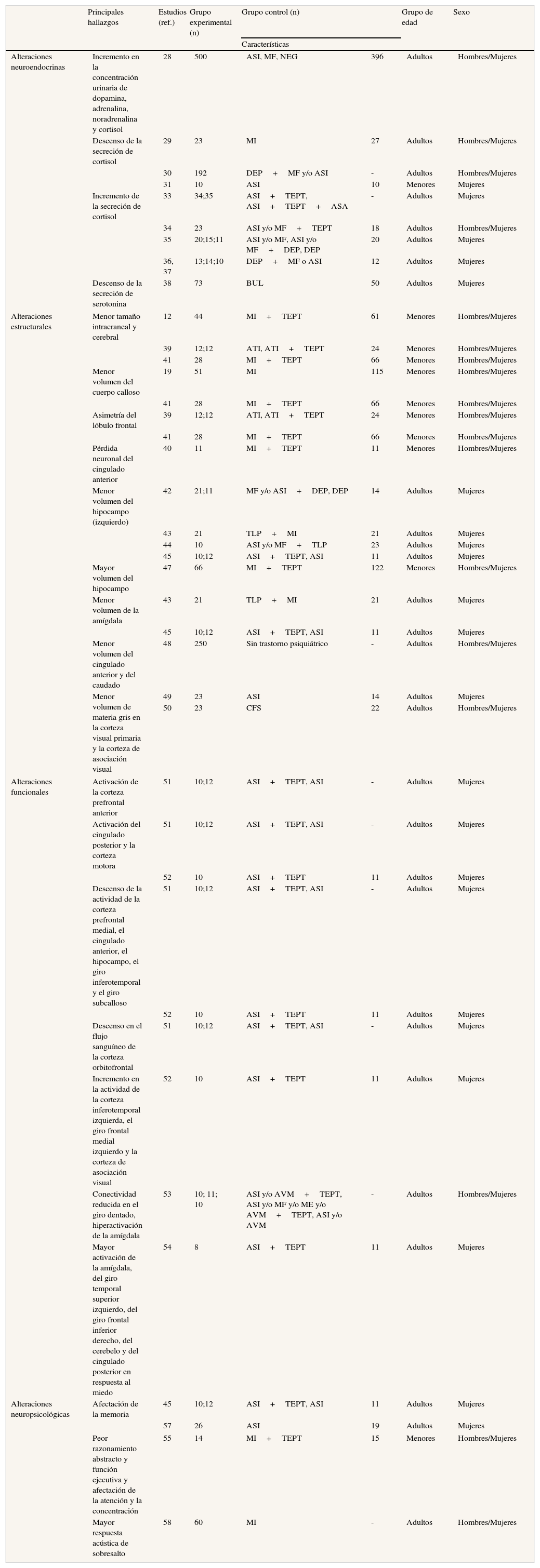
Consecuencias neurobiológicas del abuso sexual infantil (revisión sistemática de artículos publicados entre 1999 y 2010).
| Principales hallazgos | Estudios (ref.) | Grupo experimental (n) | Grupo control (n) | Grupo de edad | Sexo | ||
| Características | |||||||
| Alteraciones neuroendocrinas | Incremento en la concentración urinaria de dopamina, adrenalina, noradrenalina y cortisol | 28 | 500 | ASI, MF, NEG | 396 | Adultos | Hombres/Mujeres |
| Descenso de la secreción de cortisol | 29 | 23 | MI | 27 | Adultos | Hombres/Mujeres | |
| 30 | 192 | DEP+MF y/o ASI | - | Adultos | Hombres/Mujeres | ||
| 31 | 10 | ASI | 10 | Menores | Mujeres | ||
| Incremento de la secreción de cortisol | 33 | 34;35 | ASI+TEPT, ASI+TEPT+ASA | - | Adultos | Mujeres | |
| 34 | 23 | ASI y/o MF+TEPT | 18 | Adultos | Hombres/Mujeres | ||
| 35 | 20;15;11 | ASI y/o MF, ASI y/o MF+DEP, DEP | 20 | Adultos | Mujeres | ||
| 36, 37 | 13;14;10 | DEP+MF o ASI | 12 | Adultos | Mujeres | ||
| Descenso de la secreción de serotonina | 38 | 73 | BUL | 50 | Adultos | Mujeres | |
| Alteraciones estructurales | Menor tamaño intracraneal y cerebral | 12 | 44 | MI+TEPT | 61 | Menores | Hombres/Mujeres |
| 39 | 12;12 | ATI, ATI+TEPT | 24 | Menores | Hombres/Mujeres | ||
| 41 | 28 | MI+TEPT | 66 | Menores | Hombres/Mujeres | ||
| Menor volumen del cuerpo calloso | 19 | 51 | MI | 115 | Menores | Hombres/Mujeres | |
| 41 | 28 | MI+TEPT | 66 | Menores | Hombres/Mujeres | ||
| Asimetría del lóbulo frontal | 39 | 12;12 | ATI, ATI+TEPT | 24 | Menores | Hombres/Mujeres | |
| 41 | 28 | MI+TEPT | 66 | Menores | Hombres/Mujeres | ||
| Pérdida neuronal del cingulado anterior | 40 | 11 | MI+TEPT | 11 | Menores | Hombres/Mujeres | |
| Menor volumen del hipocampo (izquierdo) | 42 | 21;11 | MF y/o ASI+DEP, DEP | 14 | Adultos | Mujeres | |
| 43 | 21 | TLP+MI | 21 | Adultos | Mujeres | ||
| 44 | 10 | ASI y/o MF+TLP | 23 | Adultos | Mujeres | ||
| 45 | 10;12 | ASI+TEPT, ASI | 11 | Adultos | Mujeres | ||
| Mayor volumen del hipocampo | 47 | 66 | MI+TEPT | 122 | Menores | Hombres/Mujeres | |
| Menor volumen de la amígdala | 43 | 21 | TLP+MI | 21 | Adultos | Mujeres | |
| 45 | 10;12 | ASI+TEPT, ASI | 11 | Adultos | Mujeres | ||
| Menor volumen del cingulado anterior y del caudado | 48 | 250 | Sin trastorno psiquiátrico | - | Adultos | Hombres/Mujeres | |
| Menor volumen de materia gris en la corteza visual primaria y la corteza de asociación visual | 49 | 23 | ASI | 14 | Adultos | Mujeres | |
| 50 | 23 | CFS | 22 | Adultos | Hombres/Mujeres | ||
| Alteraciones funcionales | Activación de la corteza prefrontal anterior | 51 | 10;12 | ASI+TEPT, ASI | - | Adultos | Mujeres |
| Activación del cingulado posterior y la corteza motora | 51 | 10;12 | ASI+TEPT, ASI | - | Adultos | Mujeres | |
| 52 | 10 | ASI+TEPT | 11 | Adultos | Mujeres | ||
| Descenso de la actividad de la corteza prefrontal medial, el cingulado anterior, el hipocampo, el giro inferotemporal y el giro subcalloso | 51 | 10;12 | ASI+TEPT, ASI | - | Adultos | Mujeres | |
| 52 | 10 | ASI+TEPT | 11 | Adultos | Mujeres | ||
| Descenso en el flujo sanguíneo de la corteza orbitofrontal | 51 | 10;12 | ASI+TEPT, ASI | - | Adultos | Mujeres | |
| Incremento en la actividad de la corteza inferotemporal izquierda, el giro frontal medial izquierdo y la corteza de asociación visual | 52 | 10 | ASI+TEPT | 11 | Adultos | Mujeres | |
| Conectividad reducida en el giro dentado, hiperactivación de la amígdala | 53 | 10; 11; 10 | ASI y/o AVM+TEPT, ASI y/o MF y/o ME y/o AVM+TEPT, ASI y/o AVM | - | Adultos | Hombres/Mujeres | |
| Mayor activación de la amígdala, del giro temporal superior izquierdo, del giro frontal inferior derecho, del cerebelo y del cingulado posterior en respuesta al miedo | 54 | 8 | ASI+TEPT | 11 | Adultos | Mujeres | |
| Alteraciones neuropsicológicas | Afectación de la memoria | 45 | 10;12 | ASI+TEPT, ASI | 11 | Adultos | Mujeres |
| 57 | 26 | ASI | 19 | Adultos | Mujeres | ||
| Peor razonamiento abstracto y función ejecutiva y afectación de la atención y la concentración | 55 | 14 | MI+TEPT | 15 | Menores | Hombres/Mujeres | |
| Mayor respuesta acústica de sobresalto | 58 | 60 | MI | - | Adultos | Hombres/Mujeres | |
n: tamaño de la muestra; ASI: abuso sexual infantil; MF: maltrato físico; MI: maltrato infantil; NEG: negligencia; DEP: depresión; TEPT: trastorno por estrés postraumático; VSA: victimización sexual en la edad adulta; BUL: bulimia; ATI: acontecimientos traumáticos en la infancia; TLP: trastorno límite de la personalidad; ME: maltrato emocional; CFS: castigo físico severo; AVM: accidente vehículo motor. Sólo se han incluido en la tabla aquellos estudios que obtuvieron diferencias significativas entre grupos.
Uno de los sistemas neurobiológicos que se ven especialmente afectados por la experiencia de abuso sexual infantil es el eje neuroendocrino hipotalámico-hipofisario-adrenal, lo que supone un fracaso en la capacidad de alostasis del individuo, especialmente en aquellas víctimas que presentan trastorno por estrés postraumático. Concretamente, disregulaciones en el funcionamiento de este eje conllevan mayores concentraciones urinarias de dopamina, noradrenalina, adrenalina y cortisol. Así lo han encontrado Widom et al29 en víctimas ya adultas de abuso sexual infantil, al compararlas con controles de la misma edad, etnia, estatus socioecónomico y estructura familiar. En general, esta alteración en la regulación del eje hipotalámico-hipofisario-adrenal, y por consiguiente en la liberación de hormona liberadora de corticotropina, se encuentra repetidamente en la literatura, si bien estudios realizados por otros autores con muestras similares de maltrato infantil han obtenido, opuestamente, una menor concentración de cortisol en estas víctimas30-32. La importancia de esta hormona en la presencia o ausencia de estrés es cabal, debido a su relación con el desarrollo de psicopatología en situaciones estresantes33, tanto en hombres como en mujeres.
En este sentido, se ha sugerido la posibilidad de que diferentes formas de maltrato pueden conllevar diferentes efectos biológicos34, e incluso que las posteriores experiencias traumáticas en la vida de estos individuos pueden explicar las diferentes consecuencias psicobiológicas35.
Las disfunciones en el eje hipotalámico-hipofisario-adrenal también parecen confirmarse en otros trabajos. La concentración de cortisol ante una tarea cognitivamente estresante, tanto en el período de anticipación como durante la tarea, en víctimas adultas con diagnóstico de trastorno por estrés postraumático y experiencia de maltrato infantil, parece ser significativamente más alta que en no víctimas sin diagnóstico, estableciéndose esta elevación en un 63%36. Se ha sugerido una sensibilización de este eje y de la respuesta autónoma al estrés, que aumenta el riesgo de desarrollar determinados trastornos psiquiátricos, tales como trastornos de ansiedad, depresión o trastorno por estrés postraumático37-40, especialmente tras la vivencia de otros estresores añadidos en la edad adulta41.
En relación a los sistemas de neurotransmisión, un reciente estudio llevado a cabo con muestras clínicas, en concreto en mujeres con trastornos de la conducta alimentaria, también ha hallado una elevación de la serotonina en las víctimas de abuso sexual infantil al compararlas con grupos de no víctimas42.
Alteraciones estructuralesOtra importante área de estudio dentro de las consecuencias neurobiológicas es la posible influencia de la experiencia de maltrato y abuso sexual infantil en la estructura del cerebro, por ejemplo en el tamaño del hipocampo, el volumen cerebral, el volumen intracraneal y el volumen de los ventrículos laterales o de las cortezas prefrontal y cingular anterior. El estudio de De Bellis et al12 es una de las escasas investigaciones sobre este tema realizadas con víctimas infantiles de malos tratos, incluyendo el abuso sexual. Los autores apreciaron un menor tamaño intracraneal (7%) y cerebral (8%) en estas víctimas que en el grupo control. Los resultados indicaron que el volumen intracraneal se correlacionaba positivamente y de forma significativa con la edad de inicio del maltrato (con un menor tamaño craneal en las víctimas de malos tratos más jóvenes), así como negativamente con la duración de este maltrato (con un menor tamaño intracraneal en las víctimas de malos tratos más duraderos), y los autores concluyen que el maltrato infantil, incluyendo la violencia física, la negligencia, la victimización sexual y la exposición a la violencia, parece influir de forma adversa en el desarrollo cerebral de las víctimas. Otros estudios, utilizando muestras de diferentes tipos de maltrato, obtuvieron resultados similares al evaluar el cuerpo calloso de víctimas de negligencia física19, hallaron una asimetría reducida en el lóbulo frontal y también un menor tamaño cerebral general en las víctimas de distintos acontecimientos traumáticos en la infancia (maltrato emocional, abuso sexual, negligencia física, exposición a violencia, separación y pérdidas)43, pérdida neuronal en el cingulado anterior (víctimas de abuso sexual, maltrato físico y exposición a violencia)44, y constataron que la experiencia de violencia en la infancia altera el desarrollo cerebral, especialmente el sistema límbico45.
Respecto a una posible influencia de la experiencia de maltrato infantil en otra estructura límbica, como es el tamaño del hipocampo de estas víctimas, estudios llevados a cabo con resonancia magnética y tomografía por emisión de positrones han hallado un volumen del hipocampo izquierdo entre un 5% y un 18% menor en las víctimas adultas de maltrato infantil, incluyendo la experiencia de abuso sexual, en comparación con grupos control46,47, y un volumen de la amígdala significativamente menor47,48, así como la relación de estas consecuencias con el desarrollo de diversas afecciones tales como el trastorno límite de la personalidad y el trastorno por estrés postraumático48,49. Este mismo efecto en el tamaño del hipocampo en las víctimas de malos tratos en la infancia no se ha constatado en muestras de adultos jóvenes50 ni en estudios con menores12,43,44,51.
En esta línea, el trabajo de Cohen et al52 muestra un menor tamaño del córtex cingulado anterior y del núcleo caudado, de aproximadamente un 2% a un 5%, en los adultos víctimas de acontecimientos traumáticos en la infancia, entre ellos el maltrato y el abuso sexual.
También se ha encontrado que el volumen de materia gris en las mujeres víctimas de abuso sexual en la infancia, en la zona del córtex visual primario y del córtex de asociación visual, tanto derecho como izquierdo, es entre un 13% y un 18% menor, y este resultado estaba influido por la duración del abuso53. Similares resultados se han obtenido con víctimas de otros tipos de violencia, como el castigo físico corporal54.
Alteraciones funcionalesEn línea con estos estudios, Bremner et al55,56, utilizando la tomografía por emisión de positrones en su trabajo, han observado que las mujeres víctimas de abuso sexual infantil con diagnóstico de trastorno por estrés postraumático presentan una respuesta neuronal generalizada, con una mayor activación del cerebelo, el polo temporal, el giro frontal inferior izquierdo y el tálamo, ante la presentación de una breve historia relacionada con el recuerdo del abuso sexual, independientemente de su estado psiquiátrico54, así como descensos en el flujo sanguíneo en extensas áreas, que incluyen la corteza orbitofrontal, la corteza cingulada anterior y la corteza prefrontal medial (áreas de Brodmann 25, 32 y 9), el hipocampo izquierdo y el giro fusiforme/giro inferotemporal, con una activación aumentada en la corteza cingulada posterior, la corteza inferotemporal izquierda, el giro frontal medial izquierdo y en las cortezas motoras y de asociación visual, ante la memorización de palabras con connotaciones emocionales frente a palabras neutras56. Estudios más recientes, como el de Lanius et al57, han comparado la actividad cerebral en una muestra de mujeres que habían padecido alguna forma de abuso o agresión sexual en diferentes épocas de su vida y en una muestra de controles, en diversas tareas. Los resultados indicaron una conectividad reducida entre diferentes estructuras límbicas, como el giro dentado, y una hiperactivación de la amígdala. Así, el abuso sexual infantil no sólo afecta al desarrollo de diferentes estructuras cerebrales, sino a cómo estas estructuras se relacionan entre ellas e incluso a su funcionamiento en situaciones de condicionamiento y aprendizaje. En este sentido, se ha analizado la activación de la amígdala ante la adquisición de miedo en víctimas de abuso sexual infantil con diagnóstico de trastorno por estrés postraumático asociado, comparándolas con no víctimas sin trastorno, y se ha observado una mayor activación de la amígdala izquierda ante esta situación y una menor función del cingulado anterior ante la extinción del miedo58.
Alteraciones neuropsicológicasLa afectación de procesos básicos como la memoria49 o la atención y la concentración59 en víctimas de maltrato y abuso sexual infantil ha sido constatada en varios trabajos, aunque no en todos los estudios revisados60, lo que apunta a la existencia de deficiencias neuropsicológicas en estas víctimas, incluso en muestras sanas de estudiantes universitarias61.
Se ha observado una mayor respuesta acústica de sobresalto, reflejo subcortical modulado por los mismos sistemas neurales implicados en el trastorno por estrés postraumático, en las víctimas con una elevada frecuencia de abuso sexual y maltrato infantil, al compararlas con víctimas de los mismos malos tratos pero con una menor frecuencia de violencia. Este efecto se mantenía incluso al controlar por el sexo, la edad y los síntomas postraumáticos y depresivos62.
Discusión y conclusionesComo constatan los diversos trabajos publicados al respecto, la vivencia de una experiencia fuertemente estresante, como es el abuso sexual en la infancia, en un período de alta plasticidad neuronal, provoca disregulaciones en el desarrollo neurofisiológico cerebral y un fracaso en la capacidad de retorno del individuo a la normalidad fisiológica o alostasis, lo cual a su vez parece conllevar problemas de relación, disregulación del estado de ánimo y de la conducta, así como múltiples problemas sociales y emocionales63,64.
Se ha observado que, dentro de la experiencia de maltrato infantil, el abuso sexual puede comportar disfunciones y lesiones duraderas en el eje hipotalámico-hipofisario-adrenal, y esto puede implicar dificultades en la víctima para autorregular sus estados afectivos y controlar su propia conducta64. Los estudios confirman la existencia de una relación entre la experiencia de estrés infantil y la sensibilización de este sistema que, especialmente con la vivencia de otros estresores en la edad adulta, conduce a una mayor vulnerabilidad en el desarrollo de síntomas depresivos, ansiedad y otras anormalidades fisiológicas, tales como irregularidades en la cantidad de cortisol secretado65,66 y un menor volumen del hipocampo27,38. Sin embargo, la afectación causada por las experiencias violentas en la infancia no se limita sólo al hipocampo, sino que destacan los trabajos que han observado disfunciones en otras estructuras como el núcleo cingulado anterior o el núcleo caudado, y que muestran que la vulnerabilidad ante el estrés en la infancia se extiende a diversas estructuras cerebrales52.
Siguiendo a Meaney et al18, el maltrato infantil, y dentro de éste la experiencia de abuso sexual, comporta para la víctima una reprogramación o adaptación al medio violento de diversos sistemas cerebrales que, si bien inicialmente pueden ayudarla a autoprotegerse, a largo plazo se convierten en problemáticas para su correcto desarrollo e integración. Más en concreto, parece que la ocurrencia de este tipo de acontecimientos traumáticos durante ventanas específicas del desarrollo afecta a los patrones de metilación de algunos genes relacionados con la respuesta al estrés67. Este fenómeno, conocido como regulación epigenética, podría ser parte de la explicación de los mecanismos psicobiológicos de resiliencia68 frente a episodios traumáticos. Otros autores han investigado la capacidad de resiliencia que pueden conferir algunas variantes genéticas del gen de la monoaminooxidasa A o del transportador de la serotonina frente al maltrato infantil o a los acontecimientos vitales estresantes69,70. Una de las claves de esta resiliencia psicobiológica parece que sería la plasticidad cerebral, y de ahí la importancia de los efectos del maltrato durante el desarrollo68. Así, el estudio de las interacciones de genotipo y ambiente puede ofrecer una prometedora respuesta para explicar estas diferencias individuales respecto a la vulnerabilidad frente a la psicopatología70.
Fortalezas y limitaciones del estudioEl presente estudio supone la primera revisión sobre las consecuencias neurobiológicas del abuso sexual infantil en lengua española publicada hasta el momento, y permite acercar los últimos avances sobre esta reciente línea de investigación a la población hispanoparlante. Al tratarse de una revisión sistemática cuenta con la ventaja de su replicabilidad. Sin embargo, una de las limitaciones de los estudios llevados a cabo en este campo, y por lo tanto de la revisión que se presenta, es la heterogeneidad de las muestras utilizadas, que suelen incluir diferentes tipos de malos tratos, más que centrarse en una forma de violencia específica. Si bien algunos trabajos han constatado que las consecuencias asociadas a la experiencia de maltrato infantil son inespecíficas y no es posible diferenciar consecuencias concretas en función del tipo de maltrato recibido, al menos en el ámbito psicológico71, sería interesante observar si sucede lo mismo con las consecuencias neurobiológicas de este tipo de experiencias, tal y como sugieren algunos estudios32. El presente trabajo, a pesar de ser sistemático, no es un metaanálisis; así, no es posible cuantificar de forma directa los efectos de diferentes formas de maltrato en los diversos tipos de afectaciones que hemos revisado. Futuros trabajos en esta línea deberán tenerlo en cuenta.
Como hemos visto, aunque son escasos los trabajos que hasta ahora han explorado los efectos neurobiológicos del maltrato infantil, y dentro de éste del abuso sexual, se están abriendo prometedoras líneas de investigación. Por ejemplo, conocer cuáles son los efectos de las diferentes formas de maltrato durante el desarrollo y en la edad adulta nos debería permitir desarrollar tratamientos ajustados a las necesidades de cada víctima67. Se hace, pues, necesario considerar el maltrato y el abuso sexual infantil como problemas de salud que afectan a diferentes áreas de la vida de sus víctimas, como son la psicológica, la social, la física y, según los últimos trabajos revisados, la neurobiológica y la neurofisiológica. Este enfoque debería favorecer que los profesionales incrementen su formación sobre este problema y enfocar los programas de intervención y tratamiento a estas víctimas teniendo en cuenta sus múltiples efectos.
Contribuciones de autoríaN. Pereda concibió el estudio y supervisó todos los aspectos de su realización. N. Pereda y D. Gallardo obtuvieron los datos y realizaron los análisis. N. Pereda interpretó los hallazgos y contribuyó a la redacción del primer borrador del manuscrito. Ambos autores aportaron ideas, interpretaron los hallazgos, revisaron los borradores del manuscrito y aprobaron la versión final. N. Pereda es la responsable del artículo.
FinanciaciónEste trabajo ha sido parcialmente subvencionado por la Fundación Alicia Koplowitz y por el proyecto PSI2009-07726 (Ministerio de Ciencia e Innovación).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.