Efectuar una revisión sistemática de estudios originales revisados por pares que contengan datos acerca de la identificación de SARS-CoV-2 en muestras clínicas de líquido amniótico, placenta o membranas, sangre del cordón umbilical y leche humana de mujeres con diagnóstico clínico o confirmado de COVID-19. Para ser incluidos en esta revisión sistemática, los estudios debieron ser aceptados después de la publicación de la guía para el manejo de pacientes con COVID-19 de la Organización Mundial de la Salud (disponible el 13 de marzo de 2020).
ResultadosSe incluyeron 17 estudios en los que se identificaron 143 muestras clínicas (38 de líquido amniótico, 34 de placentas o membranas, 39 de sangre del cordón umbilical y 32 de leche humana), de las cuales nueve resultaron positivas para ARN de SARS-CoV-2 (una de líquido amniótico obtenida antes de romper las membranas; seis de placenta o membranas, aunque los autores indican la posibilidad de contaminación por sangre materna en tres de ellas; y dos de leche humana).
ConclusionesSiguiendo nuestros criterios de búsqueda no encontramos estudios que demuestren la detección de SARS-CoV-2, a la par del aislamiento viral y la evaluación de la capacidad infectiva de las partículas virales, en muestras clínicas de líquido amniótico, placenta o membranas, sangre del cordón umbilical y leche humana, de mujeres con diagnóstico clínico o confirmado de COVID-19. Sin embargo, la transmisión vertical no puede descartarse y se requieren estudios de mayor tamaño que empleen idealmente técnicas de localización in situ de ARN y proteína de SARS-CoV-2, así como de aislamiento viral que compruebe la capacidad infectiva de las partículas virales.
To conduct a systematic review of original peer-reviewed studies, containing data on the identification of SARS-CoV-2 in clinical samples of amniotic fluid, placenta or membranes, umbilical cord blood, and human milk, from women with a clinically or confirmed diagnosis of COVID-19. These studies should have been published after the guide for the management of patients with COVID-19 from World Health Organization guide (available in March 13, 2020).
ResultsSeventeen studies were included, in which 143 clinical samples were identified (38 of amniotic fluid; 34 of placentas or membranes; 39 from umbilical cord blood and 32 from human milk). Among the 143 samples, nine were positive for SARS-CoV-2 RNA (one amniotic fluid sample obtained before rupturing the membranes; six samples of placenta or membranes, although authors indicate the possibility of contamination by maternal blood in three of these, and two samples of human milk).
ConclusionsFollowing our search criteria, we found no studies that demonstrate the detection of SARS-CoV-2, in conjunction with viral isolation and the evaluation of the infective capacity of viral particles, in clinical samples of amniotic fluid, placenta or membranes, umbilical cord blood and human milk, from women with a confirmed or clinical diagnosis of COVID-19. However, vertical transmission cannot be ruled out, larger studies are required that ideally locate in situ RNA and protein of SARS-CoV-2, as well as isolation that demonstrate the infective capacity of the viral particles.
Los coronavirus pertenecen a la familia Coronaviridae y son virus con envoltura cuyo genoma es de ARN de cadena sencilla con sentido positivo. Los miembros de esta familia no solo causan enfermedades en los seres humanos, sino también en una amplia diversidad de animales1,2. Los coronavirus que afectan a los humanos son: coronavirus humano-229E (HCoV-229E), HCoV-NL63, HCoV-OC43, HCoV-HKU1, coronavirus del síndrome respiratorio agudo grave (SARS-CoV) y coronavirus del síndrome respiratorio de Oriente Medio (MERS-CoV); los dos últimos con tasas de mortalidad del 10% y el 35%, respectivamente3.
En 2019, un nuevo coronavirus empezó a circular entre los humanos, llamado ahora SARS-CoV-2, causante de la denominada enfermedad por coronavirus 2019 (COVID-19). Sus características patogénicas y de transmisión hicieron que la Organización Mundial de la Salud declarara una emergencia de salud pública de interés internacional en enero de 2020, y el 11 de marzo, dada la propagación y la gravedad de la COVID-19, declaró que estas eran características propias de una pandemia, la primera causada por un coronavirus4.
El SARS-CoV-2 produce un amplio espectro clínico, que va desde casos asintomáticos hasta neumonía grave e infecciones sistémicas con fallo multiorgánico que pueden provocar la muerte5. Si bien en la mayoría de los casos la infección por SARS-CoV-2 genera signos y síntomas en el aparato respiratorio, también se ha informado de episodios diarreicos con baja frecuencia1,6. Se ha estimado que alrededor del 80% de la población con COVID-19 presenta signos y síntomas de leves a moderados que no requieren tratamiento1.
Respecto al periodo de gestación, en una serie de casos que incluyó 43 mujeres embarazadas con COVID-19, el 86% tuvo enfermedad leve, el 9,3% enfermedad grave y el 4,7% enfermedad crítica; porcentajes similares a los descritos en mujeres adultas no embarazadas con COVID-19.7 En un estudio que incluyó 64 casos de mujeres embarazadas con COVID-19, de las cuales 44 tenían enfermedad grave y 20 enfermedad crítica, se reportó un recién nacido, entre 33, con diagnóstico de COVID-19 a las 48 horas de vida, que no mostró signos, ni síntomas de la enfermedad8.
Se ha confirmado que la propagación de persona a persona del SARS-CoV-2 ocurre principalmente a través de gotitas respiratorias producidas por las personas infectadas9. Existe debate acerca de la posible transmisión vertical del SARS-CoV-2, y los consensos y las guías internacionales sobre el manejo de las embarazadas con sospecha o confirmación de infección por SARS-CoV-2 difieren en las recomendaciones sobre el parto y la lactancia10,11. Debido a la relevancia del tema se han realizado diversas revisiones sistemáticas de la literatura, entre las que destacan la de Zaigham y Andersson12 y la de Lamouroux13. La primera de estas incluye 18 trabajos en inglés o chino publicados entre el 8 de diciembre de 2019 y el 1 de abril de 2020, con datos de 108 embarazos. Los autores concluyen que en la literatura analizada no se encuentra evidencia clara de transmisión vertical del SARS-CoV-2 de la madre al feto, pero no se puede excluir que se produzca12. La segunda revisión incluye 12 trabajos publicados entre el 10 de febrero y el 4 de abril de 2020 que reúnen 68 partos y 71 recién nacidos de madres con COVID-19, así como 10 muestras clínicas de líquido amniótico, 5 de placenta y 10 de leche humana, las cuales dieron negativo para SARS-CoV-213.
En el contexto de la pandemia por COVID-19 se ha generado nueva evidencia tras la publicación de la guía de la Organización Mundial de la Salud, el 13 de marzo de 202014, por lo que efectuamos una revisión sistemática de la literatura en PubMed de estudios revisados por pares publicados entre el 27 de marzo y el 21 de mayo de 2020, enfocándonos en aquellos trabajos que incluyeran análisis de muestras clínicas de líquido amniótico, placenta o membranas, sangre del cordón umbilical y leche humana de mujeres con diagnóstico confirmado por laboratorio o clínico de COVID-19.
MétodoSe realizó una búsqueda en PubMed de artículos originales revisados por pares disponibles entre el 27 de marzo de 2020 y el 21 de mayo de 2020, en inglés o español. Se utilizaron los siguientes términos de búsqueda: ‘COVID-19’, ‘SARS-CoV-2’, ‘human milk’, ‘breastmilk’, ‘breast milk’, ‘amniotic fluid’, ‘placenta’, ‘umbilical cord blood’, ‘vertical transmision’ y ‘miscarriage’. Se siguieron las recomendaciones del grupo PRISMA en términos de identificación, detección, elegibilidad y criterios de inclusión15. Las dos autoras evaluaron los títulos y los resúmenes de los estudios acorde con el objetivo de este trabajo, y una vez detectados los estudios revisaron la versión completa para verificar si eran elegibles. En cada referencia se verificaron los datos acerca de participantes, exposiciones, métodos y resultados. Los criterios de inclusión para los estudios fueron:
- •
Datos primarios revisados por pares producidos a partir de cualquier tipo de diseño de estudio.
- •
Que las participantes fueran embarazadas o madres con infante(s).
- •
Confirmación mediante laboratorio de infección por SARS-CoV-2 o diagnóstico clínico de COVID-19 en la madre.
- •
Datos de identificación viral o de aislamiento viral en cualquiera de las siguientes muestras clínicas: líquido amniótico, placenta o membranas, sangre del cordón umbilical o leche humana.
Se identificaron 107 registros, de los cuales dos condujeron a la misma referencia y uno indicó una ruta de acceso no válida. Se revisaron 68 artículos originales y se excluyeron 50 por no cumplir con los criterios de inclusión y uno por no coincidir los datos de la tabla con el texto; finalmente, 17 estudios se incluyeron en el resumen cualitativo.
En los estudios incluidos se identificó la etapa en que la madre tuvo la confirmación de la infección por SARS-CoV-2 o el diagnóstico clínico de COVID-19, el pronóstico del binomio madre-hijo/a, los resultados del análisis de SARS-CoV-2 del infante, y las muestras clínicas de líquido amniótico, placenta o membranas, sangre del cordón umbilical o leche humana. De acuerdo con la guía GRADE, la calidad de todos los estudios incluidos en la síntesis cualitativa fue muy baja, debido a que tuvieron un diseño observacional16.
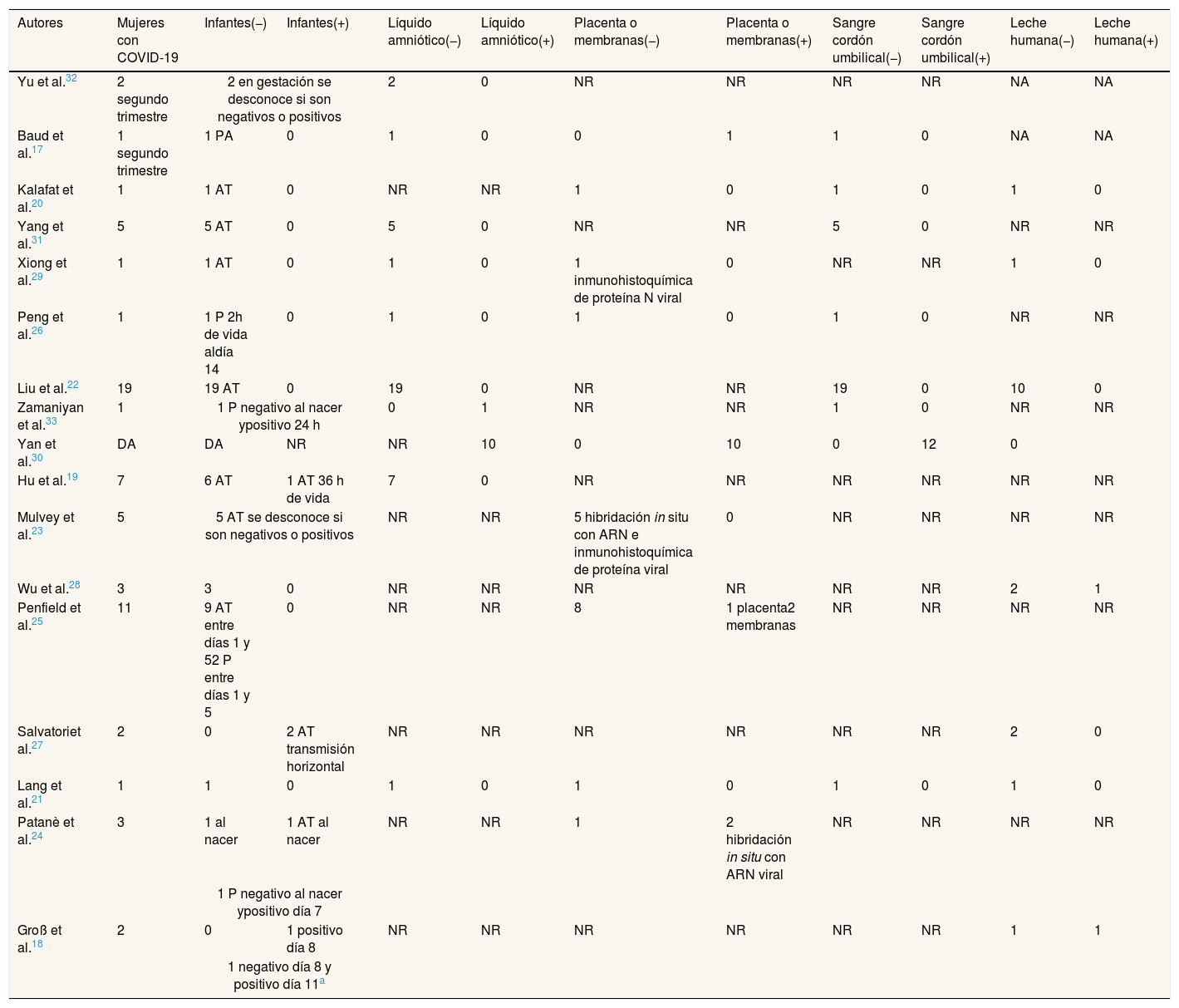
ResultadosSe incluyeron 17 estudios en el análisis cualitativo, todos con diseño observacional y publicados en inglés17–33. En ellos se identificaron 96 binomios madre-hijo/a, de los cuales 65 cumplieron con los criterios de inclusión (tabla 1). Se eliminaron 19, 10 y 2 binomios madre-hijo/a de los trabajos de Patanè et al.24, Wu et al.28 y Yang et al.31, respectivamente, por carecer de análisis de muestras clínicas de líquido amniótico, placenta o membranas, sangre del cordón umbilical o leche humana. En el trabajo de Yan et al.30 los datos se presentan en forma agrupada, por lo que no pudimos determinar el número de mujeres que se sometieron a los análisis para identificar la presencia de SARS-CoV-2 en líquido amniótico, placenta o membranas, sangre del cordón umbilical o leche humana. En un estudio identificamos dos casos de mujeres embarazadas32; en el resto de los estudios, el parto ya había ocurrido (tabla 1).
Resultados de los estudios revisados de madres con diagnóstico de COVID-19
| Autores | Mujeres con COVID-19 | Infantes(−) | Infantes(+) | Líquido amniótico(−) | Líquido amniótico(+) | Placenta o membranas(−) | Placenta o membranas(+) | Sangre cordón umbilical(−) | Sangre cordón umbilical(+) | Leche humana(−) | Leche humana(+) |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Yu et al.32 | 2 segundo trimestre | 2 en gestación se desconoce si son negativos o positivos | 2 | 0 | NR | NR | NR | NR | NA | NA | |
| Baud et al.17 | 1 segundo trimestre | 1 PA | 0 | 1 | 0 | 0 | 1 | 1 | 0 | NA | NA |
| Kalafat et al.20 | 1 | 1 AT | 0 | NR | NR | 1 | 0 | 1 | 0 | 1 | 0 |
| Yang et al.31 | 5 | 5 AT | 0 | 5 | 0 | NR | NR | 5 | 0 | NR | NR |
| Xiong et al.29 | 1 | 1 AT | 0 | 1 | 0 | 1 inmunohistoquímica de proteína N viral | 0 | NR | NR | 1 | 0 |
| Peng et al.26 | 1 | 1 P 2h de vida aldía 14 | 0 | 1 | 0 | 1 | 0 | 1 | 0 | NR | NR |
| Liu et al.22 | 19 | 19 AT | 0 | 19 | 0 | NR | NR | 19 | 0 | 10 | 0 |
| Zamaniyan et al.33 | 1 | 1 P negativo al nacer ypositivo 24 h | 0 | 1 | NR | NR | 1 | 0 | NR | NR | |
| Yan et al.30 | DA | DA | NR | NR | 10 | 0 | 10 | 0 | 12 | 0 | |
| Hu et al.19 | 7 | 6 AT | 1 AT 36 h de vida | 7 | 0 | NR | NR | NR | NR | NR | NR |
| Mulvey et al.23 | 5 | 5 AT se desconoce si son negativos o positivos | NR | NR | 5 hibridación in situ con ARN e inmunohistoquímica de proteína viral | 0 | NR | NR | NR | NR | |
| Wu et al.28 | 3 | 3 | 0 | NR | NR | NR | NR | NR | NR | 2 | 1 |
| Penfield et al.25 | 11 | 9 AT entre días 1 y 52 P entre días 1 y 5 | 0 | NR | NR | 8 | 1 placenta2 membranas | NR | NR | NR | NR |
| Salvatoriet al.27 | 2 | 0 | 2 AT transmisión horizontal | NR | NR | NR | NR | NR | NR | 2 | 0 |
| Lang et al.21 | 1 | 1 | 0 | 1 | 0 | 1 | 0 | 1 | 0 | 1 | 0 |
| Patanè et al.24 | 3 | 1 al nacer | 1 AT al nacer | NR | NR | 1 | 2 hibridación in situ con ARN viral | NR | NR | NR | NR |
| 1 P negativo al nacer ypositivo día 7 | |||||||||||
| Groß et al.18 | 2 | 0 | 1 positivo día 8 | NR | NR | NR | NR | NR | NR | 1 | 1 |
| 1 negativo día 8 y positivo día 11a | |||||||||||
AT: a término; DA: datos agrupados; h: hora; NA: no aplica; NR: no reportado; P: prematuro; PA: producto de aborto; (+) Identificación positiva de SARS-CoV-2; (-) No se identifica SARS-CoV-2.
En todos los trabajos identificamos 143 muestras que fueron analizadas para verificar la presencia de SARS-CoV-2: 38 de líquido amniótico, 34 de placenta o membranas, 39 de sangre del cordón umbilical y 32 de leche humana (tabla 1). De las 143 muestras analizadas, nueve mujeres dieron positivo para SARS-CoV-2 al menos una vez en una muestra de líquido amniótico obtenida antes de romper las membranas33, en seis muestras de placenta o membranas17,24,25 y en dos muestras de leche humana18,28 (tabla 1).
Yu et al.32 reportan dos casos de mujeres embarazadas con diagnóstico de COVID-19 en el primer trimestre. Durante el segundo trimestre de embarazo, 3 días después de tener resultados negativos para SARS-CoV-2 en una muestra faríngea por reacción en cadena de la polimerasa (PCR) y positivos para IgM en suero, se sometieron a análisis de líquido amniótico; los resultados de las pruebas PCR y de IgM e IgG para SARS-CoV-2 de ambas pacientes fueron negativos32. Baud et al.17 reportaron un producto de aborto que dio negativo para ARN de SARS-CoV-2, cuya madre dio positivo en muestras de hisopo nasofaríngeo y de placenta.
En un análisis retrospectivo realizado en 25 hospitales de China entre el 20 de enero y el 24 de marzo de 2020 se reporta un deceso neonatal, nacido de una madre con COVID-1930. Este neonato fue un varón nacido a las 35+2 semanas de gestación mediante cesárea que presentó asfixia grave, APGAR 1-1 al minuto y a los 5 minutos, fue tratado con ventilación invasiva y murió en las 2 horas posteriores al nacimiento30. Su madre desarrolló neumonía grave y choque séptico, y requirió ingreso en la unidad de cuidados intensivos para ventilación invasiva30. Este análisis retrospectivo incluye 116 embarazadas con COVID-19, 98 partos con producto único y un parto gemelar; entre los/las 100 recién nacidos/as, a 86 se les efectuaron análisis para detectar ARN del SARS-CoV-2 en muestras faríngeas, y en todos los casos los resultados fueron negativos; en diez casos se realizaron análisis de muestras de líquido amniótico y de sangre del cordón umbilical, cuyos resultados fueron negativos30. En seis madres se analizaron muestras de secreción vaginal y fueron negativas, y 12 muestras de leche humana también fueron negativas30.
Entre los/las 65 neonatos/as identificados/as, ocho fueron positivos/as para SARS-CoV-2 en algún momento18,19,24,27,33 (tabla 1). Zamaniyan et al.33 describen el caso de un infante prematuro nacido sin incidentes, con un peso de 2,350kg y APGAR 8-9 al minuto y a los 5 minutos. El infante fue recibida por personal que usó protección, incluyendo mascarilla N95, y se mantuvo aislada sin contacto con su madre. Al nacer desarrolló fiebre y tuvo un resultado negativo al virus en pruebas con muestras de hisopo nasal y faríngeo; sin embargo, a las 24 horas y a la semana tuvo resultados positivos para la identificación del virus, pero los autores la reportan con buen pronóstico. Su madre, de 22 años, ingresó el 7 de marzo en el servicio de emergencias cursando la semana 32 de gestación, tenía antecedentes de hipotiroidismo controlado y había presentado disnea, mialgia, anorexia, náuseas y fiebre durante los 4 días anteriores33. Dado el cuadro grave de COVID-19, el 15 de marzo fue sometida a operación cesárea, su condición empeoró dramáticamente y murió el 26 de marzo. La muestra de líquido amniótico que se tomó antes de romper las membranas resultó positiva para el virus, pero la muestra de sangre del cordón umbilical resultó negativa33.
Hu et al.19 reportan un caso de un neonato que a las 36 horas de vida tuvo resultado positivo de identificación viral. Este niño fue aislado durante 14 días, no desarrolló síntomas clínicos, ni evidencia de la enfermedad, tuvo resultados normales en las pruebas bioquímicas sistemáticas y los recuentos de células sanguíneas en el primer y el tercer días de vida, así como las radiografías de tórax y las ecografías cerebrales realizadas el primer día de vida, fueron normales. Estos autores mencionan que su madre tuvo labor de parto previa a la cesárea, por lo que no se descarta la ruta transcervical; sin embargo, no se reporta el resultado de la identificación viral en el cuello uterino.
Salvatori et al.27 describen dos binomios con resultados positivos para SARS-CoV-2, tanto la madre como el infante, «probablemente infectados al mismo tiempo por una tercera persona», cuyas muestras de leche humana resultaron negativas para el virus y ninguno necesitó admisión en la unidad de cuidados intensivos.
En 11 binomios madre-hijo/a analizados por Penfield et al.25 se reportó una muestra de placenta y dos de membrana positivas para ARN del SARS-CoV-2. Las muestras placentarias se obtuvieron con hisopo de la superficie amniótica después de limpiar la sangre materna, y las de membrana, entre el amnios y el corion después de la separación manual de las membranas. Los autores sostienen que pudo haber ocurrido una mezcla de líquido y tejido materno-fetal en el momento del parto y que, por lo tanto, el origen del ARN del SARS-CoV-2 detectado en la placenta y las membranas no es claro y podría representar contaminación por sangre materna, líquido amniótico o infección por SARS-CoV-2 de las membranas y el saco amniótico. Ninguno de los lactantes en este estudio dio positivo para SARS-CoV-2 entre el primer y el quinto días de vida, y tampoco tuvieron síntomas de COVID-19.
Los estudios de Mulvey et al.23, Xiong et al.29 y Patanè et al.24 resultan de particular interés en términos de los exámenes efectuados en tejidos placentarios provenientes de madres con COVID-19. Mulvey et al.23 realizaron análisis de hibridación in situ para ARN de SARS-CoV-2 y localización inmunohistoquímica de proteína viral, y Xiong et al.29 examinaron mediante inmunohistoquímica la proteína N viral; en ambos trabajos se obtuvieron resultados negativos. En cambio, Patanè et al.24, mediante hibridación in situ para ARN de SARS-CoV-2, identifican en el sincitiotrofoblasto la presencia del virus en el lado fetal.
Finalmente, de 32 muestras de leche materna identificamos dos casos que dieron positivo para ARN del SARS-CoV-218,28. El primer caso positivo de detección en leche humana fue reportado en China por Wu et al.28, aunque una muestra obtenida dos días después dio negativo. Estos autores sostienen que la posibilidad de transmisión viral a través de la leche materna no puede ser excluida. Por otro lado, Groß et al.18 reportan un caso en el que se detectó ARN del SARS-CoV-2 en leche humana a los 10, 12 y 13 días posparto, siendo negativo los días 14 y 25. El recién nacido de este estudio tuvo problemas respiratorios y se le realizó un análisis de ARN del SARS-CoV-2, que resultó positivo a los 11 y 21 días de vida, así como también positivo para virus sincitial respiratorio al día 19. Los autores mencionan que no está claro el modo de transmisión en este recién nacido.
DiscusiónEl SARS-CoV-2 es un virus de reciente circulación en los humanos que ha generado una pandemia rápidamente por su principal forma de transmisión, a través de gotitas de las vías respiratorias9. Inicialmente, la principal vía de entrada del SARS-CoV-2 al cuerpo humano se relacionó con una enfermedad con signos y síntomas respiratorios. Actualmente se conoce que la infección, en algunos casos, puede ser más generalizada debido a la diseminación del virus en el cuerpo1,6. Uno de los principales temas de interés sobre el SARS-CoV-2 es conocer si existen vías de transmisión diferentes a la respiratoria, y sin duda es importante investigar la transmisión vertical. Para comprobar dicha vía, consideramos que por la inmadurez del sistema inmunitario neonatal, así como por el tiempo de incubación y la ruta de transmisión del SARS-CoV-2, los estudios centrados únicamente en neonatos no son suficientes para establecerla. Se requiere que en paralelo se investigue la presencia viral y la capacidad de replicación de las partículas virales en muestras de líquido amniótico, placenta o membranas, sangre del cordón umbilical y leche humana, aplicando estrictas medidas de prevención y control de infecciones durante el proceso de la toma de muestras, el transporte, el almacenamiento y el análisis.
Al momento de escribir esta revisión, a diario se publica nueva información sobre la transmisión del SARS-CoV-2. Aunque los datos actuales son incipientes y limitados, falta información acerca del manejo de las muestras clínicas, así como de los métodos para la estandarización de las pruebas, la transmisión vertical intrauterina no puede excluirse. Mediante la técnica de hibridación in situ con ARN viral se demostró la presencia de SARS-CoV-2 en placenta en el lado fetal24, lo que podría sugerir que el virus se disemina del aparato respiratorio y podría transmitirse de forma transplacentaria.
Considerando el sistema de clasificación y definición de casos para la infección por SARS-CoV-2 en las embarazadas, los fetos y los neonatos propuesto por Shah et al.34, el caso reportado por Zamaniyan et al.33, incluido en la síntesis cualitativa de esta revisión, cumple con uno de los tres criterios propuestos para ser clasificado como una infección congénita confirmada. Estos hallazgos indican la importancia de efectuar estudios que incluyan el seguimiento de los binomios madre-hijo/a clasificados por la etapa del embarazo en la que ocurra la infección, así como por la gravedad de esta, ya que la gravedad podría ser un factor condicionante para la diseminación viral y, en consecuencia, para la transmisión intrauterina.
Por otro lado, en un reporte no revisado por pares disponible el 15 de mayo de 2020, los autores sostienen que han identificado el primer caso confirmado de transmisión transplacentaria de SARS-CoV-2 en una mujer embarazada durante el último trimestre, dado que el líquido amniótico obtenido antes de la rotura de las membranas y durante la cesárea, la placenta, los hisopos nasofaríngeos y rectales neonatales obtenidos durante la primera hora de vida, y muestras de sangre y líquido de lavado broncoalveolar del neonato, resultaron positivos para los genes E y S del SARS-CoV-235. El neonato prematuro con APGAR 4 y 2 al minuto y a los 5 minutos, respectivamente, necesitó reanimación y en el segundo día de vida presentó irritabilidad, hipertonía axial y opistótonos, y los autores sostienen que es el primer caso de infección congénita que se presenta con manifestaciones neurológicas después de mostrar viremia neonatal35. Sin embargo, en este reporte no revisado por pares, según nuestra apreciación, las curvas de amplificación de las muestras de sangre del recién nacido y la de hisopo vaginal parecerían ser compatibles con curvas de amplificación anormales36.
Un artículo describe el caso de una embarazada positiva para SARS-CoV-2 y negativa para IgM/IgG, cuyo neonato fue aislado inmediatamente al nacer y resultó positivo para SARS-CoV-2 a las 16 horas posparto y negativo para IgM/IgG, aunque con la limitante de la falta de evaluación del líquido amniótico, de sangre del cordón umbilical o de tejido placentario37.
Respecto a la transmisión del SARS-CoV-2 por la leche materna, encontramos dos casos de mujeres con detección positiva de ARN viral18,28. En relación con otros virus de la familia Coronaviridae, una revisión de la literatura sostiene que no existe evidencia de transmisión vertical del SARS-CoV y que no se ha detectado el virus en la leche humana38. Dos estudios han indagado la presencia de ARN del SARS-CoV y de anticuerpos en leche humana. El primero reportó la presencia de anticuerpos contra el SARS-CoV, pero no de ARN, en la leche de una mujer infectada a las 19 semanas de gestación; sin embargo, se tomó una sola muestra 131 días después de la aparición de síntomas, no se proporcionaron detalles sobre el método de recogida y el infante no fue examinado para la infección por SARS-CoV-239. El segundo estudio es un informe de un caso de una mujer infectada a las 7 semanas de gestación, cuyas muestras de leche a los 12 y 30 días posparto fueron negativas para anticuerpos contra el SARS-CoV y el recién nacido dio negativo; sin embargo, se desconocen los detalles de la recogida de las muestras de leche40.
Según un trabajo no revisado por pares, no existen estudios acerca de la determinación del MERS-CoV en leche humana41, y tampoco hay reportes clínicos o serológicos de transmisión perinatal42. Existe un reporte de la presencia de MERS-CoV en dromedarios43 y un estudio de una persona probablemente infectada por el consumo de leche cruda de camella44. La Organización Mundial de la Salud recomendó en 2019 evitar el consumo de leche cruda de camella, debido a que potencialmente los animales infectados con MERS-CoV podrían eliminar el virus por la leche45.
El efecto protector de la leche humana es particularmente fuerte contra las enfermedades infecciosas que se previenen mediante la transferencia directa de anticuerpos y otros factores antiinfecciosos46. Un estudio no revisado por pares, disponible el 8 de mayo de 2020, describe la reactividad de 15 muestras de leche materna de mujeres recuperadas con diagnóstico previo de COVID-19 al receptor de dominio de unión de la proteína S del virus SARS-CoV-2, comparándolas con 10 muestras de leche materna obtenidas antes de la pandemia. Mediante ELISA se determinaron las IgA, IgG, IgM e IgA secretora47, y los resultados indican que el 80% de las muestras con diagnóstico previo de COVID-19 tuvieron reactividad para IgA e IgA secretora; los valores promedio de OD del grupo de COVID-19 fueron significativamente mayores para IgA, IgA secretora e IgG, pero no para IgM, en comparación con los valores promedio del grupo prepandémico47. Los autores concluyen que después de la infección, en la mayoría de los casos, existe una fuerte respuesta inmunitaria contra el SARS-CoV-2 mediada por la IgA secretora en la leche humana47. Es interesante que en modelos animales se ha demostrado que la lactancia materna previene la infección por el coronavirus diarreico porcino debido al efecto protector de las IgA e IgG de la leche materna48.
La Organización Mundial de la Salud, en la guía provisional del 13 de marzo de 2020, sostiene que las madres y los/las recién nacidos/as con sospecha o confirmación de COVID-19 deben permanecer juntos, practicar la técnica del contacto piel con piel, el cuidado de la madre canguro e inmediatamente después del nacimiento iniciar la lactancia materna14. La falta del inicio temprano de la lactancia materna, el no practicar el contacto piel con piel tras el nacimiento, así como separar a la madre y el/la recién nacido/a, se han asociado con una corta duración de la lactancia materna, un mayor riesgo de mortalidad neonatal y alteraciones en el microbioma neonatal49. El inicio temprano de la lactancia materna y el contacto piel con piel son intervenciones que proporcionan grandes beneficios a la salud del binomio madre-hijo/a50.
Por otro lado, la separación del binomio madre-hijo/a no garantiza un ambiente libre del virus para el infante. Esta separación hospitalaria es aún más cuestionable en los países con sus servicios de salud saturados y con una población altamente vulnerable, pues parece que no considera la exposición que tendrá el infante cuando sea dado de alta, las condiciones de los hogares, especialmente el hacinamiento, y de la comunidad, debido a las medidas impuestas por el distanciamiento social. En algunos casos la separación puede privar al recién nacido de los beneficios nutricionales e inmunitarios de la leche materna, aunque existe la opción de la extracción. De acuerdo con Tomori et al.51, la separación de las madres con sospecha o confirmación de SARS-CoV-2 y sus infantes puede provocar «un exceso de enfermedades y muertes prevenibles entre los infantes y las mujeres alrededor del mundo» en el contexto de la pandemia.
En resumen, la información relacionada con la posible transmisión del SARS-CoV-2 durante el embarazo se ha reportado en estudios de pequeña escala. De acuerdo con nuestros criterios de búsqueda, encontramos en la literatura un caso grave y fatal de una madre con COVID-19 en la que se detectó ARN viral en el líquido amniótico antes de romper las membranas, y el neonato resultó negativo para la presencia del virus al nacimiento y positivo a la semana33. También se han reportado dos casos de detección de ARN del SARS-CoV-2 en leche humana18,28, pero en nuestro conocimiento no se ha probado la capacidad infectiva de esta. La transmisión vertical debe investigarse, idealmente utilizando técnicas de aislamiento que demuestren la capacidad infectiva de la partícula viral.
Editora responsable del artículoMercedes Carrasco Portiño.
Contribuciones de autoríaC.L. Sampieri realizó la concepción del estudio, el diseño del trabajo, el análisis de los estudios, la interpretación de los estudios y la escritura del artículo. H. Montero realizó el análisis de los estudios, la interpretación de los estudios y la revisión crítica del manuscrito con importantes contribuciones intelectuales. Ambas autoras aprobaron la versión final para su publicación y se hacen responsables y garantes de que todos los aspectos que integran el manuscrito han sido revisados y discutidos entre ellas con la finalidad de que sean expuestos con la máxima precisión e integridad.
FinanciaciónNinguna.
Conflictos de interesesNinguno.