Los médicos no disponen del tiempo ni de los recursos para considerar la evidencia subyacente en las innumerables decisiones que tienen que tomar diariamente. En consecuencia, dependen de las recomendaciones de las guías de práctica clínica. Los paneles de las guías deben considerar todos los criterios relevantes que influyen en una decisión o recomendación de manera estructurada, explícita y transparente, y proporcionar a los médicos recomendaciones factibles. En este artículo describiremos los marcos de la evidencia a la decisión (EtD) para las recomendaciones de práctica clínica. La estructura general de un marco EtD para recomendaciones clínicas es similar a la de los marcos EtD para otras recomendaciones y decisiones, e incluye la formulación de la pregunta, la evaluación de los distintos criterios y las conclusiones. Las recomendaciones clínicas requieren que los criterios se consideren de forma diferente, dependiendo de si se adopta una perspectiva individual o poblacional. Por ejemplo, desde la perspectiva individual, los gastos personales son un aspecto importante a considerar, mientras que desde la perspectiva poblacional son más importantes el uso de recursos (no solo los gastos personales) y el coste-efectividad. Son también importantes desde la perspectiva poblacional la equidad, la aceptabilidad y la factibilidad, mientras que la importancia de estos criterios suele ser limitada en el caso de la perspectiva individual. Los subgrupos específicos para los cuales pueden necesitarse recomendaciones deben estar claramente identificados y considerados con relación a cada criterio, porque los juicios pueden variar entre subgrupos. El siguiente artículo es una traducción del artículo original publicado en British Medical Journal. Los marcos EtD se utilizan actualmente en el Programa de Guías de Práctica Clínica en el Sistema Nacional de Salud, coordinado por GuíaSalud.
Clinicians do not have the time or resources to consider the underlying evidence for the myriad decisions they must make each day and, as a consequence, rely on recommendations from clinical practice guidelines. Guideline panels should consider all the relevant factors (criteria) that influence a decision or recommendation in a structured, explicit, and transparent way and provide clinicians with clear and actionable recommendations. In this article, we will describe the Evidence to Decision (EtD) frameworks for clinical practice recommendations. The general structure of the EtD framework for clinical recommendations is similar to EtD frameworks for other types of recommendations and decisions, and includes formulation of the question, an assessment of the different criteria, and conclusions. Clinical recommendations require considering criteria differently, depending on whether an individual patient or a population perspective is taken. For example, from an individual patient's perspective, out-of-pocket costs are an important consideration, whereas, from a population perspective, resource use (not only out-of-pocket costs) and cost effectiveness are important. From a population perspective, equity, acceptability, and feasibility are also important considerations, whereas the importance of these criteria is often limited from an individual patient perspective. Specific subgroups for which different recommendations may be required should be clearly identified and considered in relation to each criterion because judgments might vary across subgroups. This article is a translation of the original article published in the British Medical Journal. The EtD frameworks are currently used in the Clinical Practice Guideline Programme of the Spanish National Health System, co-ordinated by GuíaSalud.
Los médicos se enfrentan con frecuencia a situaciones con dos o más acciones alternativas. Cada alternativa suele tener ventajas y desventajas distintas, incluidas diferencias en la efectividad, los efectos adversos, los costes y otros factores (criterios). Para tomar una decisión, los médicos se basan en las recomendaciones de las guías de práctica clínica, otras recomendaciones (como las de colegas o expertos) o reglas implícitas para la toma de decisiones, como reglas basadas en la experiencia personal o en lo que hacen otros. Para garantizar la confianza, las guías de práctica clínica las elaboran paneles con conocimiento, perspectivas y destrezas relevantes, están informadas por la mejor evidencia disponible y se desarrollan de una forma sistemática1–4.
En el primer artículo de esta serie describimos los marcos GRADE de la evidencia a la decisión (EtD) y su lógica para distintos tipos de decisiones5. En este segundo artículo describimos el uso de los marcos EtD para las recomendaciones clínicas y la manera en que pueden ayudar a los médicos y los pacientes que las usan.
Utilizaremos el escenario de la tabla 1 para ilustrar el uso de los marcos EtD para las recomendaciones clínicas6–8. La pregunta planteada esta vez fue: «¿Deben cambiarse a dabigatrán los pacientes con fibrilación auricular y riesgo moderado de sufrir ictus y que actualmente reciben warfarina?». El panel especificó los detalles de la pregunta: población, intervención, comparación y outcomes (resultados o desenlaces) (PICO)9, el ámbito al que se dirige la recomendación y la perspectiva que se ha adoptado (tabla 2).
Situación clínica
| La warfarina reduce el riesgo de ictus isquémico en pacientes con fibrilación auricular, pero aumenta el riesgo de hemorragia y requiere análisis de sangre y visitas a la clínica frecuentes para monitorizar el International Normalized Ratio (INR) y ajustar la dosis. El apixabán, el dabigatrán y el rivaroxabán son anticoagulantes nuevos de dosis fijas que se han comparado con la warfarina en ensayos con asignación aleatoria6-8. El dabigatrán es un inhibidor directo de la trombina. El ensayo RE-LY (Randomized Evaluation of Long-Term Anticoagulation Therapy) fue un estudio internacional, multicéntrico y con asignación aleatoria, en el que 18.113 pacientes con fibrilación auricular con alto riesgo de sufrir ictus (puntuación de 1 o mayor en la escala CHADS2) fueron asignados al azar a recibir dabigatrán a dosis bajas (110mg dos veces al día) o a dosis altas (150mg dos veces al día) o una dosis ajustada de warfarina6. El seguimiento medio fue de 2 años. Los resultados fueron mejores con la dosis alta de dabigatrán. Un panel del programa de guías del sistema nacional de salud del Reino Unido se hace la siguiente pregunta: «¿Debe usarse dabigatrán o warfarina para la fibrilación auricular en pacientes con un riesgo de moderado a alto de sufrir un ictus?». |
Marco de la evidencia a la decisión (EtD): formulación de la pregunta*
| ¿Deben cambiarse a dabigatrán los pacientes con fibrilación auricular y un riesgo de moderado a alto de sufrir ictus que actualmente reciben warfarina? Problema: Pacientes con fibrilación auricular y un riesgo de ictus de moderado a alto que reciben warfarina. Intervención: 150mg diarios de dabigatrán. Comparación: Warfarina. Resultados principales: Muerte, ictus, sangrado mayor, infarto de miocardio, carga del tratamiento. Contexto: Área con importantes recursos. Perspectiva: Sistema de salud. Subgrupos: Pacientes bien controlados con warfarina. Antecedentes: La warfarina reduce el riesgo de sufrir un ictus isquémico en pacientes con fibrilación auricular, pero aumenta el riesgo de hemorragia y requiere que se realicen análisis de sangre y frecuentes visitas a la clínica para monitorizar el International Normalized Ratio (INR) y ajustar la dosis. El apixabán, el dabigatrán y el rivaroxabán son anticoagulantes nuevos que se administran por vía oral y a dosis fijas, y que se han comparado con la warfarina en ensayos aleatorizados6–8. El dabigatrán es un inhibidor directo de la trombina. El ensayo RE-LY (Randomized Evaluation of Long-Term Anticoagulation Therapy) fue un estudio internacional, multicéntrico y con asignación aleatoria, en el que 18.113 pacientes con fibrilación auricular con alto riesgo de sufrir ictus (puntuación de 1 o mayor en la escala CHADS2) fueron asignados al azar a recibir dabigatrán a dosis bajas (110mg dos veces al día) o a dosis altas (150mg dos veces al día) o una dosis ajustada de warfarina6. El seguimiento medio fue de 2 años. Los resultados fueron mejores con la dosis alta del dabigatrán. |
El marco EtD para las recomendaciones clínicas se desarrolló como parte del proyecto DECIDE mediante un proceso iterativo10–12. El punto de partida de los marcos EtD para las recomendaciones clínicas fue la metodología del grupo de trabajo GRADE para pasar de la evidencia a la recomendación clínica13–15. Continuamos desarrollando el marco EtD para recomendaciones clínicas basándonos en revisiones de la literatura relevante y manuales para elaborar guías clínicas, mediante tormenta de ideas y debate entre los autores, comentarios de los grupos de interés, haciendo pruebas de usuario y aplicando el marco a una serie de recomendaciones en talleres y guías reales. Los métodos usados para el desarrollo de los marcos EtD están disponibles con más detalle en el protocolo del proyecto DECIDE10. El Anexo 1 en línea contiene un glosario con la terminología empleada en los marcos EtD.
La estructura general de los marcos EtD es la misma que para las recomendaciones clínicas, decisiones de cobertura sanitaria y recomendaciones, y decisiones sobre el sistema sanitario o la salud pública5. Los marcos EtD incluyen tres secciones principales: formulación de la pregunta, evaluación de la evidencia y consideraciones adicionales de cada criterio, y conclusiones. El Anexo 2 en línea es un ejemplo de marco EtD para la situación de la tabla 1. En este artículo nos centramos en elementos de los marcos EtD para las recomendaciones clínicas que son especialmente relevantes para los médicos y los pacientes.
Formulación de la preguntaCuando se formulan preguntas relevantes, los paneles deben especificar los pacientes, la intervención, la comparación y los outcomes (resultados o desenlaces) (PICO)9, así como su perspectiva, los subgrupos, los juicios y las recomendaciones para los que la evidencia puede diferir de la recomendación general, y los ámbitos a los que se dirige la recomendación.
Los paneles de las guías no suelen ser explícitos sobre la perspectiva que adoptan, lo cual puede resultar en recomendaciones confusas y, a veces, inapropiadas. Por ejemplo, desde la perspectiva del paciente, el hecho de que el efecto deseado neto de una intervención como el dabigatrán compense los gastos personales que cuesta puede ser crucial para tomar una decisión; esto puede ser un problema si el gobierno o la aseguradora no pagan el coste completo del fármaco o si la cobertura sanitaria es limitada. Los recursos requeridos totales (aparte de los gastos personales), el coste-efectividad (desde la perspectiva poblacional) y el impacto sobre la equidad probablemente no sean cruciales en la toma de decisiones personales. Sin embargo, desde la perspectiva poblacional, como la del National Institute for Health and Care Excellence (NICE), las decisiones afectan al uso de los recursos sanitarios limitados. Los recursos necesarios totales, el coste-efectividad (desde una perspectiva más amplia que la del paciente), la equidad, la aceptabilidad y la viabilidad pueden determinar una recomendación. Si se consideran perspectivas distintas pueden formularse recomendaciones diferentes. Por ejemplo, desde la perspectiva poblacional, el panel puede recomendar el uso restringido de anticoagulantes nuevos para pacientes con fibrilación auricular dado su alto coste y el pequeño aumento de los efectos deseados en pacientes bien controlados con warfarina (el comparador). Por otro lado, desde una perspectiva individual, en un escenario de gastos personales bajos (pacientes cuya aseguradora paga la mayor parte o todo el coste de los nuevos anticoagulantes), el panel puede recomendar los nuevos anticoagulantes porque la carga (burden) es menor que la de la warfarina, la cual supone una administración diaria, limitaciones en el estilo de vida, restricciones dietéticas, visitas a la clínica y frecuentes análisis de sangre.
El ámbito de la institución que formula una recomendación suele determinar la perspectiva que adopta un panel. Por ejemplo, una organización nacional como NICE puede adoptar la perspectiva del gobierno o del ministerio de sanidad, dada su obligación de garantizar el uso óptimo del presupuesto en salud del país. Por otro lado, una asociación de profesionales puede adoptar la perspectiva individual con vistas a orientar a los pacientes y al personal sanitario en la toma de decisiones sobre un paciente.
Las recomendaciones pueden diferir entre los subgrupos de población considerados en principio al formular la pregunta. Esto puede deberse a las diferencias entre las personas (diferencias en el riesgo inicial según el valor obtenido en la escala CHADS2), entre las intervenciones (dosis o fármacos distintos dentro de una misma clase), entre las comparaciones (diferentes niveles de control del International Normalized Ratio [INR] con warfarina) o entornos diversos (como diferencias en el acceso a las unidades de trombosis)16. En el caso de la pregunta de la tabla 2, el panel puso especial atención en los pacientes con buen control del INR. El razonamiento es que estos pacientes presentan mejores resultados que los pacientes con mal control del INR. En consecuencia, los efectos deseables del dabigatrán son menores en comparación con la warfarina16.
Evaluación de los criterios consideradosLos marcos EtD para recomendaciones clínicas desde la perspectiva poblacional incluyen 12 criterios. En las recomendaciones desde la perspectiva del paciente individual, algunos criterios se aplican de manera diferente (tabla 3). El equipo técnico o el panel pueden usar la evidencia de revisiones sistemáticas o de estudios individuales en los cuales basar los juicios sobre los efectos de la intervención y otros criterios. Por ejemplo, pueden usar un estudio epidemiológico sobre el riesgo inicial de un desenlace en el contexto (o contextos) de interés, una revisión sistemática o, a veces, un estudio individual de los efectos de una intervención cuando eso sea todo lo disponible, una revisión sistemática o un estudio individual sobre el valor que dan las personas a los resultados, o un análisis económico.
Criterios para la formulación de recomendaciones clínicas desde la perspectiva poblacional y desde la perspectiva del paciente individual
| Perspectiva poblacional | Perspectiva del paciente individual |
|---|---|
| ¿El problema, constituye una prioridad? | ¿El problema, constituye una prioridad? |
| ¿Cuál es la magnitud de los efectos deseados que se prevén? | |
| ¿Cuál es la magnitud de los efectos no deseados que se prevén? | |
| ¿Cuál es la certeza (calidad o confianza) global de la evidencia de los efectos? | |
| ¿Hay incerteza importante sobre la variabilidad en el valor que las personas dan a los resultados principales? | |
| El balance entre los efectos deseados y no deseados, ¿favorece a la intervención o la comparación? | |
| ¿Cuál es la magnitud de los recursos requeridos (costes)? | El coste-efectividad de la intervención (el gasto personal relativo al efecto deseado neto), ¿favorece a la intervención o a la comparación? |
| ¿Cuál es la certeza de la evidencia de los recursos requeridos (costes)? | |
| El coste-efectividad de la intervención, ¿favorece a la intervención o a la comparación? | |
| ¿Cuál sería el impacto sobre la equidad en salud? | |
| ¿Es la intervención aceptable para los grupos de interés clave? | ¿Es la intervención aceptable para los pacientes, sus cuidadores y el personal sanitario? |
| ¿Es factible implementar la intervención? | ¿Es la intervención factible para los pacientes, sus cuidadores y el personal sanitario? |
Se debe referenciar la fuente de la evidencia resumida en el marco y, asimismo, deben notificarse las limitaciones sobre la manera en que se ha resumido la evidencia, en particular cuando la fuente no es una revisión sistemática. Si el equipo técnico no encuentra evidencia para un criterio, debe notificar la falta de evidencia e incluir en el apartado «Consideraciones adicionales» cualquier información o asunción relevante que se haya tenido en cuenta para realizar un juicio. Los equipos técnicos y los paneles pueden disminuir el trabajo que supone preparar los marcos. Por ejemplo, en una guía suele ocurrir que las revisiones sistemáticas individuales responden a uno o más de los criterios de varios marcos EtD. También pueden duplicar los marcos de forma electrónica5 y evitar la necesidad de repetir el trabajo. En otros casos, desde el principio de la síntesis de la evidencia puede estar claro que no es necesario revisar la evidencia para algunos criterios. Por ejemplo, si la certeza (calidad o confianza) de la evidencia es alta sobre daños de una gran magnitud y beneficios pequeños, la dirección y la fuerza de la recomendación pueden ser claras y por tanto sería innecesario revisar la evidencia para el resto de los criterios. Asimismo, esto puede funcionar en dirección contraria. Por ejemplo, un panel encargado de formular recomendaciones sobre la financiación de tecnologías sanitarias consideró recientemente el trasplante de microbiota fecal para la infección recurrente por Clostridium difficile. Ante la abrumadora evidencia sobre el gran beneficio que suponía para esta enfermedad tan grave y costosa, y con efectos adversos mínimos, no fue necesario considerar otros criterios de manera tan detallada. En estas circunstancias, los paneles pueden considerar rápidamente el resto de los criterios sin tener que revisar la evidencia de forma sistemática y proporcionar el razonamiento en el apartado «Consideraciones adicionales».
Las consideraciones adicionales pueden incluir:
- •
Otra evidencia, como las estimaciones de datos recogidos sistemáticamente.
- •
Consecuencias plausibles para las que no se había encontrado evidencia (como razones lógicas para anticipar una reducción potencial de las inequidades) o razones plausibles para anticipar que la intervención (opción) puede no ser aceptable para los grupos de interés o puede ser difícil de implementar.
- •
Cualquier suposición que se hiciera y, si fuera relevante, la base de la misma.
- •
La explicación del fundamento de un juicio si no deriva directamente de la evidencia de los estudios (como la lógica subyacente en un juicio sobre el balance entre los efectos deseados y no deseados).
- •
La documentación de los resultados de votaciones o debates relevantes del panel.
Cuanto más grave sea un problema, más probable es que la intervención para dicho problema sea prioritaria o recomendada (si es efectiva con daños mínimos o inconveniente). Por ejemplo, desde la perspectiva poblacional, es probable que las intervenciones útiles para enfermedades mortales o incapacitantes tengan mayor prioridad y sean más recomendadas en comparación con aquellas para enfermedades transitorias o que solo causan problemas de carácter menor o reversibles. Los paneles pueden considerar de igual importancia los problemas abordados por una guía en particular como parte del proceso de priorización, y pueden hacer que este criterio sea irrelevante. Además, pueden argumentar que la importancia del problema no es un aspecto relevante desde la perspectiva del paciente (si el paciente tiene una enfermedad y quiere actuar al respecto, siempre será una prioridad). Por ejemplo, un panel consideró el uso de la ecografía como complemento de la mamografía en mujeres con alto riesgo de sufrir cáncer de mama (1% de las mujeres) en quienes la resonancia magnética (la prueba de imagen complementaria de elección) está contraindicada (una proporción muy pequeña de las mujeres en riesgo). Si bien esto solo afecta a un grupo de mujeres muy reducido, el problema es de gran relevancia para esa población.
Sin embargo, la importancia de un problema a veces puede afectar a las decisiones que toman los pacientes. Por ejemplo, las prioridades de los pacientes para la prevención primaria pueden influir sobre la fuerza de las recomendaciones, ya que algunos riesgos pueden ser más importantes que otros, o el riesgo inicial de los pacientes puede ser tan bajo que la prevención no sería una prioridad incluso si fuera efectiva. Del mismo modo, los pacientes con comorbilidad y sus cuidadores pueden necesitar barajar un número de tratamientos diferentes y priorizarlos según la importancia de los problemas.
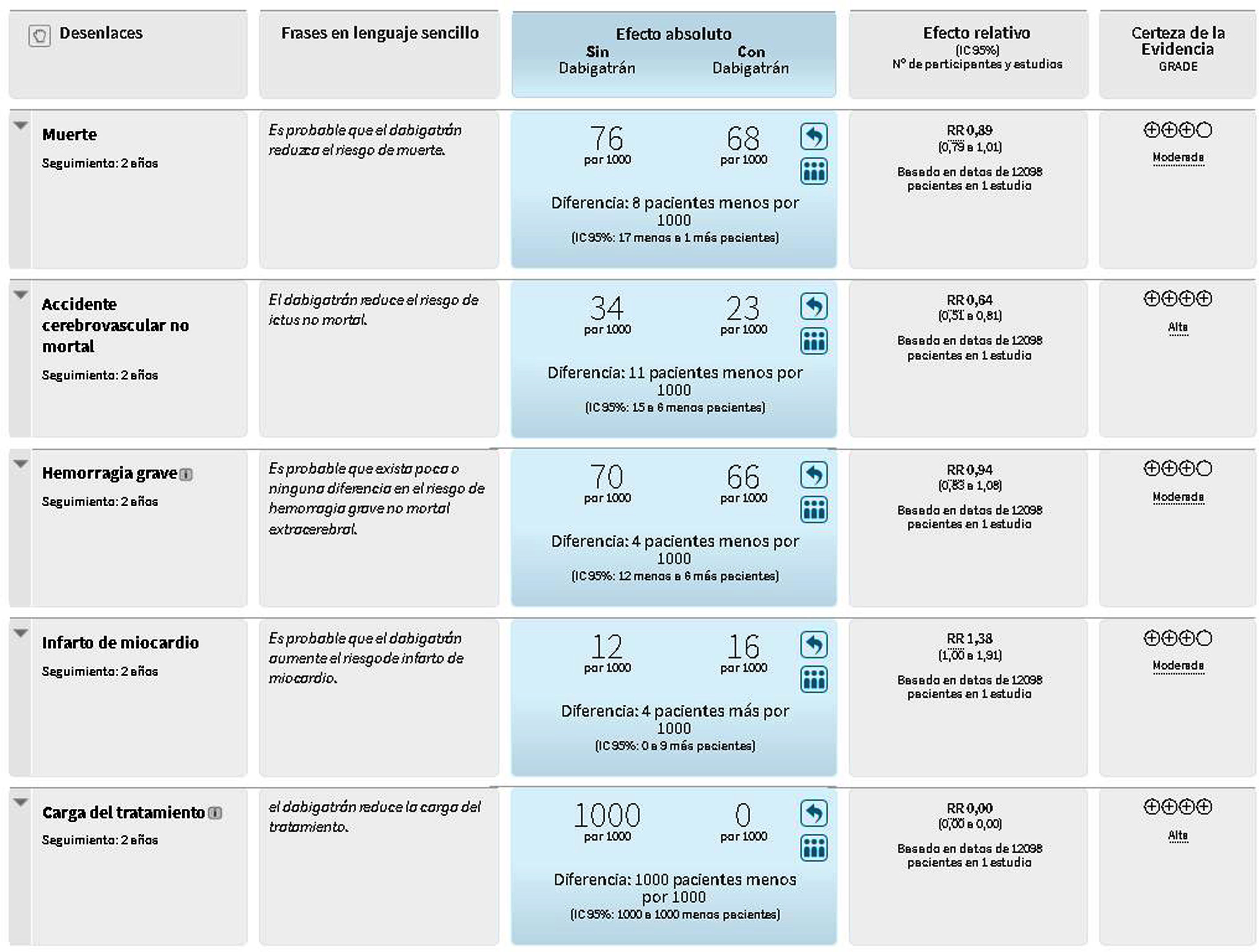
¿Cuál es la magnitud de los efectos deseados y no deseados que se prevén?El resumen de los hallazgos (fig. 1) ofrece las estimaciones de los efectos de las intervenciones comparadas sobre los resultados de interés. Mientras este resumen se basa en una revisión sistemática que identificó un único estudio de importancia, un resumen de hallazgos típico se basa en revisiones sistemáticas de múltiples estudios17.
Resumen de hallazgos: dabigatrán frente a warfarina para la fibrilación auricular4. En el siguiente enlace se encuentra disponible una versión interactiva de esta tabla: ht***tps://isof.epistemonikos.org/#/finding/598c3468e3089d05d0de0204.
Cuanto mayor sea la magnitud de los efectos deseados, más probable es que se recomiende la intervención. Por el contrario, cuanto mayor sea la magnitud de los efectos no deseados (incluida la carga relativa de las intervenciones), menos probable es que se recomiende. Los juicios sobre la magnitud de los efectos deben considerar la magnitud absoluta del efecto (como la proporción de personas que obtendrían un beneficio) y la importancia del desenlace (por ejemplo, qué valor le dan las personas afectadas).
¿Cuál es la certeza global de la evidencia de los efectos?Cuanto más baja sea la certeza de la evidencia de los resultados principales (efectos deseados y no deseados, incluida la carga), menos probabilidad hay de que se formule una recomendación fuerte (Anexo 1 en línea) para una intervención, y más probabilidad hay de que la intervención deba evaluarse si se implementa18,19.
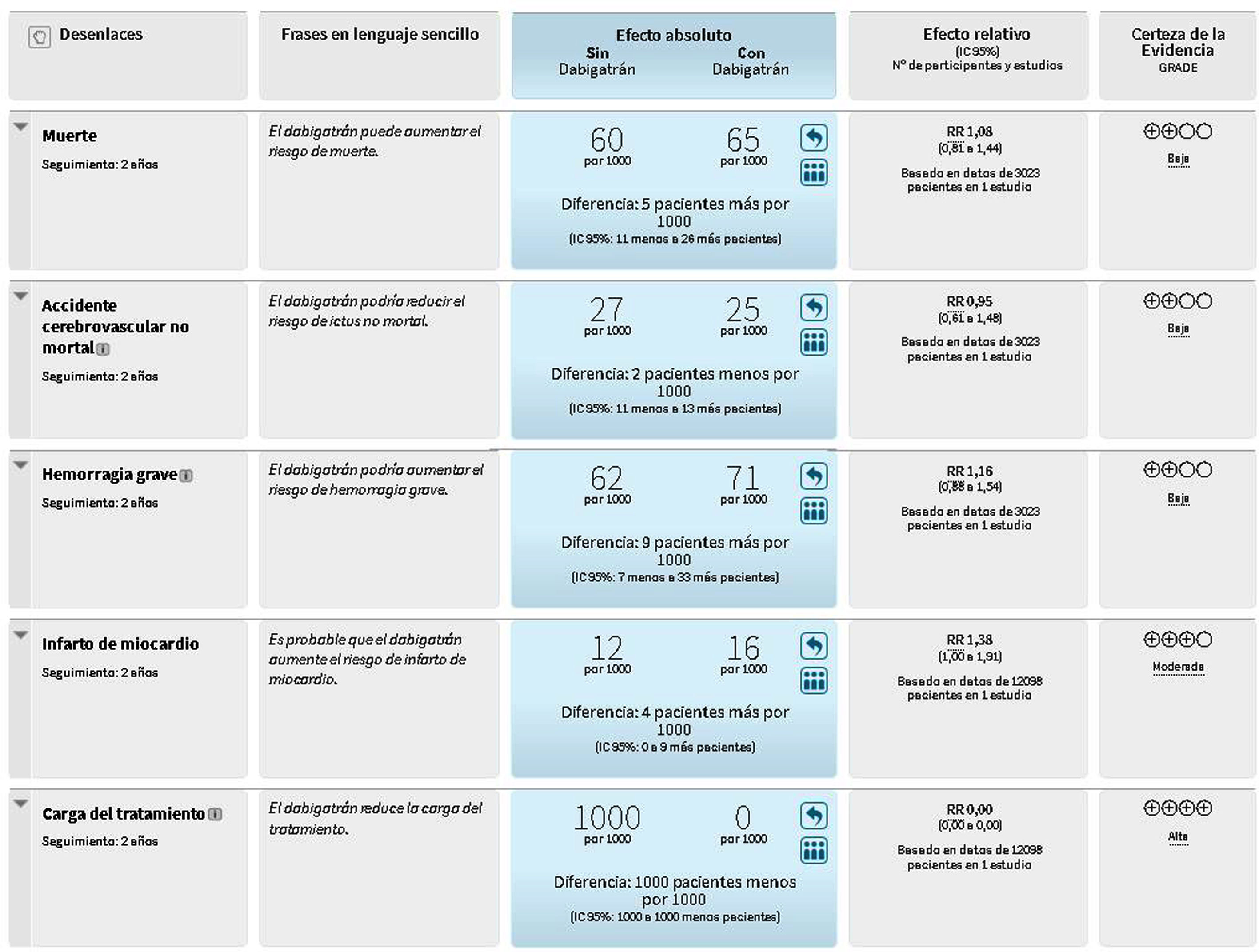
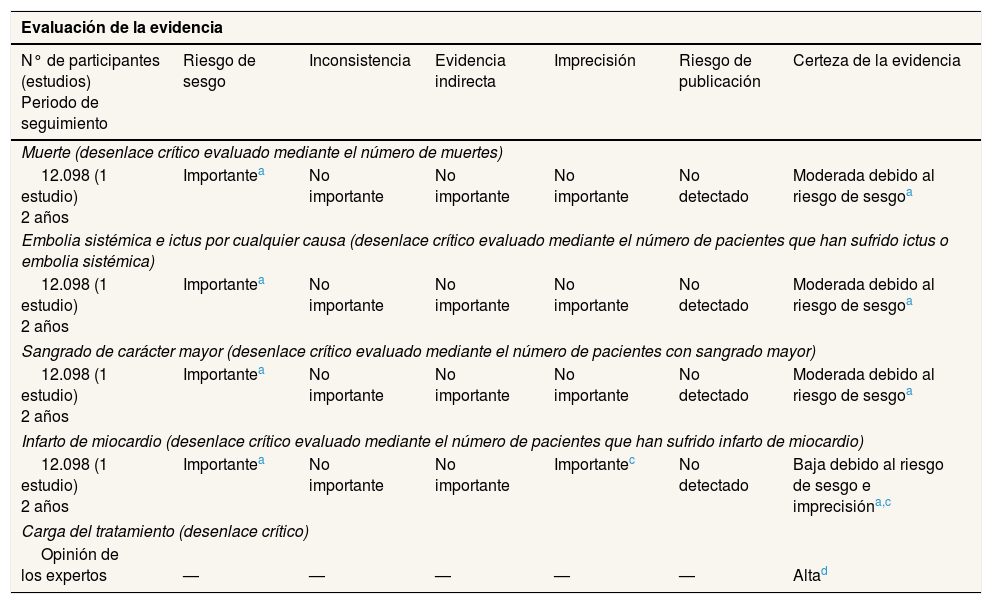
En el caso de la tabla 1, la certeza global de la evidencia (la certeza más baja de los resultados que son críticos para una decisión) es moderada, debido principalmente al riesgo de sesgo (tabla 4). La evidencia del efecto en pacientes bien controlados se consideró como de baja certeza debido a la imprecisión y el riesgo de sesgo (fig. 2). Los factores que deben evaluarse al valorar la certeza sobre la evidencia para cada desenlace son el riesgo de sesgo, la inconsistencia, si la evidencia es indirecta, la imprecisión y el sesgo de publicación18,19. Aunque la certeza respecto a la evidencia era baja para este subgrupo de pacientes, el juicio del panel fue que el efecto era creíble20, es decir, que las estimaciones del subgrupo proporcionaron una base mejor para la toma de decisiones que las estimaciones globales.
Perfil de la evidencia: 150mg diarios de dabigatrán frente a warfarina para la fibrilación auricular
| Evaluación de la evidencia | ||||||
|---|---|---|---|---|---|---|
| N° de participantes (estudios) Periodo de seguimiento | Riesgo de sesgo | Inconsistencia | Evidencia indirecta | Imprecisión | Riesgo de publicación | Certeza de la evidencia |
| Muerte (desenlace crítico evaluado mediante el número de muertes) | ||||||
| 12.098 (1 estudio) 2 años | Importantea | No importante | No importante | No importante | No detectado | Moderada debido al riesgo de sesgoa |
| Embolia sistémica e ictus por cualquier causa (desenlace crítico evaluado mediante el número de pacientes que han sufrido ictus o embolia sistémica) | ||||||
| 12.098 (1 estudio) 2 años | Importantea | No importante | No importante | No importante | No detectado | Moderada debido al riesgo de sesgoa |
| Sangrado de carácter mayor (desenlace crítico evaluado mediante el número de pacientes con sangrado mayor) | ||||||
| 12.098 (1 estudio) 2 años | Importantea | No importante | No importante | No importante | No detectado | Moderada debido al riesgo de sesgoa |
| Infarto de miocardio (desenlace crítico evaluado mediante el número de pacientes que han sufrido infarto de miocardio) | ||||||
| 12.098 (1 estudio) 2 años | Importantea | No importante | No importante | Importantec | No detectado | Baja debido al riesgo de sesgo e imprecisióna,c |
| Carga del tratamiento (desenlace crítico) | ||||||
| Opinión de los expertos | — | — | — | — | — | Altad |
| Resumen de los hallazgos | |||||
|---|---|---|---|---|---|
| Porcentaje de acontecimientos en el estudio | Efectos absolutos anticipados | ||||
| Desenlace | Con warfarina | Con dabigatrán | Riesgo relativo (IC95%) | Riesgo con warfarina | Diferencia en el riesgo con dabigatrán (IC95%) |
| Muerte | 487/6.022 (7,6%)b | 438/6.076 (7,2%) | 0,9 (de 0,79 a 1,01) | 81 por 1.000b | 8 menos por 1.000 (de 17 menos a 1 más) |
| Embolia sistémica e ictus por cualquier causa | 202/6.022 (3,4%)b | 134/6.076 (2,2%) | 0,66 (de 0,54 a 0,82) | 34 por 1.000b | 11 menos por 1.000 (de 6 a 15 menos) |
| Sangrado de carácter mayor | 421/6.022 (7%)b | 399/6.076 (6,6%) | 0,94 (de 0,83 a 1,08) | 70 por 1.000b | 4 menos por 1.000 (de 12 menos a 6 más) |
| Infarto de miocardio | 75/6.022 (1,2%)b | 97/6.076 (1,6%) | 1,29 (de 0,96 a 1,73) | 12 por 1.000b | 4 más por 1.000 (de 0 a 9 más) |
| Carga del tratamiento | 1.000/1.000 | 0/1.000 | |||
El grupo control (warfarina) no estaba enmascarado. Se bajó de calidad alta a moderada debido al diseño abierto del grupo de warfarina, que tiene el potencial de introducir un sesgo de realización que favorece al dabigatrán (en el ensayo con apixabán y rivaroxabán, tanto los pacientes como el personal de salud en los dos grupos estaban enmascarados).
Resumen de hallazgos: pacientes bien controlados con warfarina14. En el siguiente enlace se encuentra disponible una versión interactiva de esta tabla: ht***tps://isof.epistemonikos.org/#/finding/598c364de3089d05d0de0205.
Por lo general, las personas otorgan más valor a evitar un ictus que a evitar el sangrado gastrointestinal grave (tabla 5). La incertidumbre sobre el valor que dan los afectados (pacientes y cuidadores) a los resultados de interés puede ser una razón por la que formular una recomendación débil (condicional) en vez de fuerte (Anexo 1 en línea). La variabilidad respecto al valor que otorgan los pacientes a los resultados principales (hasta el punto en que personas con diferentes valores tomarían decisiones distintas) es otra razón por la que formular una recomendación débil. Por ejemplo, algunos pacientes valoran menos evitar un ictus en comparación con evitar el sangrado gastrointestinal grave o la carga del tratamiento con warfarina que otros pacientes.
Formas de expresar la importancia (el valor) de los resultados como medida de utilidad (o disutilidad)
| • Una manera de expresar el valor del estado en salud es mediante utilidades, una medida de la fuerza de la preferencia de las personas respecto a un estado en salud específico: de 0 (muerte) a 1 (salud óptima). • La disutilidad es la reducción de la utilidad. Por ejemplo, un ictus grave puede tener un valor de utilidad de 0,10 (una reducción o disutilidad de 0,90 comparado con estar sano), un ictus menor puede tener un valor de utilidad de 0,75 (disutilidad de 0,25), y el sangrado gastrointestinal grave puede tener un valor de utilidad de 0,90 (disutilidad de 0,10). • Estos valores indican que la importancia relativa del ictus grave (o el valor que dan las personas a evitarlo) es mayor que la de uno de carácter menor, que a su vez es mayor que la del sangrado gastrointestinal. • La evidencia de las utilidades puede derivar de estudios que hayan medido los valores de utilidad o, idóneamente, de revisiones sistemáticas de estos estudios. Asimismo, puede proceder de estudios que midan directamente las elecciones de las personas en conocimiento de las probabilidades de los efectos deseados y no deseados, una descripción de los resultados (estados de salud) y de información sobre el momento en que aparecerán y su duración. En ocasiones, la evidencia de la investigación cualitativa puede informar los juicios sobre las diferencias entre los valores que dan las personas a los resultados. |
Una revisión sistemática mostró que la certeza de la evidencia de que en general los pacientes dan un valor aproximadamente tres veces mayor a evitar un ictus que al sangrado gastrointestinal grave es moderada21, y mostró que la variabilidad entre los valores de los pacientes era moderada. En el caso del dabigatrán, existe incertidumbre en cuanto a si los pacientes bien controlados con warfarina valorarían más evitar la carga que supone tomar la warfarina que las posibles desventajas de cambiar a dabigatrán. Probablemente, la variabilidad respecto al valor que los pacientes dan a evitar la carga de tomar warfarina sea importante, es decir, es probable que algunos pacientes eligiesen cambiar y otros no por la carga que implica el tratamiento con warfarina. Del mismo modo, las mujeres de 40-50 años de edad pueden tomar decisiones distintas sobre el cribado del cáncer de mama según lo contrarias que se muestren a los efectos no deseados y a la carga que implica el cribado mediante mamografía22,23.
El balance entre los efectos deseados y no deseados, ¿favorece a la intervención o la comparación?Para realizar los juicios sobre el balance entre los efectos deseados y no deseados se necesita considerar los juicios de los cuatro criterios anteriores (la magnitud de los efectos deseados y no deseados, la certeza de la evidencia de los efectos y el valor que dan los afectados a los resultados). En el caso de la tabla 1, el panel decidió que probablemente el balance entre los efectos deseados y no deseados favorecía al dabigatrán (fig. 1 y tabla 4). No obstante, el balance está menos claro en el subgrupo de pacientes bien controlados con warfarina. Estos pacientes presentarían resultados similares, aparte de la mayor carga que implica tomar warfarina en comparación con dabigatrán (fig. 2)6,16. En el caso de este subgrupo, los paneles pueden inclinarse más a que el balance probablemente favorece a la warfarina o a ninguna opción en concreto. La incertidumbre sobre los potenciales efectos adversos del dabigatrán y sobre el cumplimiento del tratamiento podrían aumentar la incertidumbre respecto al balance entre los efectos deseados y no deseados (Anexo 2 en línea).
¿Cuál es la magnitud de los recursos necesarios (costes)?Cuanto mayor sea el coste, menor es la probabilidad de que se recomiende una intervención. Si se considera que el uso de recursos es crucial para tomar una decisión sobre una recomendación, es más probable que el uso de recursos deba evaluarse formalmente. Los costes y el ahorro que se incluyan dependen de la perspectiva que se adopte.
En el ejemplo del dabigatrán, para aproximadamente 66.000 pacientes con fibrilación auricular se estimó un coste de 30 millones de euros anuales más con dabigatrán que con warfarina, considerando tanto el coste de los fármacos como las visitas de monitorización. La diferencia en la estimación del coste de los dos fármacos durante la vida útil para una población de 66.000 pacientes fue de 308 millones de euros más para el dabigatrán24. Desde la perspectiva individual, los costes dependen de cuánto estaría dispuesta a pagar la población diana de su propio bolsillo. Podrían ser todos los gastos (si la aseguradora no cubre los costes del dabigatrán), una parte (si los gastos están parcialmente cubiertos) o nada (si cubre todos los gastos).
¿Cuál es la certeza de la evidencia de los recursos necesarios (costes)?Si se considera que el uso de recursos es crucial para una recomendación, cuanto más baja sea la certeza de la evidencia de los recursos necesarios, menor es la probabilidad de que el panel formule una recomendación fuerte a favor o en contra de una intervención. Los juicios sobre la certeza de la evidencia de los recursos necesarios son similares a los juicios sobre la evidencia de los efectos25. En el caso del tabla 1, hay incertidumbre importante sobre el uso de recursos para el dabigatrán y otros anticoagulantes nuevos (Anexo 2 en línea).
El coste-efectividad de la intervención, ¿favorece a la intervención o a la comparación?Cuanto mayor sea el coste en relación con el beneficio neto, menos probable es que se recomiende la intervención. Los juicios sobre el coste-efectividad de una intervención deben tener en cuenta varios criterios:
- •
El balance entre los efectos deseados y no deseados (el beneficio neto), la certeza de la evidencia de los efectos, y la incertidumbre o variabilidad de cómo valoran las personas los resultados principales.
- •
Los recursos necesarios (costes) y la incertidumbre sobre los costes.
Varias evaluaciones económicas han valorado el coste-efectividad del dabigatrán para la prevención del ictus en pacientes con fibrilación auricular en diferentes contextos26. Por lo general, estos modelos observaron que el dabigatrán era coste-efectivo, pero las ratios de coste-efectividad incremental variaban considerablemente (Anexo 2 en línea). En una evaluación económica noruega, la ratio de coste-efectividad incremental fue menor que el umbral sugerido de 70.000 euros por año de vida ajustado por calidad en el 80% de las simulaciones. No fue coste-efectiva para el subgrupo de pacientes bien controlados con warfarina ni en total para los umbrales por debajo de 38.000 euros (2.012 euros)24.
Además, si se usa una ratio de coste-efectividad a partir de una evaluación económica formal, los paneles deben considerar también la robustez de la estimación cuando se cambian variables simples o múltiples en el modelo (análisis de sensibilidad unilaterales y multifactoriales), si la evaluación económica es fiable y, en caso de utilizarse una evaluación económica publicada, cuál es su aplicabilidad en el marco o los marcos de interés.
¿Cuál sería el impacto sobre las inequidades en salud?Es más probable que se recomienden intervenciones que disminuyen las inequidades que las que no (o que las aumentan)27,28. En el ejemplo del dabigatrán, el panel consideró que podía reducir las inequidades para las personas que no puedan acceder fácilmente a las pruebas de INR, aunque no hay evidencia directa sobre ello.
¿Es la intervención aceptable para los grupos de interés clave?Cuanto menos aceptable sea la intervención para los grupos de interés clave (pacientes incluidos), menos probabilidades hay de que se recomiende; o si se recomienda, más probable es que se necesite una estrategia de implementación para resolver los problemas de aceptabilidad. Una intervención puede ser inaceptable por la distribución de los efectos deseados y no deseados y los costes, es decir, quién se beneficia (o quién sale perjudicado) y quién paga (o ahorra). Por ejemplo, las personas para quienes los costes o la carga son mayores, sin experimentar los beneficios de una intervención, pueden encontrarla inaceptable.
Otra razón por la que algunos grupos de interés pueden encontrar inaceptable una intervención son las discrepancias en los principios éticos (como autonomía, no maleficencia, beneficencia o justicia)29,30. Algunas consideraciones éticas, como la autonomía, pueden ser suficientemente importantes para algunas instituciones o paneles como para considerarlas por separado, ya sea como un juicio detallado o como criterio.
En el ejemplo del dabigatrán, algunos pacientes y médicos pueden oponerse a las restricciones en su uso. Es probable que estas no sean razones para no restringir el empleo del dabigatrán, pero pueden ser aspectos importantes para su implementación.
¿Es factible implementar la intervención?Cuanto menos factible (capacidad de que se consiga o produzca) sea una intervención, menor será la probabilidad de que se recomiende. Los obstáculos para implementar una intervención pueden cambiar la fuerza de una recomendación. Es posible que los médicos no encuentren útil recibir recomendaciones fuertes si las intervenciones no pueden implementarse en su ámbito. Sin embargo, si el público diana son los encargados de formular políticas sanitarias, puede que el panel quiera hacer una recomendación fuerte a pesar de que a los médicos les sea difícil o imposible adherirse a ella. Además, los paneles pueden incluir directamente en sus recomendaciones los principales obstáculos para la implementación, como la disponibilidad de la intervención. Más comúnmente, los paneles pueden ayudar a los responsables de implementar las recomendaciones informándoles en sus conclusiones sobre las barreras clave para su implementación31.
En resumenLa importancia de cada uno de los criterios anteriores para una recomendación puede variar. Para formular una recomendación, el panel tiene que considerar las implicaciones y la importancia de todos los juicios anteriores. En muchos casos será fácil y no requerirá una reflexión profunda. Sin embargo, cuando haya incertidumbre o discrepancia, puede ser útil considerarlas (la importancia y aplicación) para cada criterio.
Basándose en la evaluación global de los criterios, los paneles tienen que llegar a una conclusión sobre la dirección (a favor o en contra de la intervención) y la fuerza de la recomendación13,14. Deben justificar la recomendación según los criterios usados en la evaluación. Pueden llegar a estas conclusiones de diferentes maneras, tanto mediante un proceso de consenso formal como informal o por votación. En el caso de las recomendaciones sencillas, suele bastar con procesos de consenso informales.
En el ejemplo del dabigatrán, el panel formula una recomendación débil a favor de que se cambien a dabigatrán solo los pacientes mal controlados con warfarina a pesar de una buena adherencia. El coste del dabigatrán (desde la perspectiva poblacional) y la incertidumbre sobre el balance entre los efectos deseados y no deseados (incluido el riesgo de los infrecuentes efectos adversos graves) fueron las razones por las que la recomendación resultó débil. El panel formuló una recomendación débil (condicional) en contra de que los pacientes bien controlados con warfarina se cambien a dabigatrán, ya que la reducción del riesgo de ictus puede ser pequeña o nula, y la warfarina es coste-efectiva para estos pacientes en comparación con el dabigatrán. No obstante, el tratamiento con warfarina puede suponer una importante carga para algunos pacientes. Una justificación resume los juicios del panel para cada uno de los criterios más importantes en la decisión (tabla 6).
Justificación y justitifación detallada de una recomendación fuerte y una débil (condicional)
| Recomendación fuerte El panel de la guía recomienda el uso de los anticoagulantes por vía oral en lugar del ácido acetilsalicílico para pacientes con fibrilación auricular y alto riesgo de sufrir un ictus (puntación ≥2 en la escala CHADS2). Justificación: En los pacientes con fibrilación auricular y alto riesgo de sufrir un ictus (puntuación ≥2 en la escala CHADS2), la reducción del número de ictus compensa el aumento del número de sangrados extracraneales mayores no mortales adicionales y la carga que supone tomar los anticoagulantes por vía oral; estos anticoagulantes, además, son coste-efectivos. Así, el panel formuló una recomendación fuerte a favor de la anticoagulación por vía oral frente al ácido acetilsalicílico para pacientes con alto riesgo de sufrir un ictus. Recomendación débil (condicional) En los pacientes con fibrilación auricular y riesgo de moderado a alto de sufrir un ictus (puntuación ≥1 en la escala CHADS2), el panel sugiere que se cambien a dabigatrán solo si no están bien controlados con warfarina a pesar de una buena adherencia (recomendación condicional, certeza moderada de la evidencia). Justificación: En general, y en particular en el caso de los pacientes que no estén bien controlados con warfarina, el balance entre los efectos deseados y no deseados favorece al dabigatrán. Sin embargo, el panel formula una recomendación (débil) a favor de que los pacientes que no estén bien controlados con warfarina se cambien a dabigatrán debido al coste del dabigatrán (desde la perspectiva poblacional) y a la incertidumbre sobre el balance entre los efectos deseados y no deseados (incluida la incertidumbre sobre el riesgo de los infrecuentes efectos adversos graves). El panel formula una recomendación débil (condicional) en contra de que los pacientes bien controlados con warfarina se cambien a dabigatrán, porque la reducción del riesgo de sufrir un ictus puede ser pequeña o nula, y la warfarina es coste-efectiva para estos pacientes en comparación con el dabigatrán, si bien el tratamiento con warfarina puede suponer una importante carga para algunos pacientes. |
En otro escenario, el panel formuló una recomendación fuerte a favor de la anticoagulación por vía oral, en lugar de con ácido acetilsalicílico, en los pacientes con fibrilación auricular y riesgo de ictus (puntuación ≥2 en la escala CHADS2). El panel tenía confianza en que la reducción del número de ictus claramente compensó el número de sangrados mayores extracraneales no mortales adicionales, por lo cual formuló una recomendación fuerte (tabla 6).
Las conclusiones del panel sobre las consideraciones para la implementación deben especificar los problemas clave de factibilidad y aceptabilidad de la intervención, y las estrategias para solucionarlos. Por ejemplo, si el panel recomendó el uso limitado del dabigatrán en los pacientes mal controlados con warfarina, puede anticipar que sería inaceptable para algunos grupos de interés, como la industria farmacéutica, algunos clínicos y ciertos pacientes. En este caso, es importante estar preparado para manejar las objeciones que puedan hacer los grupos de interés. Además, puede ser importante pensar estrategias para garantizar que el dabigatrán se prescriba solo a esos pacientes.
Por último, los paneles pueden especificar cualquier indicador que deba monitorizarse, cuándo se implementará la recomendación y las prioridades de futuras investigaciones para tratar incertidumbres importantes (Anexo 2 en línea)32. Por ejemplo, dado que hay incertidumbre sobre los costes y los posibles efectos adversos del dabigatrán y los potenciales problemas con la adherencia a la recomendación, puede ser conveniente que se monitoricen.
Observaciones finalesLos marcos EtD para recomendaciones de práctica clínica ofrecen un método estructurado y transparente para los paneles de guías. Los marcos ayudan a garantizar la consideración de criterios clave que determinen si debe recomendarse una intervención, y a que la mejor evidencia disponible informe los juicios realizados. Los marcos son también una manera de que los paneles den a conocer a los usuarios de las guías el razonamiento (la justificación) subyacente a las recomendaciones.
Los comentarios en los talleres y el uso de los marcos EtD por los paneles de guías han sido positivos en general. El problema más importante con relación a los marcos EtD que observaron los encargados de desarrollar guías es que son complejos y precisan recursos adicionales para su preparación. Se han observado problemas similares sobre la complejidad de otros elementos del sistema GRADE para hacer juicios sobre la certeza de la evidencia y la fuerza de las recomendaciones, si bien son los propios juicios los que son complicados y no el sistema GRADE ni los marcos EtD en sí mismos.
El reto con el que se encuentra GRADE y cualquier otro sistema es mantener el método para hacer los juicios lo más sencillos posible, pero no más simples. Aunque es posible no considerar algunos criterios, se corre el riesgo de ignorar criterios potencialmente importantes para los paneles en el momento de formular una recomendación. Sin embargo, los paneles necesitan tomar decisiones pragmáticas. Por ejemplo, no siempre es posible, ni tampoco es siempre necesario, llevar a cabo una evaluación económica completa o hacer revisiones sistemáticas para cada criterio para el que pueda ser relevante. El uso de marcos EtD no lo requiere, pero sí precisa una reflexión transparente en cuanto a qué juicios son fundamentales para una recomendación y qué evidencia se emplea para basar cada juicio.
Declaración de transparenciaP. Alonso-Coello afirma que el manuscrito es un informe honesto, exacto y transparente del estudio; que no se ha omitido ningún aspecto importante del mismo; y que cualquier discrepancia respecto al estudio ha sido explicada.
Contribuciones de autoríaP. Alonso-Coello y A.D. Oxman redactaron el primer borrador de este manuscrito, y P. Alonso-Coello, A.D. Oxman, J. Moberg, R. Brignardello-Petersen, E. A. Akl, M. Davoli, S. Treweek, R. A. Mustafa, P. O. Vandvik, J. Meerpohl, G.H. Guyatt, H.J. Schünemann, I. Etxeandia-Ikobaltzeta, N. Ibargoyen-Roteta, M.X. Rojas Reyes, E. Parmelli, K. Pottie, D. Rigau, S. Rosenbaum, A.J. Sanabria, J. Singh, R. Stanev, R.W. Vernooij e I. Verstijnen contribuyeron en su redacción. Todos los autores han leído y comentado los resultados y las conclusiones del manuscrito, y han aprobado su autoría por escrito.
FinanciaciónEl trabajo en este artículo ha sido financiado en parte por el Programa FP7 de la Comisión Europea (acuerdo de subvención 258583) como parte del proyecto DECIDE. La responsabilidad recae exclusivamente sobre los autores; la Comisión Europea no se hace responsable del uso que se dé a la información contenida en este manuscrito.
Conflictos de interesesTodos los autores han completado el informe de declaración del ICMJE (http://www.icmje.org/coi_disclosure.pdf) y declaran: apoyo del Programa FP7 de la Comisión Europea (acuerdo de subvención 258583); ninguna relación financiera con instituciones que puedan tener interés en el trabajo enviado durante los 3 años previos; ninguna otra relación o actividad que pueda parecer que ha influido en el trabajo presentado. Los autores son miembros del grupo de trabajo GRADE y del proyecto DECIDE. P. Alonso-Coello está contratado como investigador Miguel Servet del Instituto de Salud Carlos III (CPII15/0034).
La Fundación Dr. Antonio Esteve ha asumido tanto el permiso de reproducción como la traducción del artículo original al español. La traducción ha sido realizada por María Victoria Leo Rosas y revisada por Andrea Cervera y Pablo Alonso-Coello pertenecientes al Centro Cochrane Iberoamericano.
Los miembros del Grupo de Trabajo GRADE que han contribuido a redactar este artículo son: Pablo Alonso-Coello, Andrew D. Oxman, Jenny Moberg, Romina Brignardello-Petersen, Elie A. Akl, Marina Davoli, Shaun Treweek, Reem A. Mustafa, Per O. Vandvik, Joerg Meerpohl, Gordon H. Guyatt, Holger J. Schünemann, Itziar Etxeandia-Ikobaltzeta, Nora Ibargoyen-Roteta, María Ximena Rojas Reyes, Elena Parmelli, Kevin Pottie, David Rigau, Sarah Rosenbaum, Andrea Juliana Sanabria, Jasvinder Singh, Roger Stanev, Robin W. Vernooij e Ilse Verstijnen. Agradecemos a Roman Jaeschke sus comentarios y sugerencias.
Publicado con permiso del editor. Fuente original: Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M et al. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016;353:i2089. Copyright © 2016, British Medical Journal Publishing Group. El material adicional se publica únicamente en línea. Visite la página de la revista para consultarlo.