El uso de modelos matemáticos como instrumentos de evaluación de alternativas está teniendo una importancia cada vez mayor en el terreno de la evaluación económica de servicios y tecnologías sanitarias, con un papel cada vez más relevante como ayuda en la toma de decisiones en la gestión sanitaria.
Hasta ahora se han usado fundamentalmente 2 tipos de modelos, en parte en función de la enfermedad estudiada. De esta forma, los árboles de decisión han sido muy utilizados para las enfermedades de carácter agudo y los modelos de Markov han sido usados en enfermedades crónicas o que presentan estados de salud recurrentes. Sin embargo, tanto unos como otros presentan importantes limitaciones a la hora de modelar de forma realista ciertos procesos o enfermedades, y por ello está creciendo el interés y el uso de los modelos de simulación de eventos discretos.
El objetivo del presente artículo es describir las principales características que presentan los modelos de simulación de eventos discretos, describir las últimas novedades, así como presentar qué ventajas aportan con respecto a los otros tipos de modelos en economía de la salud y, especialmente, en la evaluación económica de tecnologías y productos sanitarios.
The use of mathematical models to assess therapeutic alternatives is increasing in the economic evaluation of health technologies and services and these models are becoming an increasingly important aid to decision making in health care.
Until now, 2 types of model have been used, depending to some extent on the disease to be studied: decision trees have been used for acute diseases and Markov models in chronic or recurrent diseases. However, both models present major limitations when addressing complex processes or diseases.
Consequently, interest in, and the use of, discrete-event simulation is growing.
The present article aims to describe the main characteristics of discrete-event simulation, the state of the art in this field, and the advantages of these models with respect to other kinds of models in health economics, especially in the evaluation of health technologies and product assessment.
La información que sustenta las decisiones en sanidad, especialmente la relativa al uso de nuevos fármacos o tecnologías, está principalmente basada en ensayos clínicos. Hay ciertas limitaciones en los resultados que suelen presentarse en los diferentes ensayos clínicos ya que, en general, evalúan medidas clínicas intermedias, como la reducción de un factor de riesgo (p. ej., colesterol), o la proporción de pacientes que alcanzan una meta (p. ej., control de la glucemia), y no variables finales, como la supervivencia. Además, suelen presentar un período de seguimiento relativamente corto, y utilizarse comparadores como el placebo, que en la práctica real no suelen ser relevantes.
Por todo lo anterior, con la información proporcionada por los ensayos clínicos, no se suele disponer de evidencias clínicas ni económicas que permitan evaluar si un nuevo fármaco o tecnología sanitaria, en condiciones de práctica real, añade beneficios frente a otras terapias ya existentes, por lo que su uso directo en la toma de decisiones clínicas, así como en la gestión, es importante pero limitado.
Como consecuencia de ello, para agregar la información clínica y económica usamos las técnicas de modelado en sanidad. Los modelos suelen utilizar un lenguaje matemático para construir representaciones esquemáticas de los procesos, a fin de proponer explicaciones para éstos, prever su evolución y simularlos para facilitar la toma de decisiones1.
Las razones que justifican el uso de modelos para ayudar a la toma de decisiones en sanidad se han argumentado en varias revisiones1-4. Recientemente, la ISPOR ha publicado un manual de buenas prácticas para la elaboración de los modelos de decisión en el ámbito sanitario, donde menciona la importancia del modelado para los decisores públicos5.
Normalmente, la representación simplificada de la realidad en los modelos simula el comportamiento de los pacientes con ciertas enfermedades, organizaciones (p. ej., utilización de un servicio), procesos o acontecimientos que siguen una posible sucesión lógica de eventos, a los que va asociado un determinado estado de salud o evento clínico, así como una utilización de recursos sanitarios, que pueden clasificarse y cuantificarse matemáticamente.
Desde el punto de vista general, puede diferenciarse entre modelos analíticos, como los de Markov y los árboles de decisiones, y modelos de simulación. La diferencia principal es que en los primeros la solución se obtiene de forma analítica; sin embargo, los modelos de simulación suelen emplearse cuando la realidad objeto del modelo es muy compleja y la relación entre las variables es difícil de reproducir analíticamente, por lo que se debe dejar operar al sistema analizado, calculando diferentes estimaciones para cada unidad de resultado, y en función del número de réplicas requeridas.
El objetivo del presente trabajo es describir las principales características que presentan los modelos de simulación de eventos discretos (MSED) e identificar las ventajas, aportaciones e inconvenientes respecto a los otros tipos de modelos usados en el análisis económico de tecnologías y productos sanitarios.
Características de los modelos más usadosÁrboles de decisión y modelos de MarkovLos 2 tipos de modelos más ampliamente utilizados hasta la fecha en el ámbito descrito son los árboles de decisión y los modelos de Markov.
Los árboles de decisión son un método de representación de una situación clínica, que maneja la incertidumbre en la toma de decisiones respecto a los tratamientos alternativos y a la evaluación en función de sus efectos. Se caracterizan gráficamente por un conjunto de ramas (que representan las diferentes decisiones y sus consecuencias) que parten de nodos. Estos nodos son el punto de origen de cada una de dichas decisiones (nodos de acción), sus consecuencias (nodos de acontecimiento), o en los que desembocan los resultados finales de la intervención (nodos terminales). Su uso es más aplicable a procesos agudos porque éstos no dependen tanto de la dimensión temporal.
Un modelo de Markov consiste en una serie de experimentos en los que cada uno tiene mposibles resultados, E1, E2…Em, y la probabilidad de cada resultado depende exclusivamente del resultado obtenido en los experimentos previos. En el ámbito sanitario se han utilizado de forma extensiva desde hace años1, ya que permiten tener en cuenta el factor tiempo, por lo que son muy útiles en procesos crónicos, donde la evolución clínica de los pacientes puede identificarse como «estados de salud» y, por tanto, un paciente puede transitar clínicamente a través de éstos durante un determinado período, dividido en ciclos.
Una de las principales limitaciones de los modelos de Markov es que no tienen memoria de ciclos anteriores, es decir, el modelo «olvida» la historia clínica del paciente. Otras limitaciones a este tipo de técnicas son que los períodos de tiempo (ciclos) son prefijados y constantes, y que los pacientes pueden estar en un único estado de salud en cada ciclo del modelo; por ello, necesitaríamos múltiples estados para representar toda la combinación de condiciones clínicas relevantes.
Aunque los modelos de Markov son actualmente los más empleados en la evaluación económica de tecnologías y productos sanitarios, se ha observado un interés creciente por modelos más realistas, como los MSED, todavía poco utilizados en el ámbito sanitario.
MSED y técnicas de simulaciónLos MSED se utilizan para estudiar sistemas y procesos cuyo estado va cambiando con el tiempo de forma discreta, por lo que permiten conceptualizar el curso de una enfermedad y su manejo en términos de los eventos que pueden suceder durante el modelado, y cuyo impacto afecta tanto a los pacientes como a otros componentes del sistema (p. ej., el uso de recursos).
Estos modelos representan procesos y situaciones complejas, en función de los eventos que puedan ocurrir, por lo que pueden representar tanto situaciones clínicas (agudización de un proceso, descompensación patológica, aparición de una nueva situación clínica), como una determinada utilización de recursos sanitarios relacionados con dichas situaciones. Asimismo, las probabilidades de que ocurran cada uno de los eventos según se asocian con las características personales de los pacientes. Todos estos elementos, en conjunto, simulan la evolución natural de la enfermedad o proceso analizado, así como la historia de los pacientes cuya simulación se realiza en el modelo.
Por todo ello, y dado que en el mundo real es frecuente encontrarse con procesos y sistemas cuyo análisis, mediante métodos matemáticos, resulta extraordinariamente complejo o incluso imposible de llevar a cabo, el uso de MSED permite resolver problemas de esta índole. En tales circunstancias, la alternativa más eficaz para afrontar este tipo de estudios consiste en construir unos modelos lógico-matemáticos de forma que permitan imitar o simular el comportamiento del mundo real. Como resultado de repetir dicha simulación un número suficiente de veces, se obtendrá un histórico artificial de observaciones sobre el comportamiento del sistema o proceso. A partir de dichas observaciones, y utilizando técnicas de análisis estadístico, será posible extraer conclusiones sobre el funcionamiento de dicho sistema.
Una discusión sobre las ventajas y desventajas comparativas entre los modelos de árboles, Markov y MSED, puede encontrarse en otros trabajos más específicos6,7.
Resultados y discusiónEtapas de los MSEDEl diseño, el desarrollo y el análisis de resultados de una simulación es un proceso sofisticado, que requiere del analista unos mínimos conocimientos sobre programación, matemáticas, estadística, gestión de proyectos y también sobre el propio sistema estudiado8.
La principal característica de un sistema de eventos discretos9,10 es que el sistema está determinado por una secuencia de eventos que ocurren en momentos aleatorios de tiempo t1, t2… y el cambio de estado del sistema tiene lugar en esos instantes. Los pacientes son las entidades del sistema y los diferentes eventos serán las visitas y cambios de estado de salud (respuesta) desde un nivel basal al final, tras la toma de un tratamiento farmacológico que modificará la fisiología del paciente o la aplicación de una tecnología sanitaria.
Cuando se escribe un programa de simulación para MSED se puede realizar una aproximación del esquema temporal de funcionamiento de las entidades en el sistema. Así, deberá describirse la secuencia de eventos y actividades que realizarán las entidades durante su estancia en el sistema y cómo se modificarán. Algunos de los sistemas más estudiados son los problemas de colas que se aplican en determinadas situaciones, como la espera que deben tener los pacientes entre visita y visita, si los centros donde son tratados no pueden absorber toda su demanda (p. ej., en un centro e instante de tiempo sólo puede ser tratado un paciente a la vez).
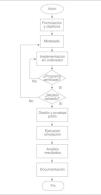
A modo de resumen (fig. 1), para llevar a cabo la simulación del sistema se deben seguir una serie de etapas, ampliamente identificadas y discutidas en la literatura científica11-15:
- 1.
Formulación de la problemática y determinación de los objetivos: consiste en establecer de forma clara, cuál es el problema que se pretende abordar, qué objetivos globales se desean alcanzar y con qué recursos será necesario contar para lograrlos en el tiempo previsto.
- 2.
Modelado del sistema: se trata de crear el diseño del sistema que permita su simulación por ordenador. El modelo deberá reflejar convenientemente la estructura interna del sistema y sus características, de modo que los resultados que se deriven sean extrapolables al sistema real. Por ejemplo, resultará fundamental modelar los fenómenos aleatorios del sistema mediante distribuciones estadísticas, como la interrupción del tratamiento, la hospitalización por urgencias u otro evento. Para llevar esto a cabo, sería interesante disponer de una serie histórica de observaciones sobre el comportamiento de dichos fenómenos aleatorios, como los resultados de un ensayo clínico, un metaanálisis o un registro de pacientes.
- 3.
Implementación del modelo en el ordenador. El modelo desarrollado desde el punto de vista teórico ha de ser implementado en el ordenador a través de algún software específico. Más adelante, se describen las principales características de cada una de las herramientas informáticas disponibles.
- 4.
Verificación del programa: comprobación de la correcta implementación del modelo en el ordenador. Para ello, debemos comprobar que el programa resultante se comporta según lo deseado, es decir, que los resultados deben ser coherentes para las diversas combinaciones de variables de entrada (inputs) del modelo, y no ha habido ningún error sintáctico a la hora de programar las diferentes instrucciones.
- 5.
Validación del modelo. Consiste en comprobar que el modelo refleja convenientemente el mundo real. Para ello, se procede a comparar, para distintas combinaciones de variables de entrada, los resultados que produce el modelo con los observables en el sistema real. En dicho proceso de validación es frecuente el uso de técnicas estadísticas que permitan comparar dos conjuntos de datos16.
- 6.
Diseño de la simulación y pruebas piloto. Una vez aceptado el modelo como válido, el siguiente paso es diseñar las características del experimento o experimentos de simulación que se van a llevar a cabo, es decir, responder a preguntas como cuál será el número de iteraciones, las variables de entrada empleadas, la conveniencia de usar técnicas de reducción de la varianza. Suele ser de gran utilidad la realización de pruebas piloto (simulaciones cortas) que proporcionen orientaciones sobre cómo conviene afrontar el estudio y calcular el número de réplicas necesarias.
- 7.
Ejecución de la simulación. Se procede a llevar a cabo la simulación establecida en el paso anterior.
- 8.
Análisis de resultados. Los resultados procedentes de un experimento de simulación suelen requerir un análisis estadístico no trivial que permita obtener información útil sobre el comportamiento analizado.
- 9.
Documentación del experimento. Una vez finalizado el experimento, éste debe ser convenientemente documentado, de modo que se fomente su credibilidad y la validez de las conclusiones obtenidas.
Puesto que en este tipo de simulación se está considerando la evolución temporal del sistema, cuyo estado se modifica sólo en instantes discretos de tiempo a causa de la aparición de algún evento, será necesario introducir un «reloj de simulación» que registre el tiempo virtual transcurrido desde la puesta en marcha del sistema, y que permita referenciar el instante exacto en que ocurre cada uno de los eventos. Es importante no confundir el tiempo virtual que marca el reloj de simulación con el tiempo de computación, el cual registra el tiempo real transcurrido desde que la simulación se puso en marcha.
El tiempo marcado por el reloj de simulación hace explícito el paso del tiempo a lo largo del modelo. Esto hace posible señalar el comienzo y el final de la simulación, y la aparición de eventos clínicos en su momento exacto, sin necesidad de ciclos de duración fija. Esto permite una simulación más eficiente y realista en función de la aparición de los eventos durante el curso de la enfermedad en los pacientes.
También permite la creación de relojes secundarios que marcan tiempos importantes, como la estancia hospitalaria, el tiempo de ausencia de efectos adversos o la supervivencia.
Puesto que los cambios en el sistema se producen sólo cuando ocurre algún evento, queda claro que el estado del sistema no sufrirá ninguna variación entre 2 eventos consecutivos. Este hecho da sentido a una de las políticas más habituales para controlar el reloj de simulación: si se sabe que el evento n se acaba de producir en el instante virtual actual tn, y que el evento n + 1 se producirá en el instante virtual tn+1, dado que entre ambos instantes no pasará nada de interés, se «avanzará» el reloj de simulación hasta el instante tn+1 y se asignará dicho instante a la variable del programa que representa el reloj de simulación. Tras avanzar el reloj hasta el instante tn+1, se lleva a cabo la actualización de las variables de estado y estadísticas del sistema. Este proceso de «avance hasta el siguiente evento y actualización de variables» se repite de forma indefinida hasta que se verifique alguna condición de fin de la simulación.
EntidadesSon los elementos dinámicos que se simulan a través del modelo, cambian de estatus, afectan y son afectados por otras entidades y son los protagonistas de los eventos clínicos de estudio del modelo.
Normalmente, en la simulación de una enfermedad se representan pacientes, pero pueden representarse también distintos componentes, como enfermeras, familiares o médicos. Estas entidades suponen una diferencia importante respecto a los árboles de decisión o a los modelos de Markov, en los cuales se especifican los resultados clínicos, estados o transiciones de los pacientes, pero éstos en sí no son caracterizados como elementos explícitos del modelo, tal como ocurre en los MSED.
AtributosSon las características de las entidades, con las cuales se describen y diferencian. Por ejemplo, son atributos de los pacientes, como la edad, el sexo, la duración de su enfermedad, la gravedad de ésta y el cumplimiento del tratamiento.
Un atributo importante en las evaluaciones económicas, fundamental en los estudios de coste-utilidad, sería la calidad de vida. Ésta se puede estudiar de forma detallada incluyéndola mediante un atributo.
Todas las entidades tienen los mismos tipos de atributos, pero con diferentes valores para cada entidad; los valores de los atributos están, por tanto, ligados a una entidad concreta. Por ejemplo, todos los pacientes tienen «edad» o «presión arterial», pero cada uno posee un valor específico. El atributo puede asignarse como un valor específico, una muestra de una distribución o el resultado de una expresión (p. ej., de una ecuación condicional).
EventosEs todo aquello que puede ocurrir durante la simulación en función del proceso que estamos estudiando. Por ejemplo, un evento puede ser un efecto adverso, una admisión hospitalaria, el alta del hospital, un cambio de dosis o una baja laboral. El concepto de evento va más allá de las transiciones de los modelos de Markov, ya que la aparición de un evento no necesariamente implica el cambio de estado de salud del paciente (p. ej., una visita al médico).
A pesar de que hay una secuencia temporal dada, los eventos pueden suceder de forma casi simultánea y pueden hacerlo en cualquier secuencia lógica en relación con la historia plausible del proceso de estudio (p. ej., fallo en un órgano diana o fallo multiorgánico en un paciente con sepsis). Al contrario que en los modelos de Markov, estos eventos no presentan ningún tipo de restricción de memoria.
Los riesgos de que los diferentes eventos ocurran pueden tomar la forma de funciones dependientes de los datos y depender de algunos atributos y variables. Estas funciones pueden cambiar durante la simulación.
VariablesLas variables definen el modelo y reflejan una característica del conjunto, no de entidades específicas. Son especificaciones que se mantienen a lo largo del modelo, aunque sus valores pueden cambiar durante el proceso de simulación, y van a definir el entorno de la simulación afectándolo a lo largo de todo el proceso. Las variables de uso común son: el horizonte temporal (duración de la simulación), las tasas de descuento para los costes y los beneficios, las tasas de incidencia, la proporción de cada tratamiento al inicio, la tasa de admisión o la perspectiva de uso. Sólo hay una copia de cada variable que se mantiene para todo el modelo.
RecursosDefinidos en un tiempo determinado, su consumo lleva asociado el gasto de una serie de unidades de dichos recursos en momentos de tiempo concretos. En el ámbito sanitario estos recursos se pueden dividir en personas (médicos, enfermeras, cuidadores), bienes (medicamentos, pruebas de laboratorio), espacios (camas hospitalarias, quirófanos) y otros.
Algunos recursos pueden consumirse de manera simultánea en un momento dado, pero lo más frecuente es que las entidades tengan que competir por estos recursos, que además tienen un coste unitario de uso.
Un recurso puede tener diferentes unidades de capacidad (pensemos, por ejemplo, en las camas en una sala de emergencia o en el número de médicos en una zona geográfica determinada).
Acumuladores estadísticosSon variables que acumulan la información de lo que ha pasado sin participar en el suceso mismo, es decir, son pasivos. Dependen de la caracterización de los resultados pedidos al modelo. Al final de la simulación, se usan para obtener el resultado final, y las medidas de éstos (cocientes coste efectividad). Algunos ejemplos de acumuladores estadísticos son la supervivencia, los costes asociados a los pacientes o el número de visitas en un tiempo determinado.
ColasCuando un paciente utiliza un determinado recurso, éste deja de estar disponible para el resto de los pacientes, lo cual puede generar colas en el sistema. Esta situación no suele tenerse en cuenta en otro tipo de modelos, en los que los recursos parecen gozar de una capacidad infinita (lo cual está alejado de la máxima de la escasez de recursos en función de las necesidades de la población, que es una característica de la toma de decisiones en sanidad). Esta conceptualización está vinculada a la idea del coste de oportunidad de los recursos en la propia estructura del modelo.
RetrasosSe pueden generar 2 tipos de retrasos: explícitos, que son los que se generan por algún tipo de acción o proceso (p. ej., la duración de los exámenes médicos), e implícitos, causados por otras acciones o condiciones en la simulación del modelo (p. ej., colas para acceder a una prueba diagnóstica).
Ecuaciones de riesgo y generadores de números aleatoriosLas primeras se refieren a ecuaciones que se aplican de forma individual a cada individuo del modelo, y pueden ser: funciones (lineales, logarítmicas, de riesgo etc.) o distribuciones estadísticas de probabilidad (normal, exponencial, weibull, beta, gamma, etc.).
Los números aleatorios se generan mediante algoritmos computacionales avanzados para asegurar la aleatorización y crear el comportamiento estocástico del modelo, y se basan en variables seudoaleatorias, creadas a través de un procedimiento determinístico.
En la mayoría de las simulaciones, los experimentos tienen por objetivo obtener valores medios de los resultados de sus distribuciones probabilísticas. Hay numerosos estudios sobre generación de números aleatorios y técnicas de simulación, así como de su optimización, que quedan fuera del abasto de este artículo10,17-20.
Funcionamiento y software para su realizaciónCómo funciona un MSEDEl desarrollo del modelo comienza por la definición y creación de la población diana mediante la especificación de las características de los pacientes que serán simulados. Así, el modelo se alimenta con información proveniente de ensayos clínicos, evidencia publicada y otros estudios, a partir de los cuales el investigador puede generar una serie de algoritmos y caminos por los que el paciente puede transitar y que sirve para diseñar la historia de la enfermedad o proceso evaluado en el modelo.
Si estudiamos 2 alternativas de tratamiento excluyentes, los pacientes para los que estas terapias estén indicadas pueden someterse a una u otra intervención. La metodología que se sigue para evaluar ambas terapias es generar aleatoriamente unos valores de entrada de las variables que conforman el perfil clínico y sociodemográfico de los pacientes que se van a simular. Al inicio de la simulación se generan pares de individuos «gemelos», es decir, con los mismos valores, que acceden a cada una de las 2 estrategias de tratamiento comparadas en el modelo, de tal forma que la diferencia en el tratamiento que se les aplica a cada gemelo es la única distinción entre ellos a la entrada del modelo.
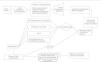
El esquema típico de simulación de un MSED se presenta en la figura 2. La simulación arranca con la puesta en marcha del reloj de simulación, tras lo cual se da la lectura de los diferentes valores iniciales, introducidos en él, como las características de la población, los detalles del manejo de los eventos y los costes en función del tratamiento asignado. Estos valores de entrada son almacenados y leídos por el modelo diseñado en el software de simulación empleado.
A los pacientes creados se les asigna unas características basadas en las distribuciones de partida (p. ej., sexo, edad, valores basales de entrada de incapacidad o enfermedad, etc.). En este punto, se estima la expectativa vital de cada individuo. La persona que realiza el análisis define el tamaño de la cohorte de pacientes que recibirá cada tratamiento (p. ej., 1.000) y el número de réplicas (número de veces que toda la simulación será repetida).
Procedimientos de evaluación y análisis de los resultados de los MSEDEl último paso es analizar los resultados obtenidos al ejecutar el modelo varias veces para poder inferir el efecto de la intervención evaluada. Una vez obtenidos los resultados al ejecutar el modelo, éstos se evalúan a través del análisis de sensibilidad.
Una descripción extensa sobre los diferentes procedimientos estadísticos de simulación, réplicas, precisión, validación, verificación, análisis estadístico de los resultados, análisis de sensibilidad y acreditación de los modelos puede consultarse en algunos trabajos aparecidos recientemente14,15.
Ejemplo de uso de MSEDPara ilustrar los modelos MSED, partiremos de un ejemplo en el que se evalúa un proceso de pacientes con enfermedad cardiovascular, que presentan bradicardia, para la cual estaría indicada la implantación de un marcapasos21. Podríamos implantar 2 tipos diferentes de marcapasos: marcapasos de estimulación monocameral (sólo en ventrículo), o VVI(R), o bien un marcapasos de estimulación bicameral (estimulación auricular y ventricular), o DDD(R).
Los pacientes implantados pueden sufrir diferentes eventos cardiovasculares con el tiempo, como fibrilación auricular (FA) o accidente cerebrovascular (ACV), efectos adversos, como el síndrome del marcapasos, o incluso morir.
Dependiendo de la efectividad de los 2 tipos de marcapasos, estos eventos se podrían dar en diferente proporción de pacientes y tardarían más o menos tiempo en suceder, producirse en momentos diferentes o incluso coincidir en el tiempo; por ello, el uso de un modelo de Markov no es apropiado. Dichos eventos llevarán asociados una utilización de recursos, que implican costes y cambios en la evaluación clínica del paciente, e incluso valores de su calidad de vida, si ésta se ha incorporado en el análisis del estudio. Este proceso se resume en la figura 3.
Se simulan pacientes con una serie de características de entrada en el modelo: sociodemográficas (edad y sexo), factores de riesgo (presión arterial, diabetes, enfermedad vascular previa) y tipo de indicación para el marcapasos (bloqueo de rama, o enfermedad del nodo sinusal). Para cada uno de los pacientes simulados se genera un gemelo, el cual presenta las mismas características basales y sólo se diferencia en la intervención del modelo evaluado a la que es sometido (uno de los gemelos va por la ruta de implantación de marcapasos monocamerales y otro por la de bicamerales). Los pacientes transitarán por el modelo durante los eventos clínicos de estudio (FA, ACV, muerte, supervivencia libre de enfermedad, síndrome del marcapasos y otras complicaciones), así como los costes asociados a la utilización de recursos que suponen dicha diferencia de eventos (fig. 4).
Los datos clínicos que alimentan el modelo son: el registro británico de marcapasos, los ensayos clínicos MOST y CTOPP y el Framingham Herat Study. Se realizan 100 simulaciones de 1.000 pares de pacientes durante 5 años, los beneficios se descontaron al 1,5% anual y los costes al 6%, tal como aconseja el NICE.
El resultado del modelo indica que supone un coste adicional medio en los pacientes implantados con marcapasos bicamerales de 43 libras por paciente, y un incremento de 0,09 AVAC, con un cociente coste/efectividad incremental de 477 libras por AVAC; estos resultados son consistentes durante el análisis de sensibilidad realizado.
Software en simulación de modelos de eventos discretosAunque la programación de este tipo de modelos puede hacerse a través de hojas de cálculo como Excel, ésta sólo se usa para modelos muy simplificados. Para modelos más complejos se utilizan paquetes de software específicos. Por ello, una de las primeras decisiones importantes consiste en seleccionar qué tipo de software se utilizará. Las opciones posibles son básicamente dos:
- 1.
Usar un lenguaje de programación (C/C++, Pascal, Java, Visual Basic, etc.). Esta opción implica, en principio, tener que modelar todos los detalles del sistema, lo cual a su vez supone un elevado coste respecto al tiempo de desarrollo del proyecto. Hay que tener presente, sin embargo, que en los últimos años se han desarrollado librerías de funciones y clases de objetos para C/C++, Pascal, Java e incluso VB.Net, que permiten agilizar este proceso de modelado. Por otra parte, al optar por un lenguaje de programación general, se dispone de una mayor flexibilidad a la hora de construir el modelo y, además, el código resultante puede ser muy eficiente y rápido de ejecutar (especialmente cuando se usa C/C++).
- 2.
Usar programas de simulación (lenguajes de simulación y simuladores) de ámbito genérico (Arena, SIMSCRIPT II.5, AweSim, SIMPLE++, Extend, GPSS/H, Micro Saint, MODSIM III, LeanSim, SIGMA, Simul 8). Esta opción puede acortar significativamente el tiempo requerido para desarrollar el proyecto, puesto que no será necesario desarrollar desde cero todos los detalles de la simulación: este tipo de programas suele incluir un lenguaje de programación especialmente orientado a la simulación, así como librerías de clases, objetos o funciones que agilizan el modelado del sistema, la obtención de valores aleatorios, la generación de informes, el análisis estadístico de resultados, etc. A cambio de ello, se prescinde de un cierto grado de flexibilidad con respecto a la opción anterior.
Los MSED tienen ventajas muy significativas, por ejemplo, con respecto a la población de estudio, ya que facilitan el diseño de la población, teniendo en cuenta las características fundamentales que la definen: perfiles de riesgo, indicaciones y contraindicaciones de las terapias, flexibilidad en la asignación de los costes a cada una, asignación de valores de calidad de vida y utilidades según las características de cada paciente. Además, tienen capacidad de manejar la población de una manera dinámica y vinculada a los eventos que realmente suceden en la historia natural de la enfermedad en cada paciente.
Los MSED permiten diseñar una estructura más clara, de forma que los eventos a los que se someten los pacientes, así como sus consecuencias, son más explícitos, y en el que las alternativas, a través de las que los pacientes discurren, suelen representarse de na forma más transparente. Además, la estructura del modelo se puede cambiar fácilmente, lo que permite un análisis de sensibilidad estructural.
Otra ventaja importante de los MSED es la variable tiempo, ya que en este caso se considera de forma explícita en el diseño del modelo, y no se restringe a ciclos fijos e invariables, de modo que las unidades que se manejan son adecuadas al problema o evento que se analiza en cada momento. Además, los MSED permiten el uso de diferentes tiempos, en función de los eventos que vayan a suceder y en los momentos que se vayan a producir.
Respecto a los resultados, los MSED permiten contemplar resultados múltiples, lo que se adecua más a la realidad, puesto que realmente una enfermedad o situación evaluada mediante técnica de modelado puede tener diferentes puntos finales que han de considerarse de forma simultánea a la hora de evaluar el resultado global de las intervenciones. Esto se realiza de una manera mucho más sencilla y natural con este tipo de modelos, dado que manejan de forma desagregada los costes y los recursos utilizados, producen diferentes medidas de eficacia, como el tiempo libre de enfermedad, la recuperación y la salida del hospital, el cambio de clase funcional o la ausencia de episodios. Además, informan sobre los resultados intermedios en los diferentes momentos de definidos en la simulación (a los 6 meses de tratamiento, al año, a la aparición de complicaciones o muerte), y ofrecen simultáneamente resultados desde varias perspectivas (comprador, sistema sanitario, sociedad), sin necesidad de volver a ejecutar el modelo.
Asimismo, los MSED permiten un estudio más realista de los tratamientos evaluados: cambios de dosis, comienzo y monitorización, prueba de dosis o período de lavado farmacológico previo a un cambio de tratamiento. También es posible, mediante algunos programas de simulación avanzada, animar el modelo, lo cual permite visualizarlo de una forma clara mejorando su transparencia.
Inconvenientes de los MSEDEn general, el uso de los MSED conlleva también una serie de limitaciones. Por un lado, requieren mayor cantidad de datos y pueden necesitar un mayor tiempo de ejecución que los modelos de Markov, si no disponemos de simuladores de alto rendimiento. El análisis de sensibilidad empleado suele ser multivariante, lo cual aumenta todavía más el tiempo de cálculo.
Otra limitación es el escaso acceso al software necesario para programar este tipo de modelos, o bien la falta de un entrenamiento adecuado de sus usuarios, especialmente en el caso de simuladores complejos, como Arena o LeanSim. Su programación también suele ser costosa con respecto al tiempo necesario para su implementación. Aunque es posible implementar este tipo de modelos por medio de programas como Excel, programando macros en Visual Basic para Aplicaciones (VBA). Es poco usual realizarlo a través de esta plataforma, ya que tiene ciertas limitaciones importantes, como por ejemplo el motor de generación de números seudoaleatorios no es suficientemente bueno desde el punto de vista estadístico o la velcidad de ejecución del código VBA es relativamente baja.
ConclusionesHasta la fecha, se han utilizado ampliamente 2 tipos diferentes de modelos para la evaluación de una gran variedad de terapias, enfermedades o procesos. Concretamente, los modelos de Markov son muy utilizados en el ámbito sanitario para el estudio de enfermedades de carácter crónico. Sin embargo, este tipo de modelos tiene una serie de limitaciones inherentes que, bajo ciertas circunstancias y/o en función de la enfermedad estudiada, hacen necesario simplificar en exceso la realidad clínica.
Como alternativa, se está empezando a usar en el ámbito sanitario un tipo de modelo, los MSED, que ya ha sido ampliamente empleado en otras ramas de la ciencia y en diferentes industrias, y permiten salvar estas limitaciones, como demuestra la gran cantidad de bibliografía encontrada sobre MSED más actual.
Los MSED pueden modelar situaciones tan complejas que, en muchos casos, no hay soluciones analíticas, y es necesaria su resolución mediante técnicas de simulación.
Los MSED permiten representar la enfermedad y su manejo de una manera más flexible, con menos restricciones y, por tanto, más asimilable a la realidad que los modelos de Markov. Todos los aspectos relevantes de la enfermedad pueden incorporarse de manera explícita y eficiente. El modelo, en su conjunto, puede presentarse de forma transparente y sencilla, por lo que cada vez más investigadores seleccionan este tipo de modelos para sus estudios en un amplio número de enfermedades y objetivos; también tienen una aplicación importante como instrumento de modelado de la actividad clínico asistencial y en el análisis de necesidades o de gestión en listas de espera. La bibliografía consultada revela un aumento muy significativo de su uso a partir de 1998, especialmente en los últimos 5 años.
Puede pronosticarse un uso más extensivo de estas técnicas en los próximos años para dar respuesta a problemas para los que otras técnicas tradicionales presentan limitaciones22. A ello ayudará, sin duda, el que las autoridades evaluadoras, como el NICE, estén aceptando este tipo de aproximación metodológica; tal es el caso del modelo de SDE, que evaluó el impacto económico del uso de diferentes tipos de marcapasos en pacientes con bradicardia21 y que ha sido recientemente publicado. En el caso español se desconoce el posicionamiento de las autoridades evaluadoras.
De este modo, en los próximos años asistiremos a una mayor extensión del uso de esta metodología de evaluación económica23, paralelamente al desarrollo de herramientas computacionales, flexibles, potentes, metodológicamente avanzadas y amigables; son especialmente interesante en esta área la capacidad dinámica que tienen de incorporar distintas herramientas en un mismo modelo (p. ej., coste-efectividad e impacto presupuestario).
AgradecimientosA Raquel Carnero, Carme Piñol y Ángel Alejandro por sus comentarios. A los revisores anónimos de Gaceta Sanitaria, ya que sus también acertados comentarios mejoraron significativamente nuestro trabajo.