Analizar la tendencia de utilización de nuevos medicamentos para el tratamiento de las enfermedades obstructivas de las vías aéreas en atención primaria de Madrid entre 1996 y 2005, y evaluar su impacto en términos de oferta, consumo y costes.
MétodosEstudio de utilización de medicamentos de novedades terapéuticas del grupo R03 («medicamentos para enfermedades obstructivas de las vías aéreas») prescritos por médicos de atención primaria de Madrid, durante 1996 y 2005. Los datos de consumo y gasto a PVP provienen de la facturación de recetas. El consumo se expresa en dosis diarias definidas por 1.000 habitantes y día.
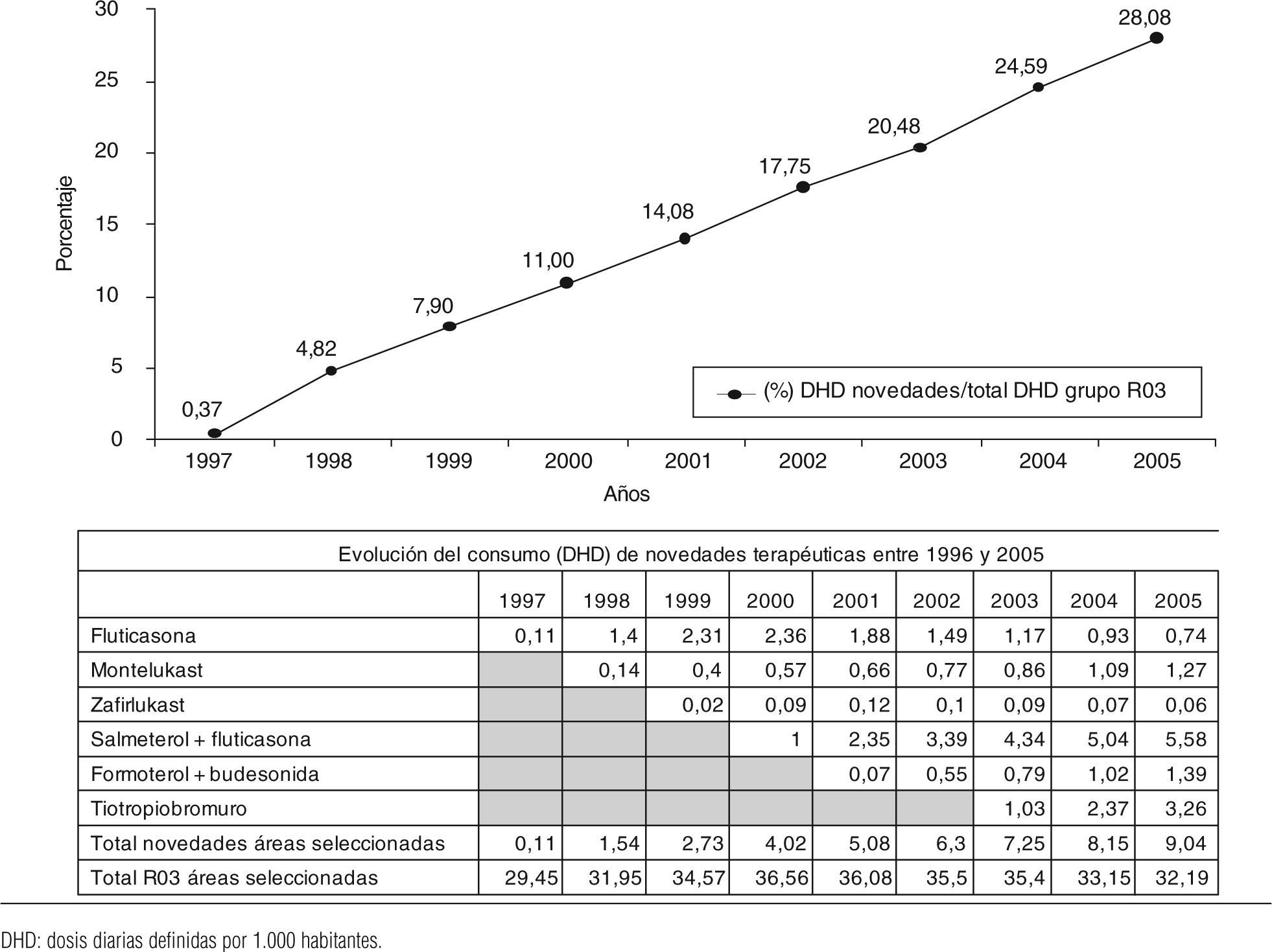
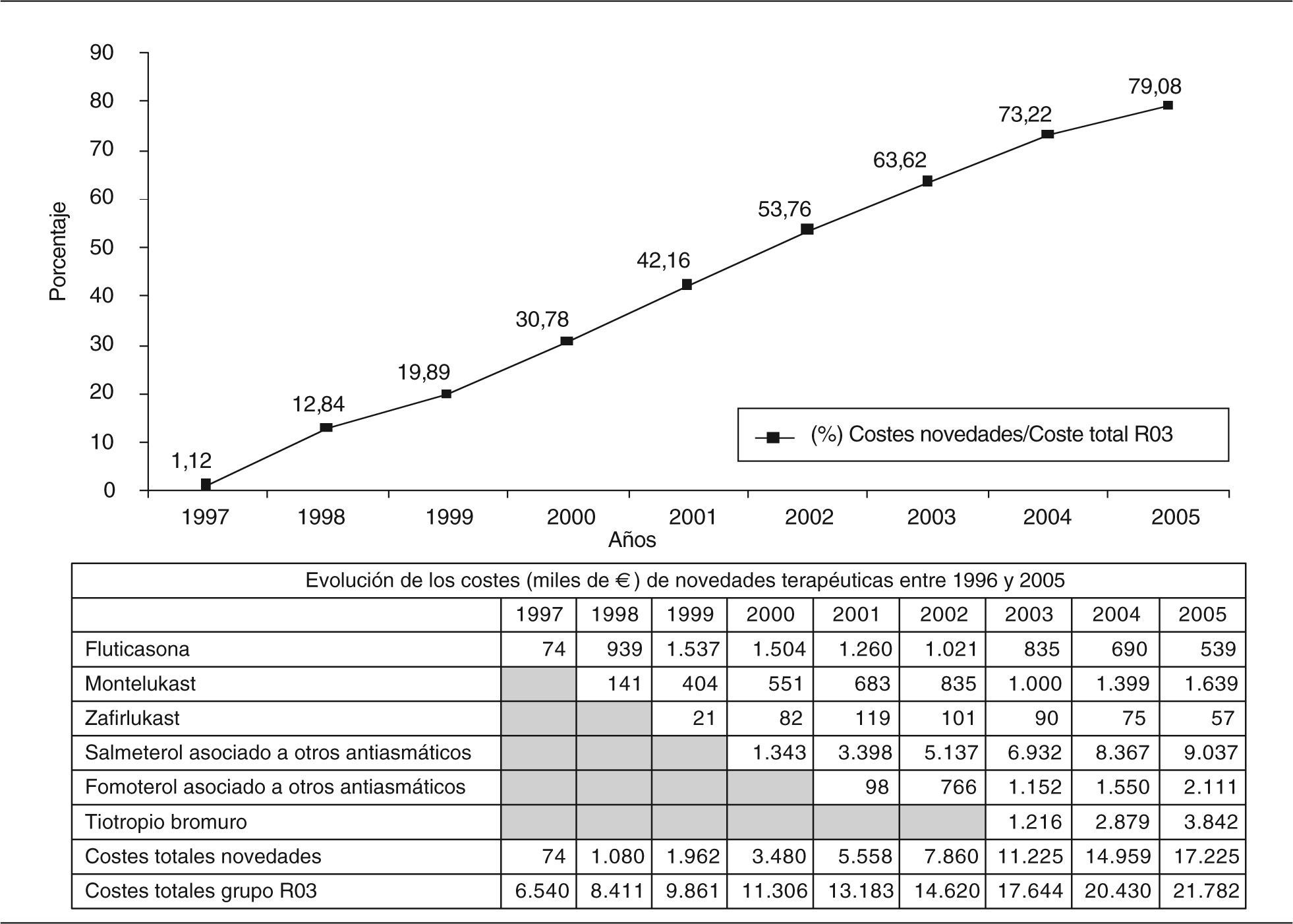
ResultadosLa oferta experimenta pocas variaciones cuantitativas aunque de gran interés cualitativo, al desaparecer fármacos sin utilidad terapéutica y comercializarse 6 novedades terapéuticas. En el año 2005, la utilización de estas últimas genera el 28,03% del total del consumo y el 79% de los costes. Las novedades de mayor impacto son salmeterol/fluticasona y tiotropio.
ConclusionesLa oferta de medicamentos mejora cualitativamente al desaparecer los fármacos sin utilidad terapéutica. La prescripción de novedades terapéuticas tiene un gran impacto sobre el consumo total de los medicamentos del grupo R03 y, sobre todo, en los costes generados, dado su elevado su precio; sin embargo, aportan limitadas ventajas terapéuticas. Los nuevos medicamentos se han incorporado a gran velocidad a la prescripción.
To analyze the trend of use of new drugs for the treatment of chronic obstructive pulmonary disease in primary care of Madrid (Spain) between 1996 and 2005, and to evaluate its impact in terms of supply, use and costs.
MethodsDrug utilization study of new products of the R03 group (Anatomical Therapeutic Chemical Classificaction System: drugs for obstructive airway diseases) prescribed by doctors of primary care of Madrid, during 1996 and 2005. Information on drug utilization and cost was obtained from the prescription database. Date was expressed in daily doses defined by 1,000 inhabitants and day.
ResultsThe supply experiences few quantitative variations although of great qualitative interest, when disappearing drugs without therapeutic utility and commercializing 6 therapeutic new products. In 2005, the use of the 6 new products generates 28.03% of the total of the consumption and 79% of the costs. The new drugs of greater impact are salmeterol/fluticasone and tiotropio.
ConclusionsThe supply of medicines qualitatively improves when disappearing drugs without therapeutic utility. The consumption of therapeutic new products has a great impact on the total consumption of the R03 group and, mainly, in the costs by its elevated price, in spite of contributing only limited therapeutic advantages. The new drugs have been gotten up at great speed to the prescription.
La enfermedad pulmonar obstructiva crónica (EPOC) y el asma son procesos respiratorios de gran trascendencia en términos de salud1-8. En el año 2005, en la Comunidad de Madrid, el consumo de fármacos para tratar ambas enfermedades fue de 36 dosis diarias definidas por 1.000 habitantes (DHD), lo que representa el 4,24% del total de tratamientos diarios dispensados. En relación con el gasto que generan por prescripción a través de receta, estos medicamentos ocuparon, en dicho año, la tercera posición, tras los antihipertensivos y psicofármacos. Su gasto supuso el 8,99% del anual en atención primaria en 2005, y respecto al año 2004 se incrementó un 7,23%, dato que supera el incremento medio de la factura farmacéutica en ese año. Además, es uno de los grupos con mayor crecimiento del precio medio por dosis diaria definida (DDD)9.
Dada la trascendencia que tiene el uso de medicamentos para el tratamiento de la EPOC y el asma en atención primaria, se ha realizado el presente estudio con el objetivo fundamental de conocer el impacto que están ejerciendo las novedades farmacoterapéuticas en el patrón de uso de los tratamientos de ambos procesos respiratorios.
Material y métodosEstudio de utilización de medicamentos, en el que se analizan los fármacos prescritos en receta médica oficial por facultativos de atención primaria (médicos de familia y pediatras), y dispensados y facturados con cargo al Sistema Nacional de Salud por las oficinas de farmacia de la Comunidad de Madrid durante el período 1996-2005. No se incluye el consumo de medicamentos prescritos por facultativos de atención especializada, en recetas privadas, ni el consumo de medicamentos sin receta.
Se evalúan todos los medicamentos clasificados dentro del subgrupo terapéutico farmacológico R03 («medicamentos para enfermedades obstructivas de las vías aéreas»), de la Anatomical Therapeutic Chemical Classification (ATC)10, excluidos los de diagnóstico y uso hospitalario. La oferta de medicamentos del grupo R03 en España se ha estudiado desglosada en principios activos (PA), especialidades farmacéuticas (EF) y presentaciones comerciales (Pr), y por vía de administración inhalatoria (VI) y sistémica (VS). En este trabajo, se han considerado como novedades terapéuticas todos los fármacos del subgrupo R03 comercializados durante el período de estudio.
Ámbito del estudioSe ha evaluado el consumo en 3 áreas sanitarias seleccionadas de la Comunidad de Madrid: 4 (noroeste), 5 (norte) y 8 (suroeste), que prestan asistencia farmacéutica al 30% del total de los usuarios del sistema sanitario de Madrid (5.979.823 a fecha de septiembre de 2006), que son representativas de la diversidad socioeconómica y demográfica de esta comunidad.
Fuentes de informaciónOfertaSe han utilizado los Catálogos de Especialidades Farmacéuticas del Consejo General de Colegios Oficiales de Farmacéuticos, entre 1996 y 2005. Se han excluido las presentaciones en envases clínicos.
Datos de consumoFacilitados por las gerencias de atención primaria de las áreas 4, 5 y 8, agregados por código nacional de especialidad farmacéutica y expresado en número de envases e importe a precio de venta al público (PVP) (€).
Dosis diaria definidaPermite comparar los consumos expresados en dosis medias diarias de mantenimiento de cada principio activo en su principal indicación y para cada vía de administración, en diferentes ámbitos geográficos y temporales. Para calcular el número de DDD por envase, se utiliza la base de datos Nomenclator del Ministerio de Sanidad y Consumo, a fecha de mayo 2006. Los valores no establecidos en él se fijan según la bibliografía.
PoblaciónSe utiliza el número de tarjetas sanitarias individuales (TSI) con derecho a prestación farmacéutica que figura en los contratos de gestión11 anuales de cada área sanitaria.
Parámetros de medidaConsumo. Dosis diaria definida por 1.000 habitantes y díaSe calcula según la fórmula: n.° DHD = (n.° de envases dispensados × n.° de formas farmacéuticas por envase × n° de mg por forma × 1.000 habitantes)/(DDD × n.° de habitantes × 365 días).
Costes en moneda constanteSe estiman los costes en euros constantes, es decir, descontando el efecto de la inflación, utilizando el incremento del índice de precios al consumo (IPC)12. Se ha tomado como año base 1996. Coste en moneda constante = importe (€) a PVPaño «a»/(1 + % IPCaño «a»).
Coste por tratamiento al díaEl coste por tratamiento al día (CTD) es el coste en euros constantes de una DDD. Permite comparar costes. CTD = coste (€) constante/n.° DDD.
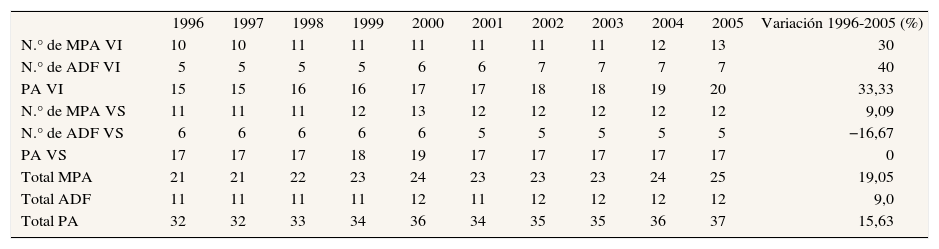
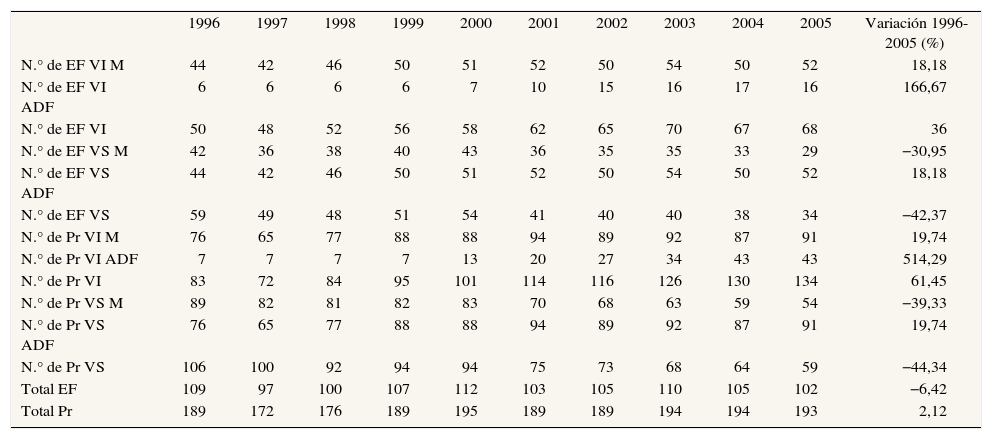
ResultadosEvolución de la oferta de medicamentos para la EPOC y el asmaNúmero de principios activos, especialidades farmacéuticas y presentacionesLa oferta de principios activos aumenta un 15,63%, y los administrados por vía inhalada son los que experimentan un mayor incremento (33%) (tabla 1). El número total de EF del grupo R03 disminuye un 6,4%, aunque las EF por vía inhalada aumenten un 36% (tabla 2). La oferta de presentaciones comerciales de asociaciones en dosis fijas por vía inhalada triplica a la de EF (tabla 2). De todos los principios activos del grupo R03 disponibles en España, el que contaba con mayor número de presentaciones comerciales en 2005 es la asociación de salmeterol/fluticasona (Pr = 30) (tabla 3).
Evolución de la oferta (frecuencia) de principios activos (PA), monofármacos (MPA) y asociaciones en dosis fijas (ADF), por vía inhalada (VI) y sistémica (VS)
| 1996 | 1997 | 1998 | 1999 | 2000 | 2001 | 2002 | 2003 | 2004 | 2005 | Variación 1996-2005 (%) | |
| N.° de MPA VI | 10 | 10 | 11 | 11 | 11 | 11 | 11 | 11 | 12 | 13 | 30 |
| N.° de ADF VI | 5 | 5 | 5 | 5 | 6 | 6 | 7 | 7 | 7 | 7 | 40 |
| PA VI | 15 | 15 | 16 | 16 | 17 | 17 | 18 | 18 | 19 | 20 | 33,33 |
| N.° de MPA VS | 11 | 11 | 11 | 12 | 13 | 12 | 12 | 12 | 12 | 12 | 9,09 |
| N.° de ADF VS | 6 | 6 | 6 | 6 | 6 | 5 | 5 | 5 | 5 | 5 | −16,67 |
| PA VS | 17 | 17 | 17 | 18 | 19 | 17 | 17 | 17 | 17 | 17 | 0 |
| Total MPA | 21 | 21 | 22 | 23 | 24 | 23 | 23 | 23 | 24 | 25 | 19,05 |
| Total ADF | 11 | 11 | 11 | 11 | 12 | 11 | 12 | 12 | 12 | 12 | 9,0 |
| Total PA | 32 | 32 | 33 | 34 | 36 | 34 | 35 | 35 | 36 | 37 | 15,63 |
Evolución de la oferta (frecuencia) especialidades farmacéuticas (EF), presentaciones comerciales (Pr), monofármacos (M) y asociaciones en dosis fijas (ADF), por vía inhalada (VI) y sistémica (VS), en España entre 1996-2005
| 1996 | 1997 | 1998 | 1999 | 2000 | 2001 | 2002 | 2003 | 2004 | 2005 | Variación 1996-2005 (%) | |
| N.° de EF VI M | 44 | 42 | 46 | 50 | 51 | 52 | 50 | 54 | 50 | 52 | 18,18 |
| N.° de EF VI ADF | 6 | 6 | 6 | 6 | 7 | 10 | 15 | 16 | 17 | 16 | 166,67 |
| N.° de EF VI | 50 | 48 | 52 | 56 | 58 | 62 | 65 | 70 | 67 | 68 | 36 |
| N.° de EF VS M | 42 | 36 | 38 | 40 | 43 | 36 | 35 | 35 | 33 | 29 | −30,95 |
| N.° de EF VS ADF | 44 | 42 | 46 | 50 | 51 | 52 | 50 | 54 | 50 | 52 | 18,18 |
| N.° de EF VS | 59 | 49 | 48 | 51 | 54 | 41 | 40 | 40 | 38 | 34 | −42,37 |
| N.° de Pr VI M | 76 | 65 | 77 | 88 | 88 | 94 | 89 | 92 | 87 | 91 | 19,74 |
| N.° de Pr VI ADF | 7 | 7 | 7 | 7 | 13 | 20 | 27 | 34 | 43 | 43 | 514,29 |
| N.° de Pr VI | 83 | 72 | 84 | 95 | 101 | 114 | 116 | 126 | 130 | 134 | 61,45 |
| N.° de Pr VS M | 89 | 82 | 81 | 82 | 83 | 70 | 68 | 63 | 59 | 54 | −39,33 |
| N.° de Pr VS ADF | 76 | 65 | 77 | 88 | 88 | 94 | 89 | 92 | 87 | 91 | 19,74 |
| N.° de Pr VS | 106 | 100 | 92 | 94 | 94 | 75 | 73 | 68 | 64 | 59 | −44,34 |
| Total EF | 109 | 97 | 100 | 107 | 112 | 103 | 105 | 110 | 105 | 102 | −6,42 |
| Total Pr | 189 | 172 | 176 | 189 | 195 | 189 | 189 | 194 | 194 | 193 | 2,12 |
Evolución de la oferta de especialidades farmacéuticas (EF) y presentaciones comerciales (Pr) de subgrupos terapéuticos y principios activos (PA) del grupo R03 entre 1996 y 2005
| 1996 | 1997 | 1998 | 1999 | 2000 | 2001 | 2002 | 2003 | 2004 | 2005 | ||||||||||||||
| Subgrupos químico-terapéutico-farmacológicos | Principios activos | Pr | EF | Pr | EF | Pr | EF | Pr | EF | Pr | EF | Pr | EF | Pr | EF | Pr | EF | Pr | EF | Pr | EF | ||
| VI | PA | Agonistas β2 adrenérgicos no selectivos (R03AB) | Hexoprenalina | 3 | 1 | 2 | 1 | ||||||||||||||||
| VI | PA | Agonistas β2 adrenérgicos no selectivos (R03AB) | Tromazolina | 1 | 1 | ||||||||||||||||||
| VI | PA | Agonistas β2 adrenérgicos no selectivos (R03AB) | Orciprenalina | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | ||||||||||
| VI | PA | Agonistas β2 adrenérgicos selectivos inhalados (R03AC) | Fenoterol | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | ||
| VI | PA | Agonistas β2 adrenérgicos selectivos inhalados (R03AC) | Procaterol | 1 | 3 | 1 | 1 | 1 | 1 | 5 | 2 | 1 | 1 | 2 | 1 | 2 | 1 | 2 | 1 | 2 | 1 | 1 | 1 |
| VI | PA | Agonistas β2 adrenérgicos selectivos inhalados (R03AC) | Salbutamol | 4 | 4 | 4 | 4 | 4 | 4 | 4 | 4 | 4 | 4 | 5 | 5 | 5 | 5 | 5 | 5 | 4 | 4 | 6 | 5 |
| VI | PA | Agonistas β2 adrenérgicos selectivos inhalados (R03AC) | Terbutalina | 3 | 3 | 3 | 3 | 3 | 3 | 3 | 3 | 3 | 3 | 3 | 3 | 2 | 2 | 2 | 2 | 2 | 2 | 2 | 2 |
| VI | PA | Agonistas β2 adrenérgicos selectivos inhalados (R03AC) | Salbutamol | 18 | 4 | 12 | 4 | 12 | 4 | 12 | 4 | 12 | 4 | 12 | 4 | 12 | 4 | 12 | 4 | 12 | 4 | 12 | 6 |
| VI | PA | Agonistas β2 adrenérgicos selectivos inhalados (R03AC) | Formoterol | 3 | 3 | 2 | 2 | 4 | 3 | 8 | 4 | 8 | 4 | 8 | 4 | 8 | 4 | 8 | 5 | 8 | 5 | 8 | 4 |
| VI | PA | Glucocorticoides inhalados (R03BA) | Mometasona | 2 | 1 | ||||||||||||||||||
| VI | PA | Glucocorticoides inhalados (R03BA) | Beclometasona | 12 | 6 | 9 | 7 | 9 | 7 | 9 | 7 | 9 | 7 | 14 | 9 | 11 | 8 | 12 | 9 | 10 | 8 | 9 | 7 |
| VI | PA | Glucocorticoides inhalados (R03BA) | Budesonida | 12 | 6 | 13 | 6 | 10 | 5 | 14 | 7 | 14 | 8 | 18 | 8 | 17 | 8 | 18 | 9 | 18 | 8 | 21 | 9 |
| VS | PA | Glucocorticoides inhalados (R03BA) | Fluticasona | 14 | 6 | 16 | 7 | 19 | 7 | 16 | 7 | 16 | 7 | 16 | 7 | 16 | 7 | 16 | 7 | ||||
| VI | PA | Anticolinérgicos (r03BB) | Bromuro de tiotropio | 5 | 2 | 5 | 3 | 6 | 2 | 4 | 2 | 4 | 2 | 4 | 2 | 4 | 2 | 4 | 2 | 4 | 2 | 4 | 2 |
| VI | PA | Anticolinérgicos (r03BB) | 1 | 1 | 1 | 1 | |||||||||||||||||
| VI | PA | Antialérgicos excluidos los corticoides (R03BC) | Cromoglícico | 8 | 5 | 8 | 5 | 8 | 5 | 8 | 5 | 9 | 6 | 8 | 5 | 8 | 5 | 9 | 6 | 6 | 4 | 6 | 4 |
| VI | PA | Antialérgicos excluidos los corticoides (R03BC) | Nedocromilo | 4 | 4 | 4 | 4 | 4 | 4 | 3 | 3 | 3 | 3 | 3 | 3 | 3 | 3 | 3 | 3 | 3 | 3 | 3 | 3 |
| VI | ADF | Adrenérgicos y otros medicamentos para enfermedades obstructivas de las vías respiratorias (R03AK) | Salmeterol-fluticasona | 6 | 1 | 13 | 4 | 18 | 8 | 24 | 8 | 30 | 9 | 30 | 8 | ||||||||
| VI | ADF | Adrenérgicos y otros medicamentos para enfermedades obstructivas de las vías respiratorias (R03AK) | Formoterol-budesonida | 2 | 1 | 3 | 2 | 6 | 2 | 6 | 2 | ||||||||||||
| VI | ADF | Adrenérgicos y otros medicamentos para enfermedades obstructivas de las vías respiratorias (R03AK) | Isoprenalina-cromoglicato | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 |
| VI | ADF | Adrenérgicos y otros medicamentos para enfermedades obstructivas de las vías respiratorias (R03AK) | Isoprenalina-fenilefrina | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 |
| VI | ADF | Adrenérgicos y otros medicamentos para enfermedades obstructivas de las vías respiratorias (R03AK) | Fenoterol-ipratropio | 3 | 2 | 3 | 2 | 3 | 2 | 3 | 2 | 3 | 2 | 3 | 2 | 3 | 2 | 3 | 2 | 3 | 2 | 3 | 2 |
| VI | ADF | Adrenérgicos y otros medicamentos para enfermedades obstructivas de las vías respiratorias (R03AK) | Ipratropio-salbutamol | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 |
| VI | ADF | Adrenérgicos y otros medicamentos para enfermedades obstructivas de las vías respiratorias (R03AK) | Beciometasono-salbutamol | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 |
| VS | PA | Agonistas α y β adrenérgicos (R03CA) | Efedrina | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 |
| VS | PA | Agonistas β2 adrenérgicos selectivos vía oral (R03CC) | Bambuterol | 2 | 1 | 2 | 1 | 2 | 1 | 2 | 1 | 2 | 1 | 2 | 1 | 2 | 1 | 2 | 1 | 2 | 1 | 1 | 1 |
| VS | PA | Agonistas β2 adrenérgicos selectivos vía oral (R03CC) | Cienbuterol | 4 | 2 | 4 | 2 | 4 | 2 | 4 | 2 | 4 | 2 | 4 | 2 | 4 | 2 | 4 | 2 | 4 | 2 | 1 | 1 |
| VS | PA | Agonistas β2 adrenérgicos selectivos vía oral (R03CC) | Fenoterol | 3 | 1 | 2 | 1 | 2 | 1 | 2 | 1 | 2 | 1 | 2 | 1 | 2 | 1 | 2 | 1 | 2 | 1 | 2 | 1 |
| VS | PA | Agonistas β2 adrenérgicos selectivos vía oral (R03CC) | Salbutamol | 12 | 6 | 12 | 5 | 13 | 7 | 14 | 8 | 14 | 8 | 12 | 7 | 14 | 6 | 12 | 7 | 10 | 6 | 9 | 5 |
| VS | PA | Agonistas β2 adrenérgicos selectivos vía oral (R03CC) | Terbutalina | 7 | 2 | 7 | 2 | 7 | 2 | 6 | 2 | 6 | 2 | 7 | 2 | 6 | 2 | 6 | 2 | 6 | 2 | 10 | 3 |
| VS | PA | Agonistas β2 adrenérgicos selectivos vía oral (R03CC) | Procaterol | 6 | 3 | 5 | 2 | 5 | 2 | 5 | 2 | 5 | 2 | ||||||||||
| VS | PA | Agonistas β2 adrenérgicos selectivos vía oral (R03CC) | Salbutamol-asociaciones | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 |
| VS | PA | Antagonistas de receptores de leukotrienos (R03DC) | Montelukast | 2 | 1 | 2 | 1 | 2 | 1 | 3 | 1 | 3 | 1 | 3 | 1 | 4 | 1 | ||||||
| VS | PA | Antagonistas de receptores de leukotrienos (R03DC) | Zafirlukast | 3 | 3 | 3 | 3 | 3 | 3 | 3 | 3 | 3 | 3 | 3 | 3 | ||||||||
| VS | PA | Xantinas (R03DA) | Etambilina | 5 | 2 | 5 | 2 | 5 | 2 | 7 | 2 | 5 | 2 | 2 | 2 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 |
| VS | PA | Xantinas (R03DA) | Aminofilina | 1 | 1 | 1 | 1 | 1 | 1 | ||||||||||||||
| VS | PA | Xantinas (R03DA) | Teofilina | 39 | 20 | 36 | 17 | 34 | 17 | 31 | 17 | 31 | 17 | 13 | 24 | 14 | 21 | 13 | 19 | 12 | 14 | 9 | |
| VS | PA | Xantinas (R03DA) | Xantinas en | 15 | 15 | 16 | 11 | 9 | 8 | 11 | 10 | 10 | 10 | 4 | 4 | 4 | 4 | 4 | 4 | 4 | 4 | 4 | 4 |
| VS | PA | Etilino-diaminas sustituidas (R06AC) | Mepiramina | 4 | 1 | 4 | 1 | 4 | 1 | 4 | 1 | 4 | 1 | 4 | 1 | 4 | 1 | 4 | 1 | 4 | 1 | 4 | 1 |
| VS | PA | Otros antialérgicos antiasmáticos (R06AX) | Ketotifeno | 6 | 3 | 4 | 2 | 4 | 2 | 4 | 2 | 4 | 2 | 4 | 2 | 4 | 2 | 4 | 2 | 4 | 2 | 4 | 2 |
| Totales | 189 | 109 | 172 | 97 | 176 | 100 | 189 | 107 | 195 | 112 | 189 | 103 | 189 | 105 | 194 | 110 | 194 | 105 | 193 | 102 | |||
ADF: asociaciones en dosis fijas; VI: vía inhalada; VS: vía sistémica.
Entre 1996 y 2005, se comercializan 6 novedades terapéuticas con indicación autorizada para la EPOC y/o el asma: fluticasona (1997), montelukast (1998), zafirlukast (1999), salmeterol/fluticasona (2000), formoterol/budesonida (2001) y tiotropio (2003). En el año 2005, el consumo de estas novedades terapéuticas supone el 28,08% del total del grupo R03 (9,04 DHD), y el mayor valor corresponde a la asociación de salmeterol/fluticasona y a tiotropio (fig. 1). Fluticasona experimenta un gran incremento de consumo sólo hasta el año 1999. El consumo de salmeterol/fluticasona año tras año aumenta, llegando a suponer en 2005 el 17,3% del consumo total (DHD) de medicamentos del grupo R03 y el 61,7% del total de novedades de este grupo. Se observan notables diferencias de consumo entre montelukast y zafirlukast, ya que éste se concentra en el primero. Tiotropio se convierte, en 2005, en el segundo principio activo de mayor consumo de todos los fármacos del grupo R03 comercializados entre 1996 y 2005.
CostesEn las 3 áreas, el porcentaje consumido por las novedades terapéuticas alcanza el 79,1% en 2005 (fig. 2). De todas las novedades, la de mayor impacto económico es salmeterol/fluticasona, que alcanza en 2005 el 41,5% del coste total del grupo R03. Tiotropio es en 2005 el segundo principio activo de mayor impacto económico (17,6%) de todas las novedades.
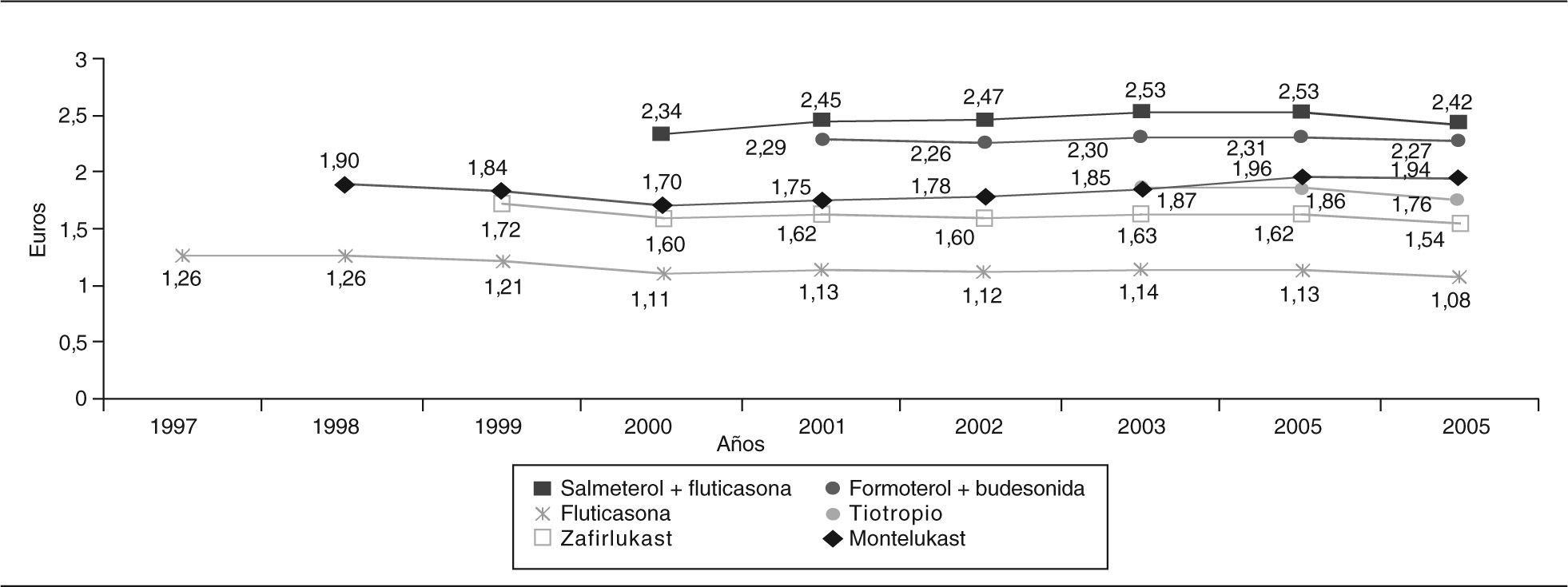
Coste de tratamiento al díaEn la figura 3 se presenta la evolución del CTD de las novedades del grupo R03. Los mayores CTD corresponden a salmeterol/fluticasona, formoterol/budesonida y montelukast, y el menor a fluticasona. Estos fármacos se comercializan con un CTD de 1,26 € para fluticasona (1,85 veces más que budesonida), 1,90 € para montelukast (10,77 veces más que teofilina), 1,72 € para zafirlukast (10,12 veces más que teofilina) y 1,87 € para tiotropio (12,5 veces más que ipratropio).
DiscusiónLa oferta de medicamentos para la EPOC y el asma experimenta pocas variaciones cuantitativas, pero sí diferencias cualitativas. Aumenta la oferta de medicamentos por vía inhalada y disminuye la sistémica, debido principalmente a la entrada en vigor del Real Decreto de financiación selectiva (1998)13, que afecta a asociaciones en dosis fijas de dudosa eficacia y seguridad, con lo que mejora la calidad de ésta.
De los 6 fármacos comercializados entre 1996 y 2005, 4 son principios activos nuevos (fluticasona, tiotropio, montelukast y zafirlukast) y 2 son asociaciones de medicamentos ya disponibles (salmeterol/fluticasona y budesonida/formoterol). Estos nuevos fármacos sólo aportan limitadas ventajas sobre los fármacos ya disponibles. Por su potencial terapéutico, fluticasona14,15, montelukast16, zafirlukast17, fluticasona/salmeterol14 y budesonida/formoterol18 están clasificados en la categoría C (nula o muy pequeña mejora terapéutica), y tiotropio19 en la B (modesta mejora terapéutica). A pesar de ello, su prescripción tiene un importante impacto, tanto en el consumo que generan dentro del total de medicamentos del grupo R03, como en su gasto, dado el elevado precio de los nuevos productos.
Es preciso especificar que se ha tenido en cuenta el efecto de la inflación sobre la merma del poder adquisitivo del dinero durante los 10 años de duración de este estudio; para ello previamente se han homogeneizado los datos de gasto a PVP generado por el consumo de los fármacos estudiados (grupo R03), pasando las unidades monetarias corrientes a unidades monetarias constantes, y deflactando el gasto a través del IPC.
En Madrid, en el año 2005, casi 3 de cada 10 pacientes que han precisado tratamiento para la EPOC y/o el asma han recibido un medicamento que lleva en el mercado español menos de 9 años, y han generado un gasto que supone el 80% del total destinado al manejo farmacoterapéutico de la EPOC y/o el asma.
Haciendo una valoración de la evolución del impacto en la prescripción de cada una de las novedades terapéuticas, se puede apreciar que todas ellas, independientemente de su potencial terapéutico, se introducen rápidamente en la farmacoterapia y van aumentando progresivamente su cuota de mercado en los años estudiados, incluso tras 5 años de su introducción en el mercado, como es el caso de salmeterol/fluticasona. Una excepción a esta tendencia es fluticasona, cuyo consumo comienza a disminuir a los 2 años de su comercialización (año 2000), a expensas del incremento de consumo de salmeterol/fluticasona.
También se comprueba que cuando se introducen varias novedades similares, en un período muy corto, el primer fármaco que sale al mercado es el que tiene el mayor impacto en la prescripción. Así, por ejemplo, montelukast se comercializa en el año 1998 y un año después zafirlukast. Este segundo principio activo sólo consigue cuotas mínimas de mercado en relación con montelukast. Algo similar ocurre con formoterol/budesonida, que se comercializa un año después que salmeterol/fluticasona y, compartiendo indicaciones, aunque aumenta paulatinamente su cuota de mercado, en ningún momento llega a alcanzar los niveles de consumo del primero.
Las novedades se comercializan con un CTD muy superior al de otros principios activos similares. En general, teniendo en cuenta las ventajas que aportan, se puede decir que el incremento de precio es desmesurado, aunque se distinguen varias situaciones.
Fármacos que no aportan nada sobre otros ya existentesEs el caso de fluticasona, que tiene un gran impacto en el manejo del asma aunque no aporte beneficios clínicamente relevantes20. A pesar de ello, se comercializa con un CTD 1,88 veces superior a budesonida.
Fármacos que aportan alguna ventaja, aunque poco relevante, y nula eficaciaPor ejemplo, montelukast y salmeterol/fluticasona, cuya única ventaja sobre otros fármacos similares es la comodidad de su empleo. De hecho, los antagonistas de leucotrienos, nada más comercializarse, aumentan su consumo, que, aunque no de forma significativa, es más de lo que cabría esperar teniendo en cuenta su limitada efectividad en el manejo del asma21. Por otro lado, en relación con los nuevos dispositivos de asociaciones en dosis fijas (salmeterol/fluticasona, formoterol/budesonida) pueden resultar más cómodos para el paciente, ya que pueden sustituir 2 envases por uno, lo que favorece su portabilidad; sin embargo, no son más efectivos ni seguros que sus componentes por separado y no hay evidencias que sugieran que mejoren el cumplimiento terapéutico22 ni los resultados en salud respecto al tratamiento con monofármacos23-25.
Fármacos con un avance modesto frente a sus similares (tiotropio frente a ipratropio) pero con un coste de tratamiento al día muy superior al referente del subgrupoLa ventaja principal de tiotropio sobre ipratropio es su mejor posología, ventaja de interés en este caso porque supone pasar de 4 administraciones al día con ipratropio a tan sólo una con tiotropio. Aunque tiotropio mejora significativamente la función pulmonar y la calidad de vida, no hay diferencias significativas respecto a la mejoría de la disnea y el número de exacerbaciones frente a ipratropio, por lo que sólo supone un modesto avance26,27. En cambio, se comercializa con un CTD más de 12 veces superior a ipratropio.
Principios activos similares (me-too)Se comercializan con sólo un año de diferencia, como es el caso de zafirlukast y formoterol/budesonida. Se autorizan con un CTD ligeramente inferior a sus similares (montelukast y salmeterol/fluticasona), de forma que pueden promocionarse por su menor precio para tratar de desplazar al comercializado un año antes.
En el estudio de Zara et al28 sobre el impacto de novedades terapéuticas en Cataluña en 2002, se indica que las novedades terapéuticas del grupo de medicamentos de antiasmáticos son las de mayor repercusión económica (el 20,7% del gasto en nuevos fármacos), y la combinación en dosis fijas de salmeterol/fluticasona se posiciona como la de mayor impacto económico en el conjunto del total de la prescripción. En el estudio de Bandrés et al29 se analiza, entre 1999 y 2003, el gasto por envase de los nuevos principios activos autorizados para su uso en atención primaria, y se observa que éste es más del doble de los ya existentes.
También se han evaluado los factores que influyen sobre el médico a la hora de prescribir novedades terapéuticas y se ha comprobado que la información recibida por la industria farmacéutica y la opinión de los especialistas son factores muy importantes en la decisión de los médicos30-32.
Estos resultados ponen claramente de manifiesto la importancia de las estrategias de marketing sobre el consumo de medicamentos, muy por delante de las evidencias científicas y de las recomendaciones reflejadas en las guías de práctica clínica. Del análisis que realizan Baena Díez et al33 sobre los nuevos principios activos comercializados en España, se desprende que se han producido pocos avances terapéuticos verdaderos en relación con el volumen de nuevos principios activos autorizados en atención primaria, pero a un coste muy superior a sus alternativas ya disponibles. Este autor destaca la responsabilidad de la administración sanitaria a la hora de fijar los precios de fármacos del grupo C (me-too), sin una relación con lo que aportan, que además están financiados con recursos públicos.
Sin obviar la importancia del desarrollo de fármacos que pueden suponer un avance terapéutico avalado por su eficacia en términos de mortalidad y morbilidad, se debe llamar a la prudencia y a la utilización de fármacos con amplia experiencia y mejoras en la morbimortalidad demostradas para cada situación clínica. Se debe hacer llegar a los profesionales y a los pacientes qué principios activos suponen verdaderos avances terapéuticos, cuál es su uso correcto y su relación beneficio-riesgo.
Aunque la DDD puede no coincidir con la dosis realmente utilizada por la población, es la mejor aproximación a la prevalencia de uso de estos medicamentos en la población general. Por otro lado, para el cálculo de la DHD, se ha utilizado como población la recogida en las bases de datos de la TSI, aunque pueden excluir a población que, siendo atendida, no tenga emitida la TSI en ninguna de las 3 áreas seleccionadas.
La evolución de la oferta de medicamentos disponibles en España para la EPOC y el asma mejora cualitativamente durante el período de estudio por la retirada del mercado de fármacos de baja utilidad terapéutica, y tiende a concentrarse en un menor número de especialidades pero con más presentaciones comerciales. Se observa el gran impacto que alcanzan las novedades terapéuticas, que llegan a posicionarse como opciones de primera línea en el manejo de la EPOC y el asma, conquistando gran parte de los recursos económicos destinados a ambas enfermedades, sin que estén bien establecidos sus beneficios clínicos y ventajas respecto a las alternativas ya existentes20-27 y con un precio muy superior.
AgradecimientosA la Dra. Teresa Alfonso, profesora titular del Departamento de Ciencias Sanitarias y Médico-Sociales de la Universidad de Alcalá, por su colaboración en la realización de este trabajo.