Analizar la supervivencia poblacional del cáncer de mama (CM) en estadios precoces, estimando la tendencia temporal del exceso de mortalidad (EM) a largo plazo en periodos anuales y quinquenales, y determinando, si es posible, una proporción de pacientes que puedan considerarse curadas.
MétodoSe incluyó la cohorte de pacientes diagnosticadas de CM en estadios I y II antes de los 60 años de edad en Gerona y Tarragona (N = 2453). Se calcularon la supervivencia observada (SO) y la supervivencia relativa (SR) al CM hasta los 20 años de seguimiento. Para valorar el EM se estimó la SR a intervalos anuales (SRI) y quinquenales (SR5). Los resultados se presentan por grupos de edad (≤49 y 50-59), estadio (I/II) y periodo de diagnóstico (1985-1994 y 1995-2004).
ResultadosEn el estadio I, la SO y la SR fueron mayores en 1995-2004 que en 1985-1994: 3,5% a los 15 años de seguimiento y 4,5% a los 20 años. La SO superó el 80% en el estadio I y se mantuvo inferior al 70% en el estadio II. Sin embargo, el EM a largo plazo no desapareció (SRI <1) independientemente del grupo de edad, el estadio y el periodo de diagnóstico. A los 15 años de seguimiento, el EM a 5 años osciló entre el 1-5% en el estadio I (SR5 ≥0,95) y el 5-10% en el estadio II.
ConclusionesEn nuestra cohorte, a los 15 años de seguimiento se detectó que el EM anual no desapareció y el quinquenal fue del 1-10%. Por ello, no se pudo determinar una proporción de curación del CM durante el periodo de estudio.
To analyze the population-based survival of breast cancer (CM) diagnosed in early stages estimating the time trends of excess mortality (EM) in the long term in annual and five-year time intervals, and to determine, if possible, a proportion of patients who can be considered cured.
MethodWe included women diagnosed with BC under the age of 60 years in stages I and II in Girona and Tarragona (N = 2453). The observed (OS) and relative survival (RS) were calculated up to 20 years of follow-up. RS was also estimated at annual (RSI) and in five-year intervals (RS5) to graphically assess the EM. The results are presented by age groups (≤49 and 50-59), stage (I/II) and diagnostic period (1985-1994 and 1995-2004).
ResultsIn stage I, OS and RS were higher during 1995-2004 compared to 1985-1994: 3.5% at 15 years of follow-up and 4.5% at 20-years of follow-up. In 1995-2004, the OS surpassed 80% in stage I patients whereas in stage II it remained below 70%. During 1995-2004, the long-term EM did not level off towards 0 (RSI <1) independently of age group, stage and period of diagnosis. After 15 years of follow-up, the 5-year EM oscillated between 1 and 5% in stage I (RS5 ≥0.95) and between 5 and 10% in stage II.
ConclusionsIn our cohort, after 15 years of follow-up, it was detected that the annual EM did not disappear and the five-year EM remained between 1 and 10%. Therefore, it was not possible to determine a cure rate of BC during the study period.
El cáncer de mama (CM) es una enfermedad heterogénea, en la que la supervivencia y la mortalidad han ido mejorando en los últimos años, fruto tanto del diagnóstico precoz del tumor como de la utilización de tratamientos médicos cada vez más adecuados al perfil molecular de la neoplasia1,2.
Sin embargo, una proporción de pacientes diagnosticadas de CM fallecerán por la enfermedad durante los primeros años tras el diagnóstico3–11. Desde hace años se reconoce que las recidivas, la mortalidad general y la mortalidad por CM están aumentadas después de 5-10 años del diagnóstico de la enfermedad, en un periodo de seguimiento en el que ya podríamos considerar que, una vez sobrepasado, la probabilidad de sobrevivir se asemejaría a la misma que la paciente tendría si no hubiese presentado el CM. En los años 1980 se estimaba que la mortalidad por CM podía llegar a ser del 2% anual después de 15 años del tratamiento inicial3, o bien de una muerte por 100 mujeres 20 años después de la cirugía4. Estudios más recientes han mostrado que la detección precoz y la introducción de nuevos tratamientos en el CM, tanto de quimioterapia como de hormonoterapia o anti-HER2, dan lugar a esperar una clara mejora de la supervivencia a largo plazo del CM5,6 e incluso poder detectar una fracción de curación del CM bajo la hipótesis de concavidad de las curvas de supervivencia y asumiendo una mezcla de funciones de supervivencia7.
Disponemos de poca información sobre la supervivencia poblacional a largo plazo del CM en nuestro medio8,9, sobre todo si tenemos en cuenta que la esperanza de vida de nuestra población femenina sobrepasa los 80 años y que la edad media al diagnóstico es de aproximadamente 60 años10. En dos estudios anteriores pudimos objetivar las mejoras en la supervivencia a largo plazo entre periodos9,11, detectando en uno de ellos que las mujeres diagnosticadas de CM antes de los 50 años de edad en Gerona podían presentar un exceso de mortalidad (EM) respecto a la población general a los 10 años desde el diagnóstico11.
En el estudio actual ampliamos la cohorte con las pacientes diagnosticadas en la provincia de Tarragona en el mismo periodo y aumentando el rango de edad en el momento del diagnóstico de CM hasta los 60 años para estimar el EM a 15 y 20 años del diagnóstico en los estadios potencialmente curables (I-II), y en los grupos de ≤49 y 50-59 años de edad.
El objetivo del presente estudio es estimar la tendencia temporal del EM a largo plazo de dicha cohorte en periodos anuales y quinquenales, y determinar, si es posible, una proporción de pacientes que puedan considerarse curadas.
MétodoSe ha utilizado una cohorte inicial de 4804 pacientes diagnosticadas de CM infiltrante (código de la Clasificación Internacional de Enfermedades versión 10:C50/versión 9: 174) antes de los 60 años de edad, en las provincias de Tarragona y Gerona, en el periodo 1985-2004. Los datos han sido proporcionados por los registros de cáncer poblacionales de dichas provincias. Se ha realizado un seguimiento activo y pasivo de estas mujeres hasta el 31 de diciembre de 2014. Los tiempos de seguimiento de las pacientes vivas en dicha fecha fueron considerados como censurados. La fecha de fallecimiento se obtuvo mediante confrontación de la base de datos de los registros de cáncer con el registro de mortalidad de Cataluña y el índice nacional de defunciones.
Evaluación del estadioSe realizó una revisión de las historias clínicas disponibles en los diferentes hospitales de las provincias de Gerona y Tarragona, y pudo obtenerse información de la extensión del tumor en un 26% de las 1935 pacientes diagnosticadas en el periodo 1985-1994 y un 89% de las 2869 diagnosticadas en 1995-2004.
Dadas las sucesivas ediciones del sistema TNM desde 1984 hasta 2004, con los consiguientes cambios de clasificación, se optó por unificar los estadios I a IV de acuerdo con la quinta edición, aplicada en clínica de 1998 a 200312. Uno de los cambios más significativos en la quinta edición del sistema TNM en comparación con la cuarta es la consideración como estadio IV cuando hay afectación metastásica de los ganglios supraclaviculares. A partir de dicha clasificación, 2453 de las 4804 pacientes diagnosticadas de CM antes de los 60 años de edad presentaron estadios I/II, y es la cohorte analizada en este estudio.
Análisis estadísticoSe calcularon la supervivencia observada (SO) y la supervivencia relativa (SR), y sus intervalos de confianza del 95% (IC95%), mediante la aplicación WebSurvCa13. La SO permite evaluar la supervivencia global (por todas las causas de muerte) en la cohorte, y la SR es el cociente entre la SO y la supervivencia esperada (SE) según una población de referencia, que permite llevar a cabo una estimación de la supervivencia neta al CM, ya que se trata de datos que provienen de registros poblacionales de cáncer14.
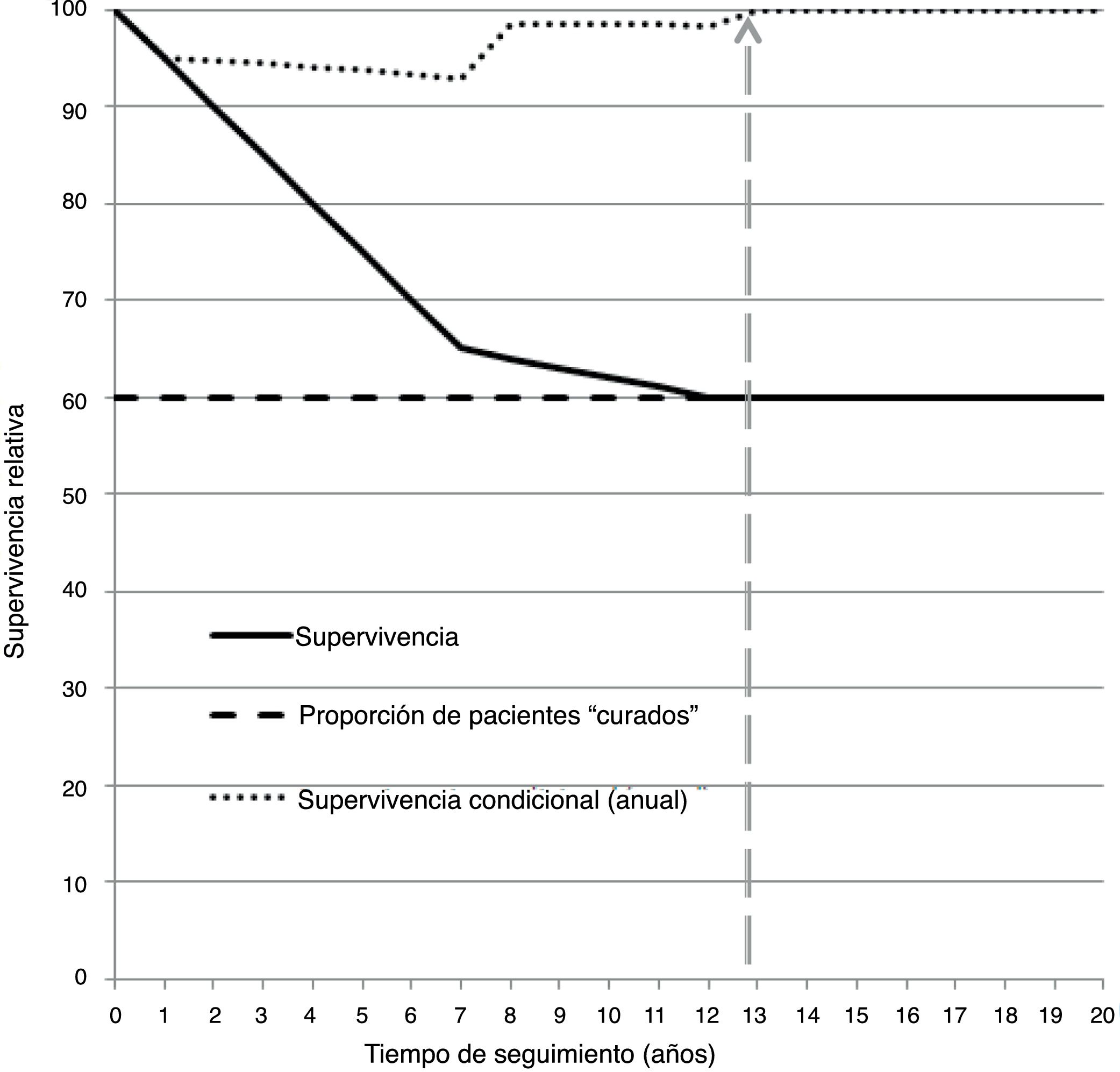
En un marco teórico, la proporción de pacientes curadas de la enfermedad puede evaluarse a través de la evolución temporal del EM que se estimaría mediante la SR calculada en intervalos anuales (SRI)14–16. Si la SRI se mantiene en 1 (o en 100 en escala de porcentajes), es decir, si el cociente entre SO y SE en ese intervalo es 1, ello indicaría que el riesgo de fallecer por la enfermedad en la cohorte de pacientes es similar al de la población general, o sea, cuando el EM es 0. La proporción de pacientes curadas se mediría a partir de la asíntota de la SR que se observaría después de un cierto año t*, es decir, cuando la SR y la SRI se mantuviesen constantes a partir de dicho año t*14,16. A modo de ejemplo, la figura 1 muestra que a los 13 años de seguimiento se detecta un punto de «curación», SRI (t* ≥ 13) = 1, que permitirá conocer la fracción de curación de la enfermedad (en la figura sería un 60%). Nótese que para sacar esta conclusión es necesario que la función de SR sea cóncava y presente una asíntota16, que en el CM generalmente no se observa17. En paralelo a este análisis, se ha sugerido la utilización de la SR condicional no únicamente al año (SRI), sino también a los 5 años (SR5), como medida de evolución del EM a largo plazo16. La SR5(T) se define como la probabilidad que tendría una paciente de sobrevivir a los 5 años una vez haya sobrevivido T años después del diagnóstico16. En clínica es más informativa, ya que estimaría la probabilidad de sobrevivir 5 años más una vez alcanzado un seguimiento determinado, por ejemplo 5 años después de finalizar el tratamiento.
Comportamiento teórico de la función de supervivencia relativa (razón entre supervivencia observada y supervivencia esperada según una población de referencia) de una cohorte de pacientes diagnosticados de cáncer. Interpretación: los/las pacientes que superen los 13 años de seguimiento tienen una supervivencia al cáncer similar a la de la población general (supervivencia observada/ supervivencia esperada=1, 100%, “tiempo de “curación”) aunque pueden morir por otras causas. La proporción que supera los 13 años es del 60%.
La combinación gráfica de los indicadores a largo plazo de la SO, la SR, la SRI y la SR5 permite valorar la evolución temporal del EM. Los valores de SR, SRI y SR5 se presentan en escala 0-1, ya que queremos remarcar la razón SO/SE, es decir, si en algún intervalo de tiempo la SO es similar a la SE. Se ha utilizado el programa R (https://www.R-project.org/) para generar los gráficos correspondientes a los indicadores de supervivencia presentados. Los resultados se presentan por grupos de edad (≤49 y 50-59), estadio (I/II) y periodo de diagnóstico (1985-1994 y 1995-2004).
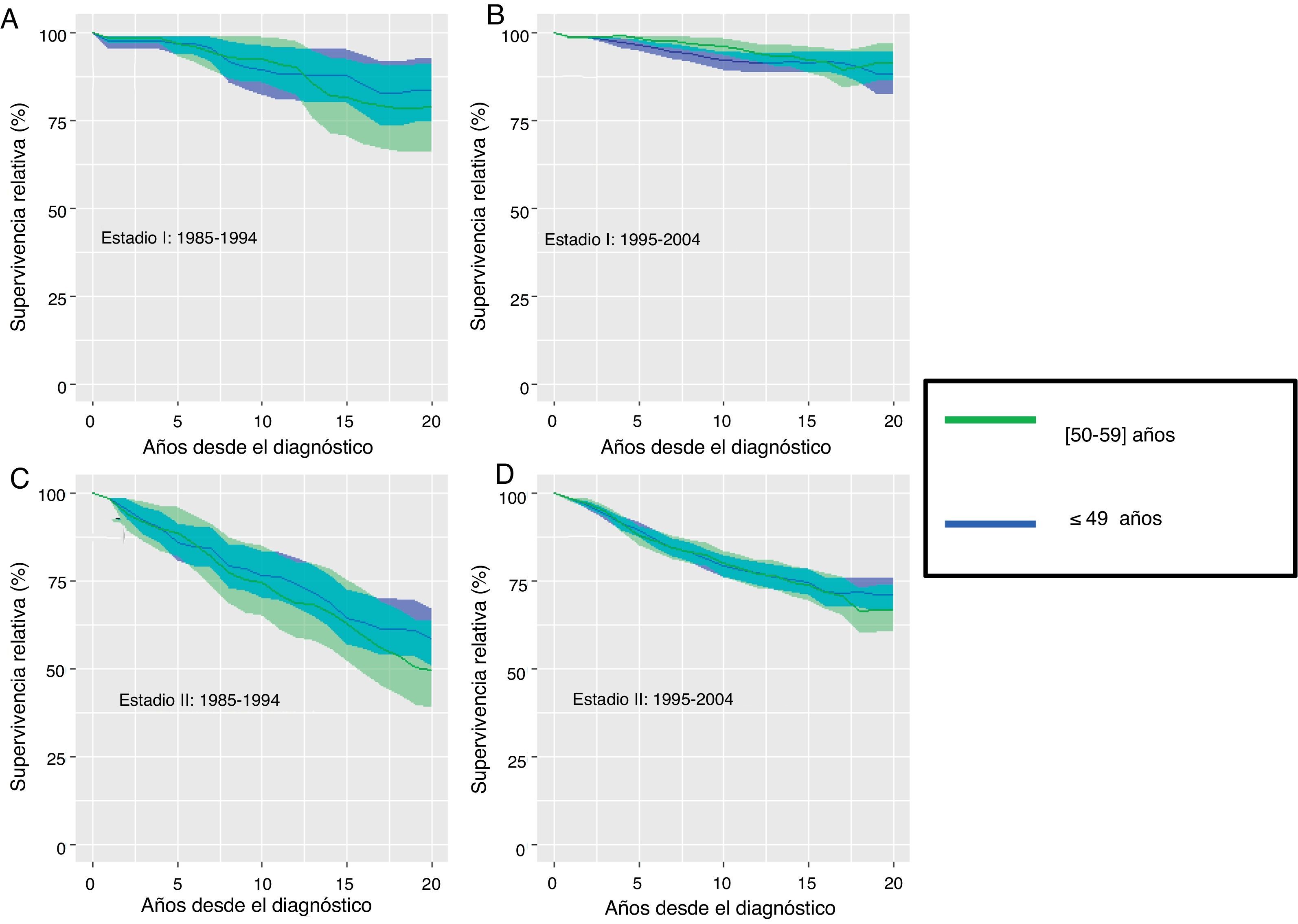
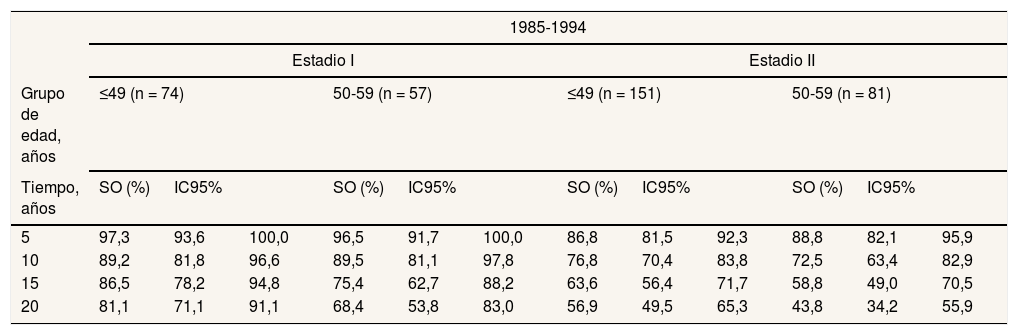
ResultadosLa tabla 1 muestra la SO hasta los 20 años de seguimiento según el grupo de edad, el estadio y el periodo de diagnóstico. La SO a largo plazo fue superior en las mujeres jóvenes y en el segundo periodo. Así, en estadio I, en las mujeres diagnosticadas antes de los 50 años la SO aumentó un 3,5% en el segundo periodo respecto al primero a partir de los 15 años de seguimiento (SO 1995-2004: 90%; IC95%: 87,1-92,9%; SO 1985-1994: 86,5%; IC95%: 78,2-94,8%), incrementándose dicha diferencia hasta un 4,5% a los 20 años de seguimiento. En las mujeres diagnosticadas entre los 50 y los 59 años se detectó un incremento de un 4,6% en el periodo 1995-2004 a partir de los 10 años de seguimiento (SO: 94,1%; IC95%:92,0-96,3%) respecto al periodo 1985-1994 (SO: 89,5%; IC95%:81,1-97,8%), y del 15% a los 20 años de seguimiento. En el estadio I, la SO a 20 años para el periodo 1995-2004 estaría por encima del 80%, siendo ligeramente superior en las pacientes diagnosticadas en el segundo periodo y en las más jóvenes (mujeres ≤49 años: 85,6%; IC95%: 80,0-91,6%; mujeres entre 50 y 59 años: 83,4%; IC95%: 78,7-88,5%). En el estadio II, las diferencias son más acusadas y la SO no superó el 70%. Sin embargo, se detectó un incremento superior al 10% en el segundo periodo de 1995-2004 a partir de los 15 años de seguimiento. La figura 2 presenta la curva de SR estimada hasta los 20 años de seguimiento. A pesar del incremento de la SR en el periodo 1995-2004, no fue posible calcular una fracción de curación, ya que las curvas de SR no mostraron una forma cóncava y asintótica a lo largo del periodo de estudio.
Supervivencia observada por grupos de edad diagnosticados en estadios I y II según periodo de diagnóstico
| 1985-1994 | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Estadio I | Estadio II | |||||||||||
| Grupo de edad, años | ≤49 (n = 74) | 50-59 (n = 57) | ≤49 (n = 151) | 50-59 (n = 81) | ||||||||
| Tiempo, años | SO (%) | IC95% | SO (%) | IC95% | SO (%) | IC95% | SO (%) | IC95% | ||||
| 5 | 97,3 | 93,6 | 100,0 | 96,5 | 91,7 | 100,0 | 86,8 | 81,5 | 92,3 | 88,8 | 82,1 | 95,9 |
| 10 | 89,2 | 81,8 | 96,6 | 89,5 | 81,1 | 97,8 | 76,8 | 70,4 | 83,8 | 72,5 | 63,4 | 82,9 |
| 15 | 86,5 | 78,2 | 94,8 | 75,4 | 62,7 | 88,2 | 63,6 | 56,4 | 71,7 | 58,8 | 49,0 | 70,5 |
| 20 | 81,1 | 71,1 | 91,1 | 68,4 | 53,8 | 83,0 | 56,9 | 49,5 | 65,3 | 43,8 | 34,2 | 55,9 |
| 1995-2004 | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Estadio I | Estadio II | |||||||||||
| Grupo de edad, años | ≤49 (n = 450) | 50-59 (n = 465) | ≤49 (n = 663) | 50-59 (n = 512) | ||||||||
| Tiempo, años | SO (%) | IC95% | SO (%) | IC95% | SO (%) | IC95% | SO (%) | IC95% | ||||
| 5 | 97,3 | 95,8 | 98,8 | 98,5 | 97,4 | 99,6 | 90,4 | 88,2 | 92,7 | 88,0 | 85,2 | 90,9 |
| 10 | 91,8 | 89,3 | 94,4 | 94,1 | 92,0 | 96,3 | 79,1 | 76,1 | 82,3 | 78,5 | 75,1 | 82,2 |
| 15 | 90,0 | 87,1 | 92,9 | 87,6 | 84,1 | 91,2 | 73,7 | 70,3 | 77,4 | 70,4 | 66,2 | 74,8 |
| 20 | 85,6 | 80,0 | 91,6 | 83,4 | 78,7 | 88,5 | 69,2 | 64,8 | 73,9 | 61,6 | 55,8 | 68,0 |
IC95%: intervalo de confianza del 95% de la SO; SO: supervivencia observada.
Supervivencia relativa y su intervalo de confianza al 95% a largo plazo de las pacientes diagnosticadas de cáncer de mama antes de los 60 años de edad en las provincias de Girona y Tarragona en estadios I (A,B) y II (C,D): comparación por periodos de diagnóstico comprendidos entre los años 1985-1994 y 1995-2004.
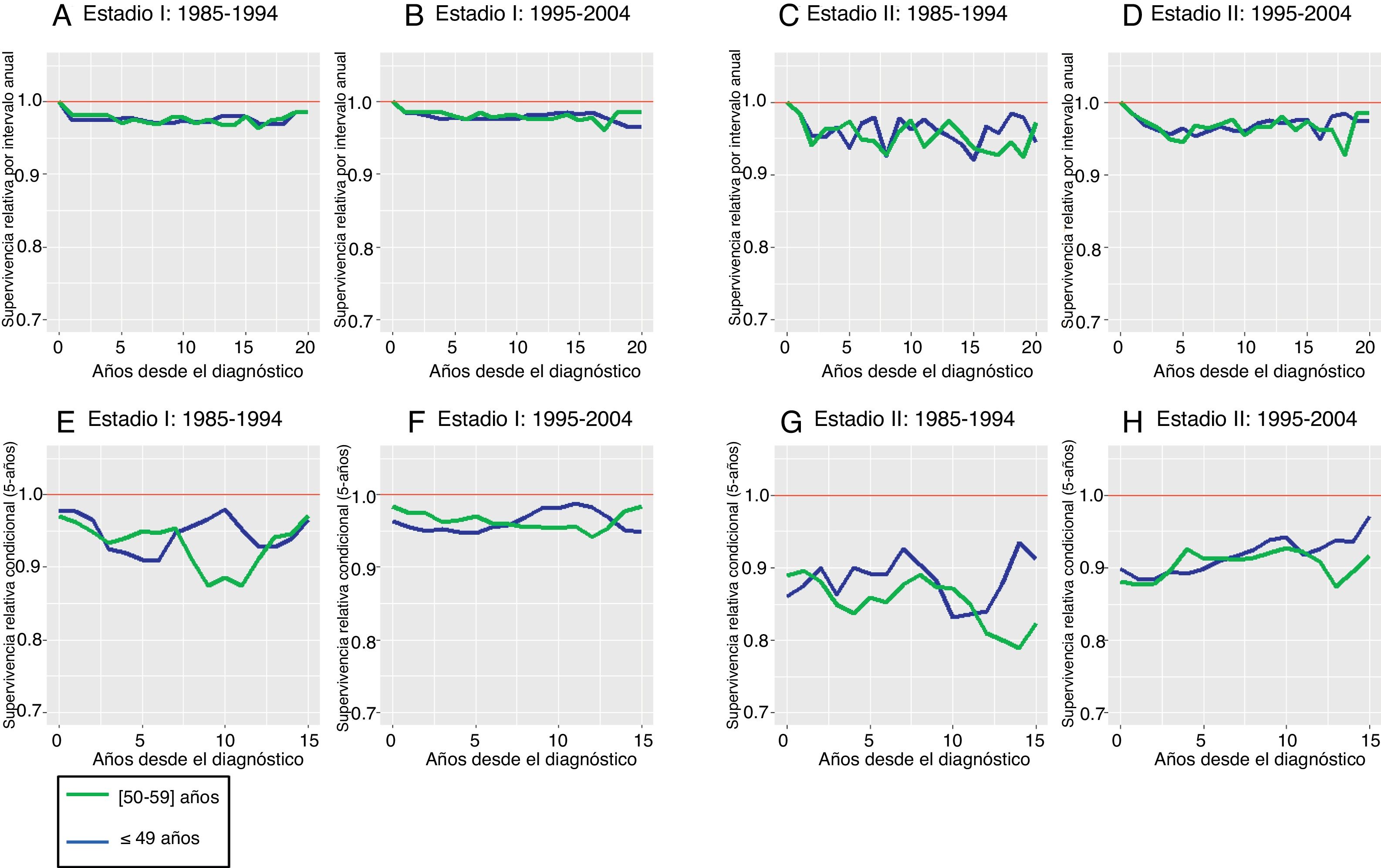
Las curvas de SR en intervalos anuales (SRI) se mantuvieron por encima del 95% en el estadio I, con independencia del grupo de edad y del periodo de diagnóstico (fig. 3 A y B), mientras que en el estadio II (fig. 3C y D) dicho patrón mostraba una mayor variabilidad. En ningún caso se alcanzó una SRI = 1 puntual (curación) a lo largo del periodo de diagnóstico. La SR5 (fig. 3 E a H) muestra las mejoras de la supervivencia condicional a los 5 años entre periodos de diagnóstico. En el estadio I (fig. 3 E y F), las curvas de SR5 se mantuvieron por encima del 95% (EM ≤5%) en el periodo 1995-2004, mostrando que la SR5 de las pacientes diagnosticadas hasta los 49 años de edad podría superar la de las mujeres diagnosticadas entre los 50 y los 59 años, en concreto desde 7,5 años hasta prácticamente 12,5 años de seguimiento. En el estadio II (fig. 3 G y H) parece observarse una clara mejoría de la SR5 en las pacientes diagnosticadas en el periodo 1995-2004, especialmente en el grupo de edad ≤49 años. En estas pacientes, la probabilidad de sobrevivir al CM a 5 años se incrementaría un 5%, es decir, de un 90% (EM = 10%) al inicio del seguimiento a un 95% si la paciente sobrevive 15 años después del diagnóstico del CM. Las tablas I y II del Apéndice online muestran la SRI y la SR5, y sus respectivos IC95%. Finalmente, cabe destacar que en cuanto a las causas básicas de defunción que podrían contribuir a dicho exceso de mortalidad (tabla III del Apéndice online), el CM fue la causa básica de defunción más frecuente, con un 78,49% de las mujeres que fallecieron (1985-1994: 80,14%; 1995-2004: 77,91%), seguida por otros cánceres diferentes del CM (14,88%) y por las enfermedades cardiovasculares (4,3%).
Supervivencia relativa por intervalo anual (paneles A, B, C, D) y condicional a los 5 años (paneles E, F, G, H) a largo plazo de las pacientes diagnosticadas de cáncer de mama antes de los 60 años de edad (≤49 años y 50-59 años) en las provincias de Gerona y Tarragona en estadios I y II: comparación por periodos de diagnóstico comprendidos entre los años 1985-1994 y 1995-2004.
Las mujeres diagnosticadas de CM antes de los 60 años de edad entre 1985 y 2004 en una fase potencialmente curable, como son los estadios I y II, tienen una mediana de supervivencia superior al 70%, pero continúan presentando un EM a largo plazo, más allá de los 10 años de seguimiento. Las pacientes tratadas en el segundo periodo diagnóstico tienen una supervivencia entre un 3,5% y un 15% mayor que las del primer periodo, lo que indica que existen mejoras diagnósticas, en la clasificación del estadio y en los tratamientos. El análisis de las curvas de la SR y la SRI no ha permitido establecer una fracción de pacientes curadas. El patrón general de disminución continua de la SR durante un periodo largo de seguimiento indica que las pacientes sufren un EM a lo largo del tiempo16.
Cabe destacar que la SR5 no alcanzó el 100% a los 15 años de seguimiento, existiendo un EM de un 1-5% en las pacientes diagnosticadas en estadio I y de un 5-10% en las diagnosticadas en estadio II. Según nuestro conocimiento, este es el primer estudio que cuantifica en nuestro entorno el EM por CM en intervalos anuales y quinquenales a largo plazo.
La supervivencia a largo plazo del CM y su posible curación siguen estudiándose, sobre todo desde la experiencia clínica de recidivas a largo plazo de la enfermedad en estadios precoces15. Ya en la década de 1970 se observó que las pacientes con CM y tumores pequeños y favorables tenían un EM significativo a los 15 y 20 años después del tratamiento inicial3. Otros estudios posteriores han seguido mostrando un EM a largo plazo en el CM11,17–19 incluso en mujeres diagnosticadas en un programa de cribado poblacional20. Otro estudio que analizó la SR5 a largo plazo en pacientes adolescentes y jóvenes tratadas por cáncer detectó un EM por CM tras 10 años del diagnóstico21.
La SR pone de manifiesto el EM en relación a la población general, representando una situación hipotética en la que el CM sería la única causa atribuible de muerte; sin embargo, no es exactamente una supervivencia específica de causa. En un estudio anterior observamos que la probabilidad de fallecer por CM a largo plazo superaba a la probabilidad de fallecer por otras causas9, lo que sugiere que el EM a largo plazo puede deberse básicamente al CM. En este sentido, el presente estudio muestra que la mayor parte de las causas básicas de defunción fueron CM (78,49%), mientras que los tumores diferentes de CM fueron un 14,88% y la patología cardiovascular fue un 4,3% (tabla III del Apéndice online). Otros estudios se han posicionado en esta dirección, mostrando que a medida que aumenta el seguimiento cobra importancia la mortalidad por el CM contralateral4,18, y que hay otras causas de muerte que podrían estar aumentadas en estas pacientes, como la patología cardiovascular y otros tipos de cáncer4, sea por un efecto tardío del tratamiento con quimioterapia, hormonoterapia o radioterapia posmastectomía22 o bien por factores de riesgo compartidos con otras enfermedades, como por ejemplo la diabetes23. El estudio del EM secundario a la patología no relacionada con el CM es importante de cara a plantear un seguimiento adecuado de estas pacientes a largo plazo4,18,22–28.
Limitaciones y ventajasPrimero, la comparación de los indicadores de supervivencia entre periodos debe llevarse a cabo con cautela, debido básicamente al déficit de información del estadio en el periodo 1985-1994. Esta situación afecta a la precisión de los estimadores de supervivencia de dicho periodo (nótese que los IC95% de la cohorte 1985-1994 incluyen prácticamente siempre los de la cohorte 1995-2004; v. tabla 1 y fig. 2) y a la comparabilidad de supervivencias entre periodos. Teniendo en cuenta dichas limitaciones, se ha considerado que la información de la que se dispone de 1985-1994 es mínimamente representativa, ya que se llevó a cabo una revisión de historias clínicas en los hospitales de Gerona y Tarragona donde se disponía de información de las pacientes durante este periodo. Por otro lado, los indicadores presentados para el periodo 1995-2004 pueden considerarse robustos, pues solo de un 11% de las mujeres diagnosticadas de CM antes de los 60 años no se dispuso de información referente al TNM.
Segundo, la cohorte diagnosticada en 1995-2004 no tuvo un seguimiento completo de 20 años, ya que únicamente las pacientes diagnosticadas en el año 1995 tuvieron dicho seguimiento. Así, también puede darse el fenómeno de migración del estadio al mejorar las técnicas para evaluar la extensión del tumor (estadios I en el primer periodo pueden haber pasado a estadios II en el segundo periodo por el fenómeno de la migración)29. Esta situación se ha descrito cuando se ha comparado la sexta con la quinta revisión de la clasificación TNM según el American Joint Committee on Cancer, indicando que pacientes clasificadas en la quinta edición como estadio IV podrían ser subdivididas en dos grupos en la sexta edición, mostrando diferencias estadísticamente significativas en la supervivencia30. De esta forma, bajo la hipótesis de que la supervivencia ha mejorado con el periodo de diagnóstico8,11, disponer de seguimiento hasta 20 años de cohortes más recientes, diagnosticadas por ejemplo entre los años 2000 y 2004, podría mejorar las cifras de supervivencia a largo plazo presentadas en estas cohortes. Dichas cohortes se habrían beneficiado de mejoras en el tratamiento1,2,5,6,8 y en el diagnóstico precoz mediante los programas de cribado poblacional1,6,8.
Tercero, otra limitación es no disponer de información de los biomarcadores, de los patrones moleculares ni de la comorbilidad de las pacientes en el periodo de estudio actual. El CM es una enfermedad biológicamente y clínicamente heterogénea, con diferentes subtipos moleculares de diferente pronóstico y distinta respuesta al tratamiento23–28. La disponibilidad de esta información permitiría llevar a cabo una estimación del pronóstico de supervivencia clínicamente más adecuada26 y comparable con estudios más actuales23–28. Según el estudio del International Breast Cancer Study Group con 4105 pacientes tratadas entre 1978 y 1985, el riesgo de recidiva del CM persiste 24 años después del tratamiento24, y dicho riesgo es, a corto plazo (5 años), mayor para las pacientes con tumores con receptores hormonales negativos. Sin embargo, las pacientes con CM con receptores de estrógenos positivos en dicho estudio presentaron un riesgo significativo de recidiva a largo plazo, 10 o 20 años después del diagnóstico23,25. Recientemente se ha constatado que en mujeres diagnosticadas de CM con receptores de estrógenos positivos y en un estadio temprano aún tienen un riesgo persistente de recidiva y muerte por la enfermedad hasta 20 años después del diagnóstico y tras haber recibido 5 años de tratamiento endocrino adyuvante26–28.
Como fortalezas de este estudio cabe destacar que los indicadores utilizados, derivados de la SR y que pueden obtenerse mediante WebSurvCa13, son adecuados para los objetivos considerados, ya que permiten estimar la tendencia temporal de la supervivencia al cáncer. Por otro lado, el método utilizado para valorar una fracción de curación mediante la evolución temporal del EM tiene dos ventajas: no implica asumir ningún modelo estadístico y permite una fácil interpretación de los resultados.
ConclusiónA pesar de que la supervivencia a largo plazo en las pacientes diagnosticadas de CM antes de los 60 años de edad en estadios localizados mejoró entre ambos periodos, no fue posible establecer una fracción de pacientes curadas debido a que el EM en dichas mujeres se encontró entre un 5% y un 10% a los 20 años de seguimiento. Como recomendación, debería asegurarse un control a largo plazo de la patología asociada en estas pacientes, potencialmente curables, para una detección temprana de segundas neoplasias y no descartar la posibilidad de una recidiva tardía.
Las perspectivas de las probabilidades de supervivencia y de curación del cáncer de mama a largo plazo son de gran interés, y su valor en nuestro medio no es conocido. El exceso de mortalidad del cáncer de mama disminuye a largo plazo.
¿Qué añade el estudio realizado a la literatura?Este estudio estima por primera vez el exceso de mortalidad a largo plazo del cáncer de mama en Gerona y Tarragona, que es de al menos un 5% en estadios precoces y sin poder establecer una fracción de pacientes curadas. A pesar de las mejoras en la supervivencia de dicho cáncer, este resultado tiene implicaciones clínicas que deben ser comunicadas de forma adecuada a las pacientes.
María-Victoria Zunzunegui.
Declaración de transparenciaEl autor principal (garante responsable del manuscrito) afirma que este manuscrito es un reporte honesto, preciso y transparente del estudio que se remite a Gaceta Sanitaria, que no se han omitido aspectos importantes del estudio, y que las discrepancias del estudio según lo previsto (y, si son relevantes, registradas) se han explicado.
Contribuciones de autoríaLa concepción del artículo es de todos/as los/las autores/as. Los párrafos correspondientes a la metodología han sido redactados por R. Clèries, M. Buxó, A. Ameijide, M. Vilardell y J.M. Martínez. El trabajo de campo de codificación de estadios de la cohorte y su verificación lo han llevado a cabo M.L. Vilardell, R. Marcos-Gragera, A. Izquierdo, M. Carulla y J. Galceran. La discusión epidemiológica y la versión final se han basado en las aportaciones de todas las personas firmantes.
FinanciaciónEste trabajo es uno de los objetivos de un estudio que ha sido subvencionado por el Instituto de Salud Carlos III mediante el proyecto “PI14/01041” (Cofinanciado por el Fondo Europeo de Desarrollo Regional/Fondo Social Europeo. “Una manera de hacer Europa”/“El FSE invierte en tu futuro”). Agradecemos al programa CERCA/Generalitat de Catalunya por el soporte institucional.
Conflictos de interesesNinguno.