Hemos leído con interés el artículo publicado por Ubago Pérez et al.1, titulado Guía metodológica para la evaluación de la eficacia y la seguridad de nuevos fármacos: implementación de las recomendaciones de EUnetHTA. En él se describen brevemente los métodos empleados para elaborar informes de síntesis de la evidencia de nuevos medicamentos. Sobre estas evaluaciones, los autores comentan que vienen utilizándose en la actividad evaluadora de apoyo a la elaboración de informes de posicionamiento terapéutico que se publican en el Sistema Nacional de Salud (SNS) por la Agencia Española de Medicamentos y Productos Sanitarios. Aprovechando el debate existente sobre el papel de la evaluación de tecnologías sanitarias en el SNS2, nos gustaría comentar algunos aspectos y aclaraciones que consideramos importantes.
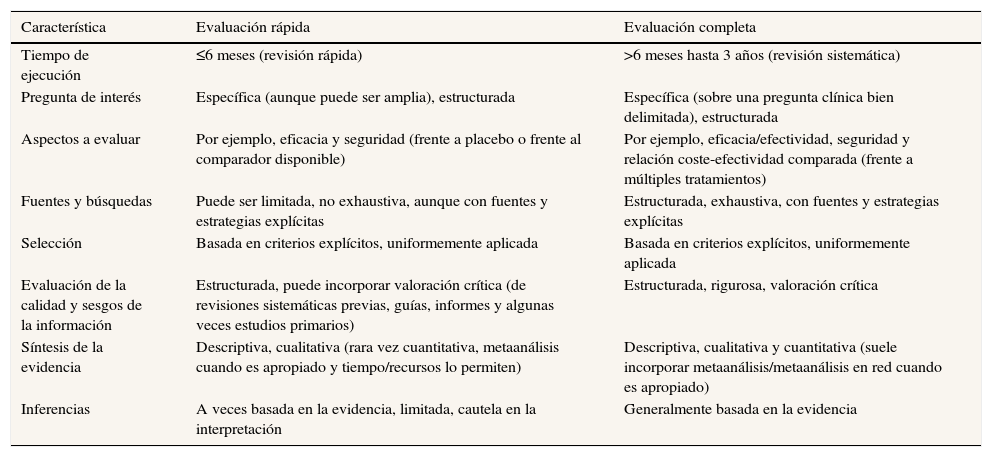
Planificar y elaborar evaluaciones de tecnologías sanitarias rigurosas que sirvan para informar la toma de decisiones (atendiendo a criterios de seguridad, eficacia/efectividad y coste-efectividad) es una actividad prioritaria en distintos servicios de salud. En los últimos años se han propuesto productos de síntesis de la evidencia complementarios (no sustitutorios) a la evaluación completa de tecnologías sanitarias, algunos de los cuales pueden enmarcarse dentro de programas o sistemas de evaluación rápida de la evidencia. Parece ser el caso particular del tipo de evaluaciones descritas en la guía presentada1, que sigue el modelo básico para evaluaciones rápidas de efectividad comparada (HTA Core Model for rapid relative effectiveness assessments) propuesto por EUnetHTA (European Network for Health Technology Assessment). Del artículo parece extraerse que los informes de evaluación de nuevos medicamentos elaborados (por la Agencia de Evaluación de Tecnologías Sanitarias de Andalucía) para informar el posicionamiento terapéutico y la fijación de precios en el SNS adoptan métodos simplificados y acelerados en lugar de optar firmemente por evaluaciones de tecnologías sanitarias más completas y exhaustivas (p. ej., evaluaciones terapéuticas completas que consideren de manera simultánea la relación coste-efectividad de múltiples tratamientos para un problema de salud). Es importante destacar que, a diferencia de las evaluaciones completas de tecnologías sanitarias (tabla 1), las evaluaciones rápidas3 suelen omitir o simplificar etapas (p. ej., limitar el alcance de la evaluación a la eficacia y la seguridad, limitar las fuentes de información y búsquedas, limitar por fecha de publicación) para poder elaborar una síntesis acelerada. Sin embargo, ello también puede conducir a que se produzcan potenciales sesgos y errores durante la evaluación (p. ej., omisión de tratamientos relevantes, omisión de estudios con información de interés, errores en la extracción de datos, sesgos de publicación)3.
Diferencias entre evaluaciones rápidas y completas
| Característica | Evaluación rápida | Evaluación completa |
|---|---|---|
| Tiempo de ejecución | ≤6 meses (revisión rápida) | >6 meses hasta 3 años (revisión sistemática) |
| Pregunta de interés | Específica (aunque puede ser amplia), estructurada | Específica (sobre una pregunta clínica bien delimitada), estructurada |
| Aspectos a evaluar | Por ejemplo, eficacia y seguridad (frente a placebo o frente al comparador disponible) | Por ejemplo, eficacia/efectividad, seguridad y relación coste-efectividad comparada (frente a múltiples tratamientos) |
| Fuentes y búsquedas | Puede ser limitada, no exhaustiva, aunque con fuentes y estrategias explícitas | Estructurada, exhaustiva, con fuentes y estrategias explícitas |
| Selección | Basada en criterios explícitos, uniformemente aplicada | Basada en criterios explícitos, uniformemente aplicada |
| Evaluación de la calidad y sesgos de la información | Estructurada, puede incorporar valoración crítica (de revisiones sistemáticas previas, guías, informes y algunas veces estudios primarios) | Estructurada, rigurosa, valoración crítica |
| Síntesis de la evidencia | Descriptiva, cualitativa (rara vez cuantitativa, metaanálisis cuando es apropiado y tiempo/recursos lo permiten) | Descriptiva, cualitativa y cuantitativa (suele incorporar metaanálisis/metaanálisis en red cuando es apropiado) |
| Inferencias | A veces basada en la evidencia, limitada, cautela en la interpretación | Generalmente basada en la evidencia |
Fuente: adaptada de la ref. 3.
Durante años se han estado aplicando metodologías muy diversas para elaborar evaluaciones rápidas de tecnologías sanitarias. No obstante, la descripción de los métodos y de los resultados de las evaluaciones publicadas continúa siendo deficiente4. Cualquier evaluación de tecnologías sanitarias que pretenda informar la toma de decisiones debería aplicar procesos transparentes y explícitos. Evaluar la metodología de las evaluaciones de tecnologías sanitarias nos da a conocer mejor las características de las evaluaciones disponibles5, de manera que es presumible que algunas de las iniciativas mencionadas por Ubago Pérez et al.1 contribuyan a mejorar la presentación de futuras evaluaciones rápidas de nuevos medicamentos y otras tecnologías.
Contribuciones de autoríaF. Catalá-López y M. Ridao han contribuido a la escritura del trabajo, han realizado la revisión crítica con importantes contribuciones intelectuales y han aprobado la versión final del manuscrito para su publicación.
FinanciaciónF. Catalá-López ha recibido ayudas de la Generalitat Valenciana (PROMETEOII/2015/021). M. Ridao ha recibido ayudas de la Red de Investigación en Servicios de Salud en Enfermedades Crónicas (REDISSEC), del Instituto de Salud Carlos III.