Bexsero® (4CMenB), vacuna contra el meningococo B, fue autorizada en Europa en 2013. En España, a pesar de que el meningococo B es la principal causa de enfermedad meningocócica invasiva (EMI), Bexsero® está recomendada y financiada para pacientes con alto riesgo de EMI pero no de forma sistemática en el calendario vacunal del SNS.
ObjetivoEvaluar el coste-utilidad, el impacto epidemiológico y los costes totales de la introducción de 4CMenB para una política vacunal informada en España.
MétodoSe adaptó para España un análisis de coste-utilidad, árbol de decisión probabilístico. Una cohorte de recién nacidos en 2015 fue modelizada con dos posologías mediante dos estrategias: vacunación sistemática con 4CMenB o no vacunación. Los costes se midieron desde la perspectiva del pagador y los beneficios se calcularon en años de vida ajustados por calidad (AVAC). Se realizó un análisis de Monte Carlo y se consideraron 32 escenarios para valorar la robustez y la incertidumbre de los resultados.
ResultadosCon la pauta 3+1, la vacunación sistemática previno el 54% de los casos y de las muertes, y se estimó una razón de coste-utilidad incremental (RCUI) de 351.389 €/AVAC (intervalo de confianza del 95% [IC95%]: 265.193-538.428). La pauta 2+1 previno el 50% de los casos y de las muertes, con una RCUI de 278.556 €/AVAC (IC95%: 210.285-430.122).
ConclusionesDada la incidencia actual de enfermedad meningocócica invasiva en España y la información disponible sobre 4CMenB, nuestro modelo indica que la vacunación sistemática no es coste-efectiva con el actual precio. Solo con un precio de 1,45 € para la pauta 3+1 o de 3,37 € para la pauta 2+1 podría ser recomendada basándose en su eficiencia.
Bexsero® (4CMenB), meningococcal B vaccine, was licensed in Europe in 2013. In Spain, despite MenB being the most frequent cause of invasive meningococcal disease (IMD), Bexsero® is recommended and financed for patients at increased risk of IMD but is not financed by the NHS in the routine vaccination schedule.
Objectiveto evaluate the cost-utility, epidemiological impact, and total costs of the introduction of 4CMenB into the vaccination schedule to help inform vaccine policy in Spain.
MethodWe adapted a cost-utility analysis, a probabilistic decision-tree, to Spain. A cohort of new-born infants in 2015 was modelled with two dosages, using two different strategies: routine vaccination schedule with 4CMenB and non-vaccination. Costs were measured from a payer perspective and benefits were calculated in quality-adjusted life years (QALYs). A Monte Carlo analysis and 32 scenarios were performed to assess the robustness and the uncertainty of our results.
ResultsWith the 3+1 dosage, routine vaccination prevented 54% of cases and deaths and an incremental cost-utility ratio (ICUR) of 351.389 €/QALY (95% confidence interval [95%CI]: 265,193-538,428) was estimated. The 2+1 dosage prevented 50% of cases and deaths, with an ICUR of 278.556 €/QALY (95%CI: 210,285-430,122).
ConclusionsGiven the current incidence of invasive meningococcal disease in Spain and the information available from 4CMenB, our model shows that routine vaccination is not cost-effective at the current price. Only with a vaccine price of 1.45 € for the 3+1 schedule or 3.37 € for the 2+1 schedule could it be recommended based on efficiency criteria.
Neisseria meningitidis (meningococo), bacteria gramnegativa con reservorio humano en la nasofaringe, es una de las principales causas de infecciones bacterianas invasivas en el mundo1. Seis serogrupos, que se clasifican por sus polisacáridos capsulares, tienen riesgo para la salud: A, B, C, W, X, Y2. La bacteria puede superar las barreras defensivas del organismo y propagarse al sistema nervioso central, originando una enfermedad meningocócica invasiva (EMI) y produciendo meningitis, sepsis o ambas. La EMI puede tener consecuencias muy graves, incluyendo daño cerebral, pérdida auditiva, pérdida de miembros, alteraciones del neurodesarrollo y muerte. Se han identificado factores de riesgo que facilitan este proceso de invasión, como la exposición al humo del tabaco, el tiempo seco y frío, el hacinamiento y la infección por el virus de la gripe2,3.
En 2016 se notificaron 3280 casos de EMI en Europa, con 304 muertes4. En España, en la temporada 2017-2018 se notificaron 372 casos, de los que se confirmaron 346 (incidencia de 0,74/100.000 habitantes); de ellos, 142 (41%; incidencia de 0,3/100.000 habitantes) fueron causados por el serogrupo B. La incidencia de EMI por el serogrupo B ha disminuido desde la temporada 1999-2000 (0,69/100.000 habitantes), y el descenso es más importante en los menores de 1 año (24,99/100.000 habitantes en 1999-2000 a 5,85/100.000 habitantes en 2017-2018)5.
La técnica de vacunología inversa permitió la identificación de las proteínas (NadA, NHBA, fHbp y PorA) utilizadas para la fabricación de la vacuna frente a N. meningitidis del serogrupo B, 4CMenB (Bexsero®)6. Estos antígenos pueden encontrarse o no en las diferentes cepas de N. meningitidis serogrupo B, y la técnica MATS (Meningococcal Antigen Typing System; ELISA cuantitativo y cualitativo) evalúa si la cepa bacteriana estaría cubierta por la vacuna7.
La ficha técnica inicial de 4CMenB en 2013 indicaba tres pautas de vacunación posibles según la edad de inicio: comienzo antes de los 6 meses, tres dosis más un recuerdo (3+1); comienzo entre los 6 meses y 2 años, tres dosis (2+1); comienzo desde los 2 años, dos dosis. En junio de 2018 se autorizó una pauta 2+1 para comenzar a los 3-5 meses, utilizada en el Reino Unido para la vacunación sistemática8. La primera dosis no debe administrarse antes de los 2 meses de edad, límite actual establecido de seguridad y eficacia para 4CMenB6.
Tras su aprobación en España en junio de 2013, la Agencia Española de Medicamentos y Productos Sanitarios la clasificó como medicamento de uso hospitalario y autorizó su administración en personas con deficiencias del complemento, asplenia o en tratamiento con eculizumab, personal de laboratorio en contacto con N. meningitidis, y en casos de brote y estudios de contactos, todo ello según la epidemiología del momento y los criterios de introducción de vacunas en el programa vacunal9.
Tras una nueva evaluación de su seguridad, en septiembre de 2015 pasó a ser un medicamento sujeto a prescripción médica disponible en farmacias al precio de 105,60 € la dosis10. Esta modificación originó una gran demanda entre la población. En 2016, España fue el país del mundo donde más se consumió esta vacuna (17% de la producción mundial), aun teniendo unas tasas de la enfermedad inferiores a las de otros países. Casi el 65% de los niños que la recibieron tenían entre 2 y 11 años, y solo un 13% se administraron a niños menores de 1 año, que es el colectivo más vulnerable11.
La Asociación Española de Pediatría viene defendiendo desde 2014 su inclusión en el calendario vacunal sistemático en España12.
El objetivo de este estudio es evaluar el coste-utilidad de la inclusión de 4CMenB en el calendario vacunal sistemático en España.
MétodoSe realizó una evaluación económica de coste-utilidad con perspectiva del pagador (Sistema Nacional de Salud) y siguiendo la guía de López-Bastida et al.13 (véase tabla I del Apéndice online). La población de estudio fueron todos los recién nacidos en España durante el año 2015 (418.432)14. Se compararon dos estrategias: la introducción de la vacunación sistemática en los recién nacidos frente a la no introducción de la vacuna en el calendario sistemático (estado actual). Se realizó un modelo con la pauta 3+1 (2, 4, 6 y 12 meses) y otro con la pauta 2+1 (3, 5 y 12 meses). Como horizonte temporal se consideró la esperanza de vida de la cohorte modelizada (82,7 años).15
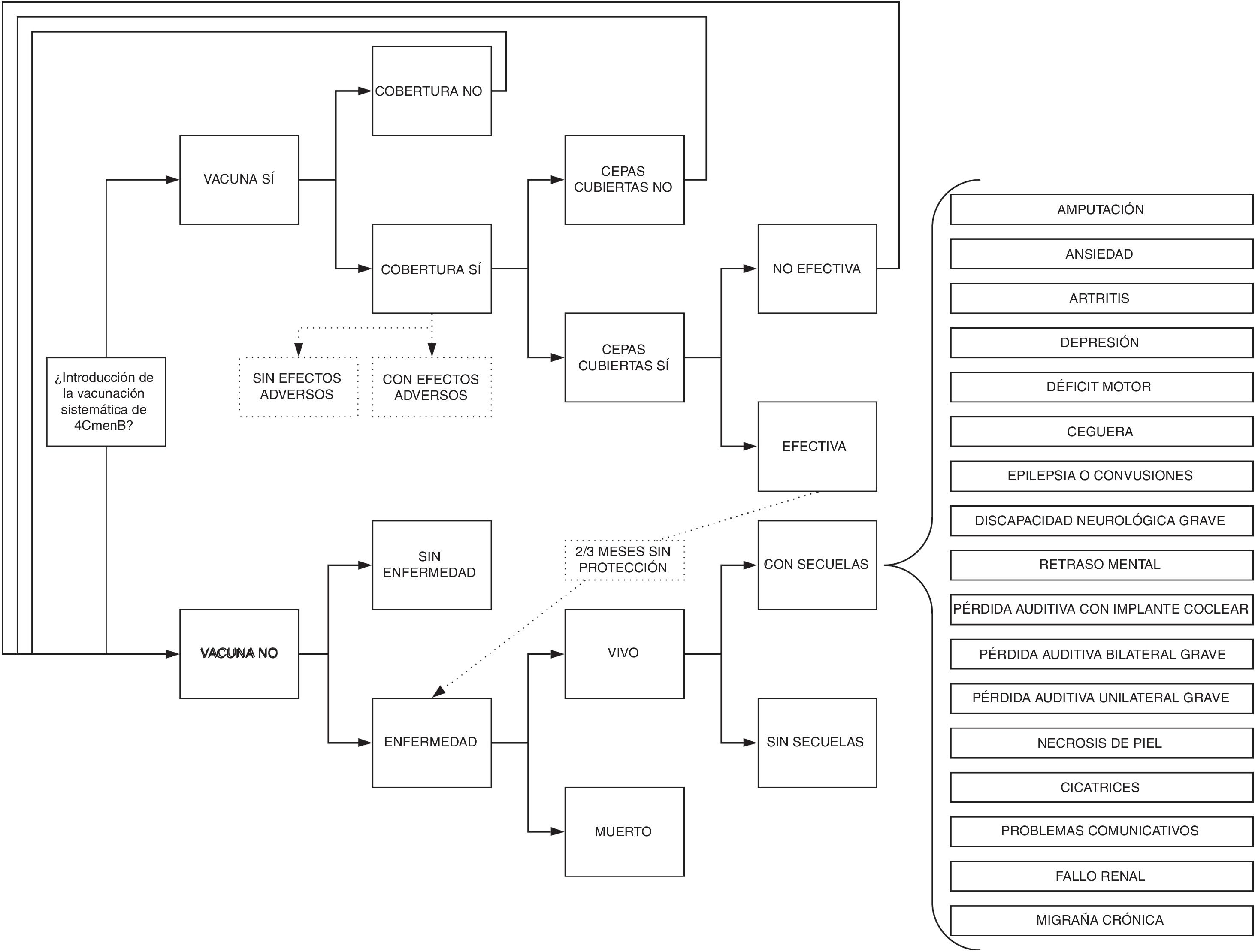
ModeloSe realizó un árbol de decisión modificado de Gasparini et al.16 (fig. 1) que emplea las dos estrategias mencionadas. En la estrategia de vacunación, los niños pueden o no ser vacunados (cobertura de vacunación), y los vacunados sufrirán los efectos adversos de 4CMenB. Los vacunados tendrán protección contra un porcentaje de cepas de meningococo B (estimado según MATS). En los vacunados y cubierta la cepa por MATS, se divide entre vacunación efectiva o no. Los niños vacunados, con cepas cubiertas y vacunación efectiva no padecerán la enfermedad en la franja temporal de cobertura de la vacuna (desde los 2 o 3 meses hasta los 48 meses)17. Los niños que no se hayan vacunado, que la cepa no esté cubierta por la vacuna o que esta no haya sido efectiva sufrirán la enfermedad igual que en la estrategia de no vacunación. En la estrategia de no vacunación, la enfermedad se presenta en la cohorte según la tasa de incidencia por edad.
Con respecto al modelo de Gasparini et al.16 se incluyeron el porcentaje de cepas cubiertas en España según MATS y la incidencia en los meses hasta la primera dosis de 4CMenB. Este modelo es adecuado ya que la enfermedad no muestra un patrón de recurrencia-remisión de estados de salud que haga que sea estrictamente necesario un modelo de Markov. Aunque un árbol de decisión no tiene ciclos, nuestro modelo tiene en cuenta el tiempo en que ocurre la aparición de EMI y, si se sobrevive, su impacto en el resto de la vida de la persona, al calcular los costes y los años de vida ajustados por calidad (AVAC) de forma anual y sumarlos para la totalidad del horizonte temporal del modelo.
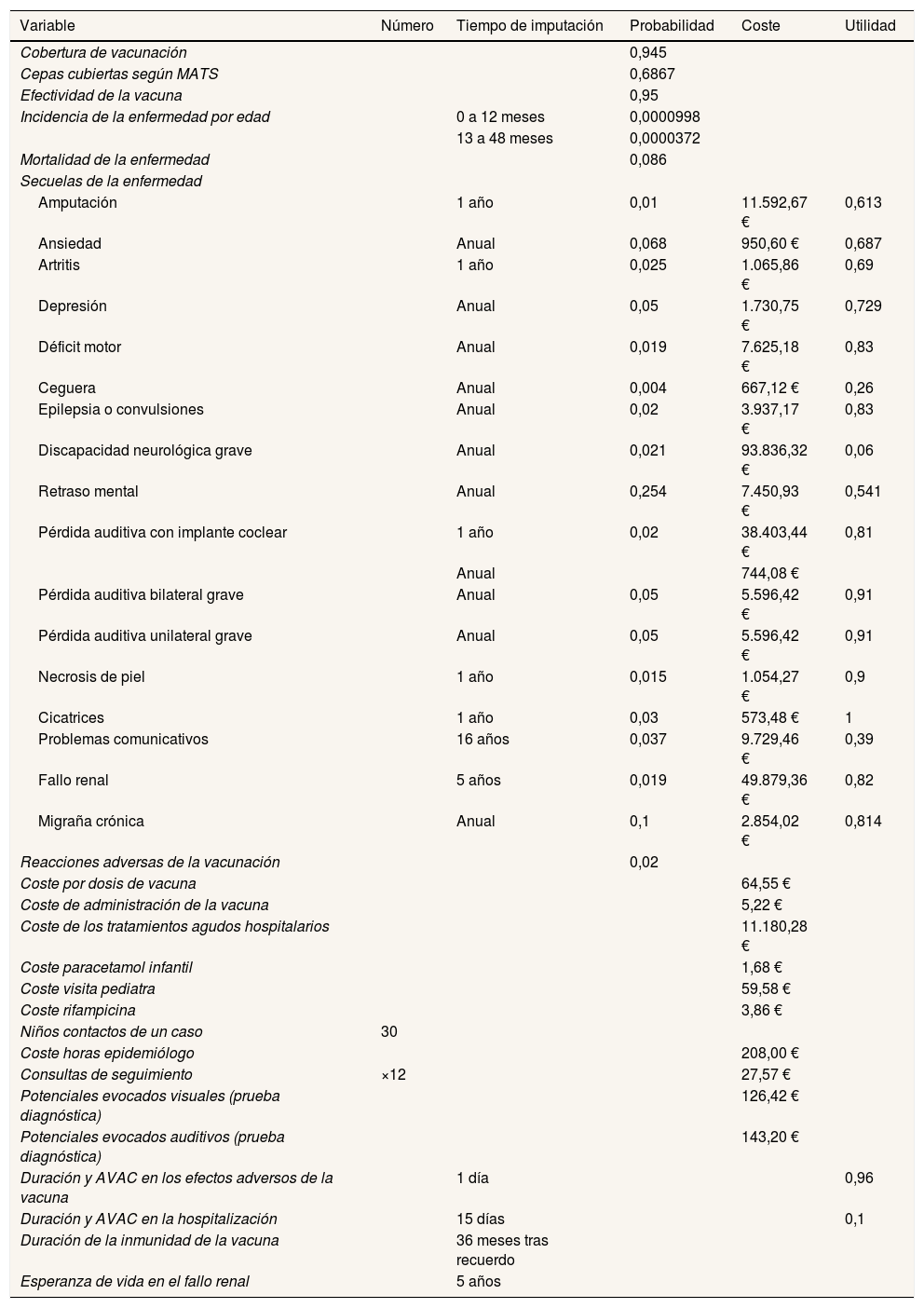
Todas las variables del modelo (probabilidades, costes, utilidad y tiempo) se presentan en la tabla 1. Sus fuentes se detallan en la tabla II del Apéndice online.
Resumen de las variables incluidas en el modelo (valor en escenario base)
| Variable | Número | Tiempo de imputación | Probabilidad | Coste | Utilidad |
|---|---|---|---|---|---|
| Cobertura de vacunación | 0,945 | ||||
| Cepas cubiertas según MATS | 0,6867 | ||||
| Efectividad de la vacuna | 0,95 | ||||
| Incidencia de la enfermedad por edad | 0 a 12 meses | 0,0000998 | |||
| 13 a 48 meses | 0,0000372 | ||||
| Mortalidad de la enfermedad | 0,086 | ||||
| Secuelas de la enfermedad | |||||
| Amputación | 1 año | 0,01 | 11.592,67 € | 0,613 | |
| Ansiedad | Anual | 0,068 | 950,60 € | 0,687 | |
| Artritis | 1 año | 0,025 | 1.065,86 € | 0,69 | |
| Depresión | Anual | 0,05 | 1.730,75 € | 0,729 | |
| Déficit motor | Anual | 0,019 | 7.625,18 € | 0,83 | |
| Ceguera | Anual | 0,004 | 667,12 € | 0,26 | |
| Epilepsia o convulsiones | Anual | 0,02 | 3.937,17 € | 0,83 | |
| Discapacidad neurológica grave | Anual | 0,021 | 93.836,32 € | 0,06 | |
| Retraso mental | Anual | 0,254 | 7.450,93 € | 0,541 | |
| Pérdida auditiva con implante coclear | 1 año | 0,02 | 38.403,44 € | 0,81 | |
| Anual | 744,08 € | ||||
| Pérdida auditiva bilateral grave | Anual | 0,05 | 5.596,42 € | 0,91 | |
| Pérdida auditiva unilateral grave | Anual | 0,05 | 5.596,42 € | 0,91 | |
| Necrosis de piel | 1 año | 0,015 | 1.054,27 € | 0,9 | |
| Cicatrices | 1 año | 0,03 | 573,48 € | 1 | |
| Problemas comunicativos | 16 años | 0,037 | 9.729,46 € | 0,39 | |
| Fallo renal | 5 años | 0,019 | 49.879,36 € | 0,82 | |
| Migraña crónica | Anual | 0,1 | 2.854,02 € | 0,814 | |
| Reacciones adversas de la vacunación | 0,02 | ||||
| Coste por dosis de vacuna | 64,55 € | ||||
| Coste de administración de la vacuna | 5,22 € | ||||
| Coste de los tratamientos agudos hospitalarios | 11.180,28 € | ||||
| Coste paracetamol infantil | 1,68 € | ||||
| Coste visita pediatra | 59,58 € | ||||
| Coste rifampicina | 3,86 € | ||||
| Niños contactos de un caso | 30 | ||||
| Coste horas epidemiólogo | 208,00 € | ||||
| Consultas de seguimiento | ×12 | 27,57 € | |||
| Potenciales evocados visuales (prueba diagnóstica) | 126,42 € | ||||
| Potenciales evocados auditivos (prueba diagnóstica) | 143,20 € | ||||
| Duración y AVAC en los efectos adversos de la vacuna | 1 día | 0,96 | |||
| Duración y AVAC en la hospitalización | 15 días | 0,1 | |||
| Duración de la inmunidad de la vacuna | 36 meses tras recuerdo | ||||
| Esperanza de vida en el fallo renal | 5 años |
AVAC: años de vida ajustados por calidad; MATS: Meningococcal Antigen Typing System.
En la tabla II del Apéndice online se encuentran todas las variables y las fuentes de donde fueron extraídos los datos. Costes ajustados al año 2015.
En las secuelas, la columna «Tiempo de imputación» se refiere a la duración de los costes, y «Utilidad» se atribuye a la esperanza de vida.
Los datos de incidencia, mortalidad y cohorte de inicio usados en el estudio fueron los publicados para la temporada 2013-201418, ya que fue en septiembre de 2015 cuando se permitió la venta en farmacias de 4CMenB y los datos posteriores podrían estar sesgados por el efecto de la vacuna en la población.
Los costes se ajustaron al valor de 2015 a través del Índice de Precios al Consumidor. Los costes de la vacuna y de su administración se imputan a los cubiertos por la campaña de vacunación; los costes de las reacciones adversas, a los afectados; los costes de salud pública y de tratamientos agudos hospitalarios, a los casos; los costes de seguimientos, a los supervivientes de EMI; y los costes de las secuelas, a los afectados por ellas.
Se usó el umbral de razón coste-utilidad incremental (RCUI) propuesto por Vallejo Torres et al.19 (24.000 €/AVAC), ya que no existe uno dictado por las autoridades sanitarias. Se aplicó una tasa de descuento del 3% anual para los costes y los AVAC13.
En cuanto a los efectos adversos, 4CMenB produce reacción febril (>38°C) y reacciones locales con más frecuencia que otras vacunas sistemáticas, en especial si se administra de manera concomitante con las vacunaciones del calendario, por lo que se recomienda la vacunación separada del calendario actual y en ocasiones el uso de paracetamol profiláctico. Los casos de EMI que se generasen tras los 48 meses no están contemplados en los costes totales de ninguno de los dos modelos, ya que no serían prevenibles según la posología y la inmunogenicidad actual de la vacuna.17
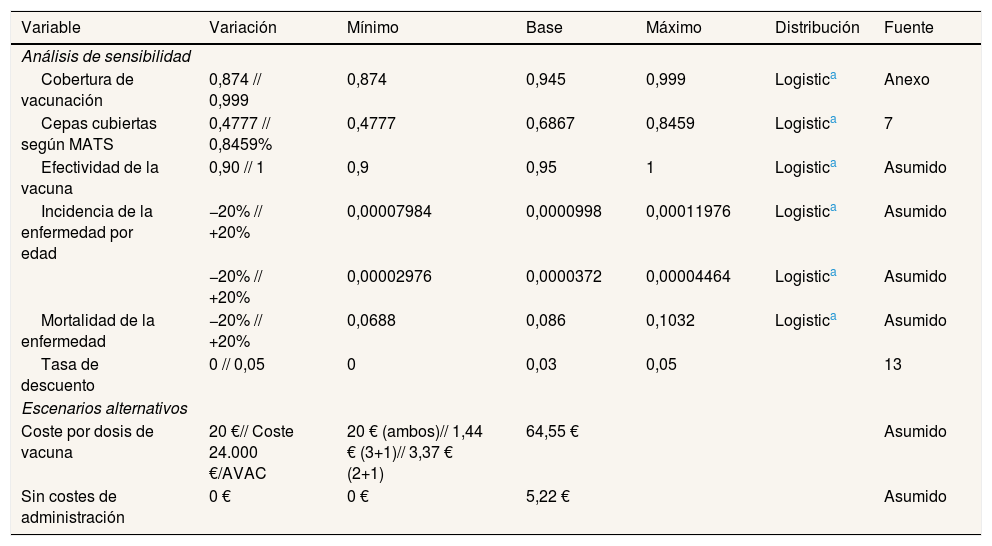
Análisis de sensibilidad univariante, probabilístico y según los escenariosSe realizaron un análisis de sensibilidad univariante y otro probabilístico (Monte Carlo con 1000 simulaciones)20 en los modelos base modificando las seis variables más relevantes para observar cómo afectaban al modelo (12 escenarios). Además, se crearon tres escenarios alternativos: 1 y 2) modificaciones del coste de la dosis vacunal; y 3) escenario sin costes de administración (aunque actualmente se recomienda su administración separada de las vacunas sistemáticas, por el aumento de los efectos adversos si se administra de manera concomitante17, podría existir la opción futura de unirla). Los precios alternativos de la dosis vacunal son 20 €, que es el precio de referencia intermedio usado en otros estudios internacionales, y el precio al cual el modelo ofrece una RCUI de 24.000 €/AVAC. Por tanto, se crearon 32 escenarios diferentes, 16 en cada modelo (tabla 2).
Variables modificadas en el análisis de sensibilidad y en los diferentes escenarios
| Variable | Variación | Mínimo | Base | Máximo | Distribución | Fuente |
|---|---|---|---|---|---|---|
| Análisis de sensibilidad | ||||||
| Cobertura de vacunación | 0,874 // 0,999 | 0,874 | 0,945 | 0,999 | Logistica | Anexo |
| Cepas cubiertas según MATS | 0,4777 // 0,8459% | 0,4777 | 0,6867 | 0,8459 | Logistica | 7 |
| Efectividad de la vacuna | 0,90 // 1 | 0,9 | 0,95 | 1 | Logistica | Asumido |
| Incidencia de la enfermedad por edad | −20% // +20% | 0,00007984 | 0,0000998 | 0,00011976 | Logistica | Asumido |
| −20% // +20% | 0,00002976 | 0,0000372 | 0,00004464 | Logistica | Asumido | |
| Mortalidad de la enfermedad | −20% // +20% | 0,0688 | 0,086 | 0,1032 | Logistica | Asumido |
| Tasa de descuento | 0 // 0,05 | 0 | 0,03 | 0,05 | 13 | |
| Escenarios alternativos | ||||||
| Coste por dosis de vacuna | 20 €// Coste 24.000 €/AVAC | 20 € (ambos)// 1,44 € (3+1)// 3,37 € (2+1) | 64,55 € | Asumido | ||
| Sin costes de administración | 0 € | 0 € | 5,22 € | Asumido | ||
AVAC: años de vida ajustados por calidad; MATS: Meningococcal Antigen Typing System.
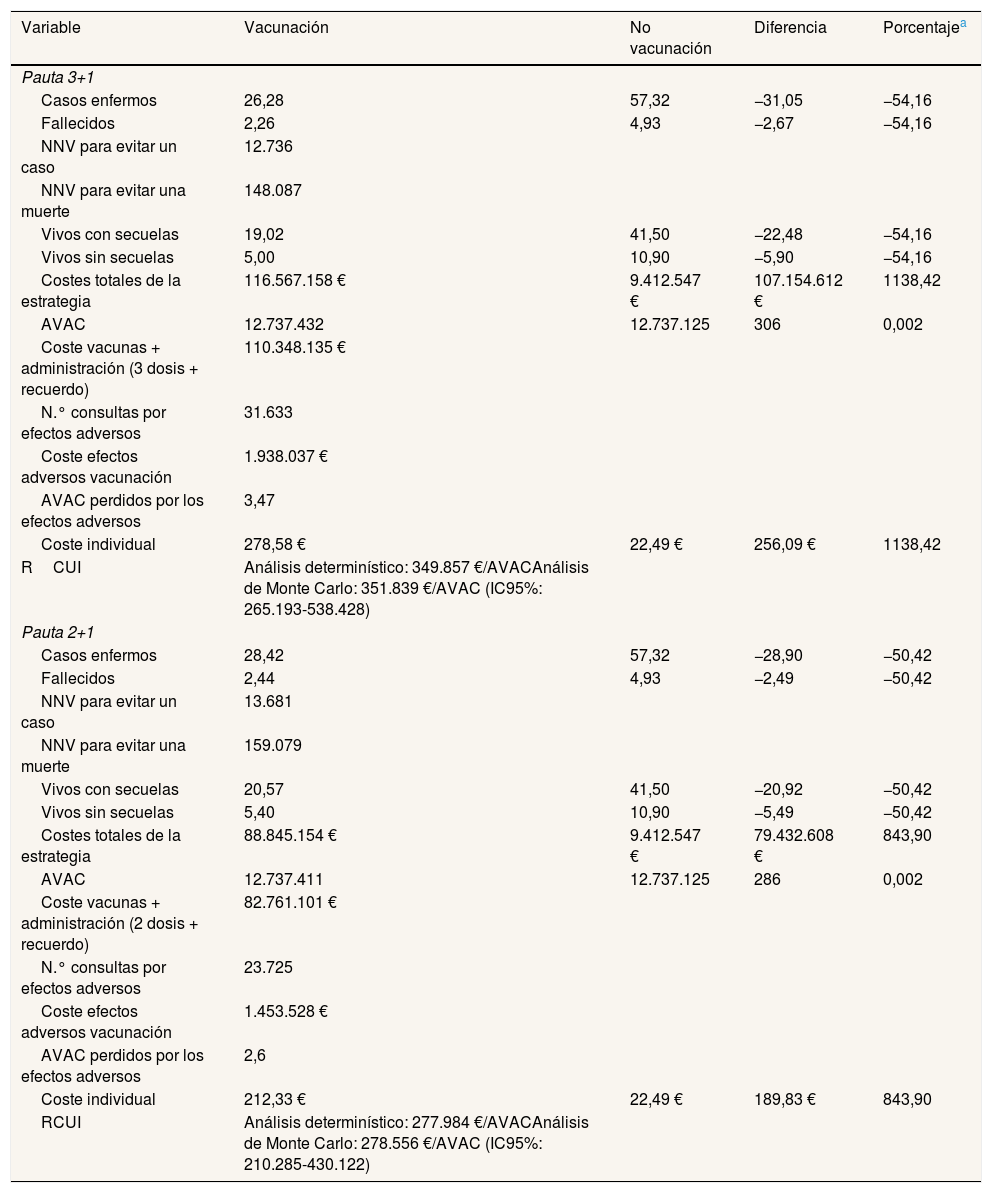
El impacto epidemiológico de la introducción de la vacunación sistemática con 4CMenB supondría, en la franja de 0 a 4 años de edad, una reducción de 31 casos y 3 muertes en el modelo 3+1, y de 29 casos y 2 muertes en el modelo 2+1. Seguirían existiendo casos en las estrategias de vacunación de ambos modelos. Se necesita vacunar a 12.736 niños para evitar un caso y a 148.087 para evitar una muerte en el modelo 3+1, y a 13.681 y 159.079, respectivamente, en el modelo 2+1. La RCUI del modelo 3+1 es de 351.839 €/AVAC (intervalo de confianza del 95% [IC95%]: 265.193-538.428) y la del modelo 2+1 es de 278.556 €/AVAC (IC95%: 210.285-430.122) (tabla 3 y tablas III y IV del Apéndice online).
Resultados en los escenarios base
| Variable | Vacunación | No vacunación | Diferencia | Porcentajea |
|---|---|---|---|---|
| Pauta 3+1 | ||||
| Casos enfermos | 26,28 | 57,32 | −31,05 | −54,16 |
| Fallecidos | 2,26 | 4,93 | −2,67 | −54,16 |
| NNV para evitar un caso | 12.736 | |||
| NNV para evitar una muerte | 148.087 | |||
| Vivos con secuelas | 19,02 | 41,50 | −22,48 | −54,16 |
| Vivos sin secuelas | 5,00 | 10,90 | −5,90 | −54,16 |
| Costes totales de la estrategia | 116.567.158 € | 9.412.547 € | 107.154.612 € | 1138,42 |
| AVAC | 12.737.432 | 12.737.125 | 306 | 0,002 |
| Coste vacunas + administración (3 dosis + recuerdo) | 110.348.135 € | |||
| N.° consultas por efectos adversos | 31.633 | |||
| Coste efectos adversos vacunación | 1.938.037 € | |||
| AVAC perdidos por los efectos adversos | 3,47 | |||
| Coste individual | 278,58 € | 22,49 € | 256,09 € | 1138,42 |
| RCUI | Análisis determinístico: 349.857 €/AVACAnálisis de Monte Carlo: 351.839 €/AVAC (IC95%: 265.193-538.428) | |||
| Pauta 2+1 | ||||
| Casos enfermos | 28,42 | 57,32 | −28,90 | −50,42 |
| Fallecidos | 2,44 | 4,93 | −2,49 | −50,42 |
| NNV para evitar un caso | 13.681 | |||
| NNV para evitar una muerte | 159.079 | |||
| Vivos con secuelas | 20,57 | 41,50 | −20,92 | −50,42 |
| Vivos sin secuelas | 5,40 | 10,90 | −5,49 | −50,42 |
| Costes totales de la estrategia | 88.845.154 € | 9.412.547 € | 79.432.608 € | 843,90 |
| AVAC | 12.737.411 | 12.737.125 | 286 | 0,002 |
| Coste vacunas + administración (2 dosis + recuerdo) | 82.761.101 € | |||
| N.° consultas por efectos adversos | 23.725 | |||
| Coste efectos adversos vacunación | 1.453.528 € | |||
| AVAC perdidos por los efectos adversos | 2,6 | |||
| Coste individual | 212,33 € | 22,49 € | 189,83 € | 843,90 |
| RCUI | Análisis determinístico: 277.984 €/AVACAnálisis de Monte Carlo: 278.556 €/AVAC (IC95%: 210.285-430.122) |
AVAC: años de vida ajustados por calidad; IC95%: intervalo de confianza del 95%; NNV: número necesario de personas a vacunar; RCUI: razón coste-utilidad incremental.
La estrategia de vacunación sistemática supondría un coste de 116 M€ con la pauta 3+1 o de 89 M€ con la pauta 2+1. La estrategia de no vacunación supondría en ambos casos 9,4 M€. En la estrategia de introducción, el coste en vacunas supone un 88% del coste total con la pauta 3+1 y un 86% con la pauta 2+1.
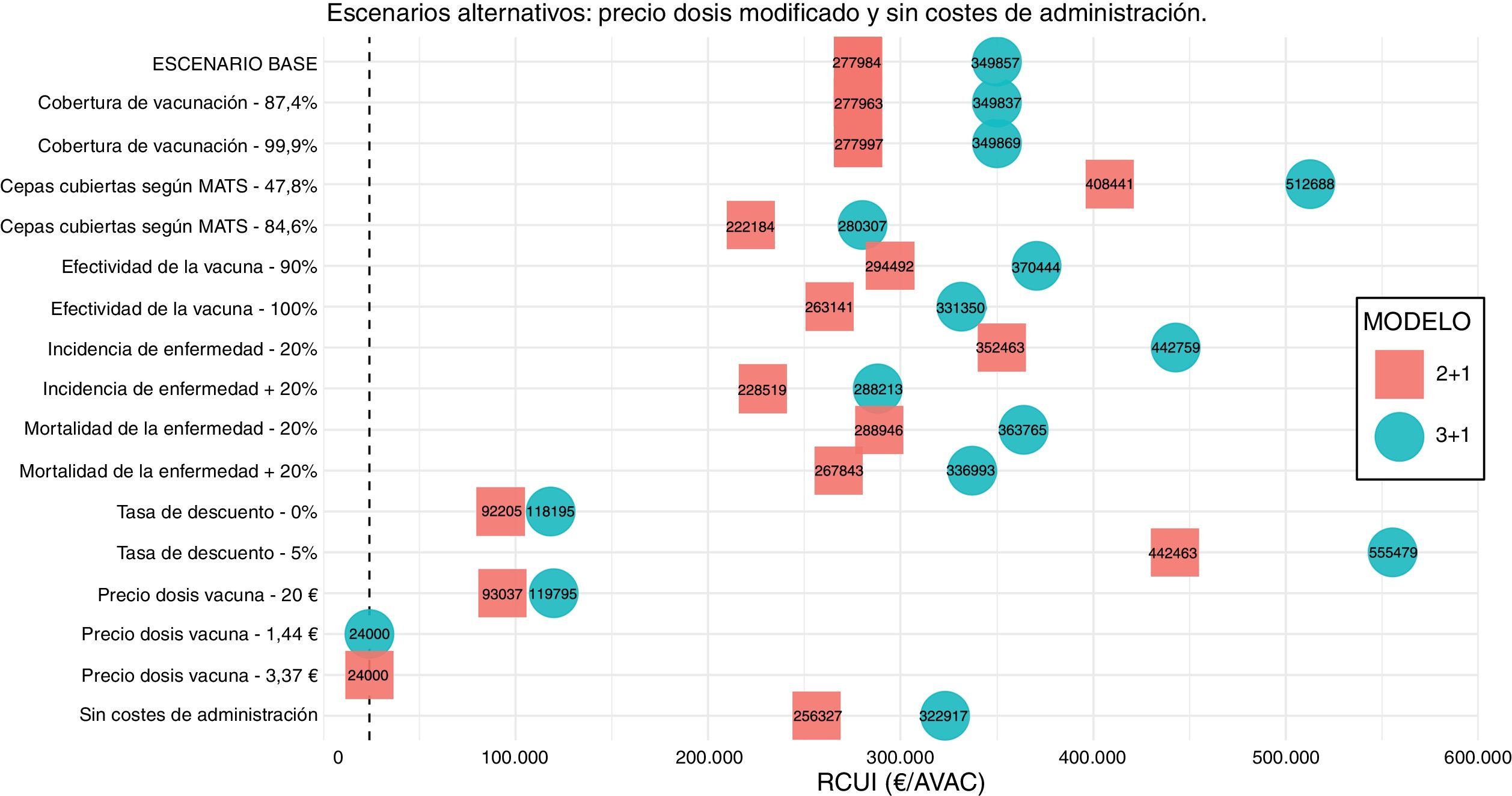
Análisis de sensibilidad y escenarios alternativosCon respecto a los 32 escenarios (fig. 2), solo dos alternativos se encuentran en el umbral de 24.000 €/AVAC, que son los específicamente creados para ello modificando el precio real de la dosis de 4CMenB. El rango de los otros 30 escenarios va de 92.205 €/AVAC a 555.479 €/AVAC.
Debido al gran impacto en los costes de la estrategia de vacunación que tiene el precio de la dosis de la vacuna, una disminución de este tiene una gran repercusión en la RCUI. La tasa de descuento también tiene un gran peso en el modelo, ya que los costes de las secuelas son a muy largo plazo y se ven fuertemente afectados por la tasa de descuento. Destaca la modificación que produce la incidencia de la enfermedad y la cobertura de cepas de la vacuna, que cuanto más altas son más disminuye la RCUI, pero sin llegar en ningún momento al umbral de coste-utilidad.
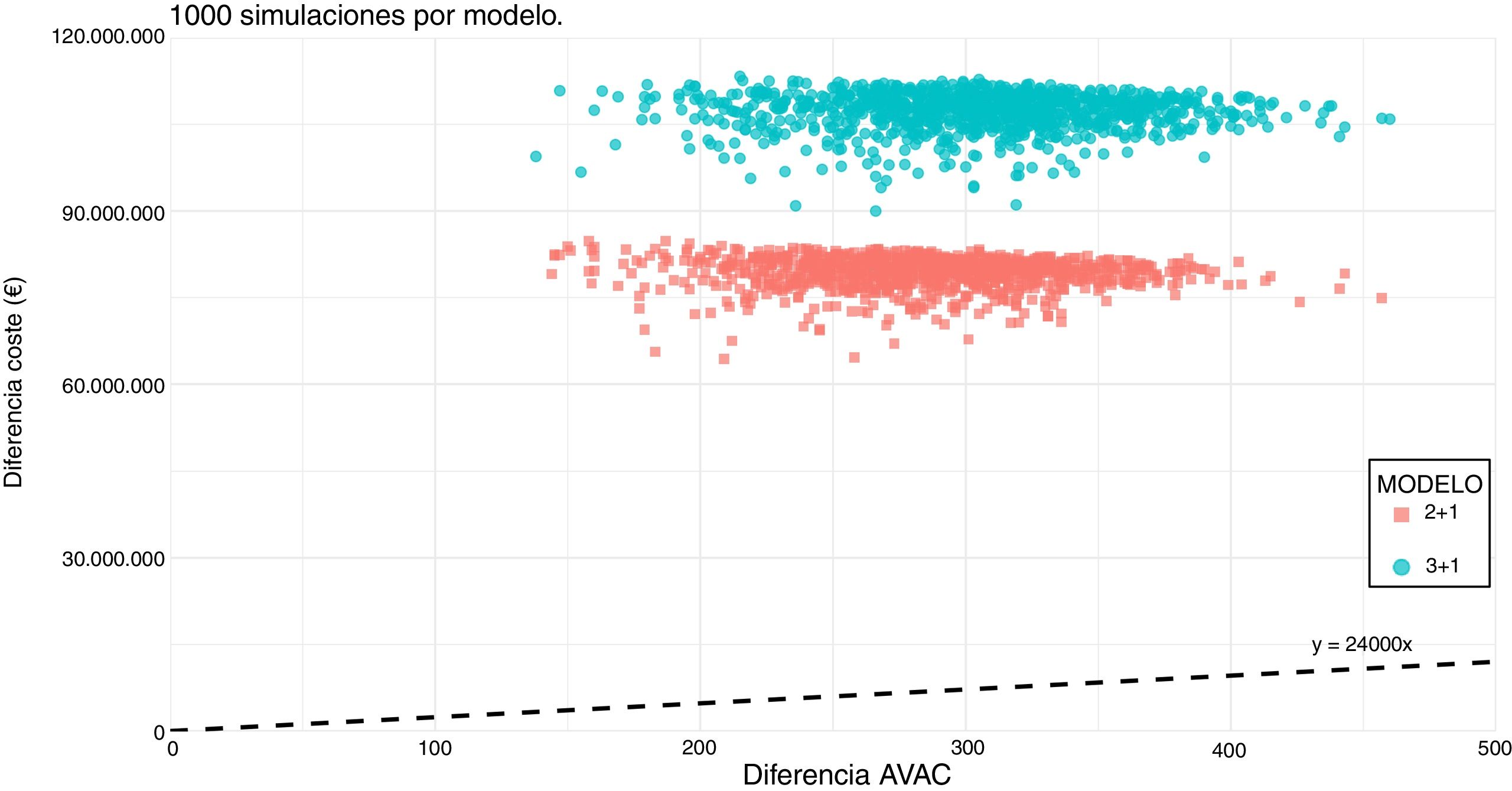
Al cambiar la incidencia de la enfermedad se modifican el número de casos y de fallecidos por EMI, pero no el porcentaje de casos evitados por la vacunación con respecto al escenario base. Al cambiar la cobertura de cepas por la vacuna no se modifican el número de casos ni las muertes en la estrategia de no vacunación, y sí varían tanto los casos como las muertes en la estrategia de vacunación y el porcentaje de casos evitados por la vacuna. El modelo 2+1 es más costo-efectivo que el modelo 3+1, principalmente por la disminución del coste en vacunas, pero al retrasar el inicio de la vacunación hasta los 3 meses disminuye el número de casos evitados. Los resultados por cada escenario modelizado se encuentran en la tabla III del Apéndice online. En la figura 3 se muestra el resultado del análisis de Monte Carlo en ambos modelos.
DiscusiónLos resultados indican que la vacunación sistemática con Bexsero® (4CMenB) no es coste-efectiva al precio actual. En el modelo 3+1, la RCUI es de 351.839 €/AVAC y evita 31 casos y 3 muertes, y en el modelo 2+1 es de 278.556 €/AVAC y evita 29 casos y 2 muertes. En ambos modelos, en la estrategia de vacunación sistemática más del 80% de los costes se debe al precio de la dosis de 4CMenB.
Las variables que más influyen en el modelo son el precio de la vacuna, la tasa de descuento, las cepas cubiertas según MATS y la incidencia de la enfermedad. Solo con un precio alterado de 1,45 € para la pauta 3+1 y de 3,37 € para la pauta 2+1 (el coste para la administración es de 64,5 €21) la introducción de la vacunación estaría dentro del umbral de coste-utilidad, considerado un umbral de 24.000 €/AVAC.
Nuestro estudio presenta las limitaciones propias de un estudio de modelización y las dificultades para encontrar datos económicos en el contexto nacional, como ocurre también en otros países europeos. En la modelización de la vacunación asumimos que todos los niños cubiertos reciben las tres o cuatro dosis según el esquema de vacunación, y no se contempla una pauta vacunal parcial.
Nuestro estudio tiene limitaciones que pueden influir en ambos sentidos en los resultados de la RCUI. Aquellas que tienden a un aumento de la RCUI, yendo en contra del coste-utilidad, son cuatro: 1) el uso de la técnica MATS (aunque sea el predictor más usado en los estudios de referencia puede ofrecer resultados conservadores7); 2) la perspectiva del pagador registra menos costes en las secuelas que una perspectiva de costes sociales; 3) la EMI podría causar varias secuelas a la vez (en nuestro estudio económico, como en otros, asumimos que los supervivientes pueden tener una única secuela14); y 4) el tipo de modelo no nos permite evaluar el efecto rebaño de la vacuna al estudiarse en una única cohorte (el efecto rebaño es la posible externalidad positiva que se crea al disminuir la circulación del agente infeccioso y proteger a sujetos no vacunados). Entre las limitaciones que tienden a disminuir la RCUI, favoreciendo el coste-utilidad, encontramos las siguientes: 1) la incidencia de la EMI en los últimos años está disminuyendo, pero nosotros hemos tenido que tomar la tasa de incidencia de 2013-201418; 2) asumimos que no existen pérdidas de vacunas por retiradas de lotes ni por rotura de la cadena de frío; 3) no se han tenido en cuenta el coste del paracetamol profiláctico ni el tratamiento de la fiebre posvacunal que no requiere consulta médica de urgencia; y 4) aunque la capacidad de crear inmunidad no es completa con la primera dosis de la vacuna, consideramos protegido al niño desde la administración de esta17.
Hay que tener en cuenta que la introducción de la vacuna puede llevar a una selección de cepas no cubiertas por ella, y recordar que la incidencia de EMI tiene una variabilidad cíclica, aunque tendente a la baja en el caso español3–5.
Entre las fortalezas de nuestro estudio cabe mencionar que hemos creado un modelo muy completo que incluye los costes de salud pública, los costes de seguimiento y la pérdida de calidad de vida por los efectos adversos que no están contemplados en todos los estudios similares. Un estudio con perspectivas de costes sociales disminuiría aún más la RCUI, pero se desconoce si llegaría a cumplir los umbrales de coste-efectividad.
4CMenB fue aprobada para la prevención de la EMI causada por el serogrupo B6, por lo que hemos restringido su uso a este serogrupo. Sin embargo, contiene antígenos que se presentan en otros serogrupos de N. meningitidis, aunque su capacidad de inmunogenicidad no ha sido aún bien estudiada22.
Nuestros resultados se enmarcan en el informe del posible impacto epidemiológico de la vacuna del Ministerio de Sanidad en 201323, en el que se expone que sería necesario vacunar a 12.853 niños menores de 1 año en España (entre 10.427 y 18.469) para prevenir un caso y 117.827 niños (entre 95.648 y 169.377) para prevenir un fallecimiento en menores de 1 año.
Es complicado comparar nuestros resultados con los de otros países de nuestro entorno, ya que la cobertura de cepas, la incidencia y los costes son diferentes4,7. Aun así, destacamos que en ninguno de los países en el contexto europeo se obtiene una RCUI coste-efectiva incluso con perspectivas de costes sociales con el precio de la dosis en España24. En un estudio alemán25 que tiene en cuenta los efectos directos de la vacunación (sin efecto rebaño) la RCUI es de 2M €/AVAC, y asumiendo un 60% de eficacia de eliminación del estado de portador es de 1.160.000 €/AVAC. Un estudio italiano16 muestra una RCUI con la perspectiva de costes del pagador de 120.990 €/AVAC y con perspectiva social de 109.762 €/AVAC. En Francia26 resulta una RCUI de 381.000 €/AVAC en ausencia de efecto rebaño y de 222.600 €/AVAC teniendo en cuenta la efectividad sobre el estado de portador. En Inglaterra27 se prevé una reducción del 26,3% de los casos en los primeros 5 años con efecto rebaño y del 24% sin efecto rebaño, con la misma pauta vacunal que en nuestro estudio. Se observa aquí que el efecto rebaño no parece tener mucha trascendencia en los primeros años de vida. En septiembre de 2015, el Reino Unido incluyó en su calendario oficial esta vacuna para lactantes (esquema 2+1) y se han notificado los resultados de los primeros 10 meses del programa: una cobertura del 88% para las dos primeras dosis y una efectividad del 83% frente a cualquier cepa de meningococo del serogrupo B y del 94% frente a las cubiertas por la vacuna. Los casos notificados de EMI por meningococo del serogrupo B se han reducido un 50% en la población diana de la vacunación (37 casos versus 74 de media)8; estos resultados son muy similares a los de nuestro modelo 2+1.
La pauta de administración recomendada actualmente conllevaría tres o cuatro citas más en el calendario vacunal23. Si se administrase de manera concomitante con otras vacunas, los ensayos clínicos sugieren un aumento de la frecuencia y de la gravedad de la fiebre posvacunal8, lo que podría llevar a una disminución en la adherencia a esta y otras vacunas. Además, se envían a la sociedad mensajes contradictorios entre sociedades científicas (Asociación Española de Pediatría y Sociedad Española de Salud Pública y Administración Sanitaria) y se plantea la introducción de la vacuna en el calendario solo en algunas comunidades autónomas, para una enfermedad como la EMI que tiene un alto impacto mediático por sus elevadas mortalidad y morbilidad12,24,28,29.
En conclusión, dada la epidemiología de la EMI, el precio actual de la vacuna y la información que tenemos en la actualidad, teniendo presentes las limitaciones y las fortalezas de esta evaluación económica, no podemos considerar que la inclusión de 4CMenB en el calendario de vacunaciones sistemáticas español sea una medida coste-efectiva.
4CMenB es una vacuna frente al meningococo del serogrupo B autorizada en 2013. En España está financiada para grupos de riesgo, pero no está incluida en el calendario vacunal sistemático. Existe una presión social para su inclusión. Sin embargo, hasta ahora no se había realizado un análisis de coste-utilidad en España.
¿Qué añade el estudio realizado a la literatura?Se trata del primer estudio de coste-utilidad de 4CMenB en España, el cual concluye que con la epidemiología, la posología y el precio actual de la vacuna no sería coste-efectiva la vacunación sistemática. El análisis realizado aporta información clave para la gestión de las políticas vacunales, exponiendo así el coste de la estrategia y los resultados esperados si se incluyera de forma sistemática.
Miguel Ángel Negrín Hernández.
Declaración de transparenciaEl autor principal (garante responsable del manuscrito) afirma que este manuscrito es un reporte honesto, preciso y transparente del estudio que se remite a Gaceta Sanitaria, que no se han omitido aspectos importantes del estudio, y que las discrepancias del estudio según lo previsto (y, si son relevantes, registradas) se han explicado.
Contribuciones de autoríaR. Ruiz-Montero, D. Epstein y J. Espín Balbino han participado en la concepción y el diseño del estudio. R. Ruiz-Montero ha realizado la recogida y el análisis de los datos. R. Ruiz-Montero y B. Guzmán Herrador realizaron la primera versión del documento. Todos los autores han revisado el manuscrito y realizado importantes contribuciones intelectuales en su redacción. Todos los autores han aprobado la versión final para su publicación.
AgradecimientosEste estudio se realizó en el contexto de trabajo de fin de máster del XXXII Máster de Salud Pública y Gestión Sanitaria de la Escuela Andaluza de Salud Pública (EASP). Se agradece a la EASP y a su profesorado, en especial a D. Alberto Fernández, la formación recibida y los consejos para una mejor trayectoria tanto profesional como personal.
FinanciaciónLos costes de publicación de este artículo han sido financiados por el Departamento de Ciencias Sociosanitarias, Radiología y Medicina Física de la Facultad de Medicina y Enfermerí, Universidad de Córdoba, Córdoba (España).
Conflictos de interesesR. Ruiz-Montero recibió en 2018 una beca de inscripción administrada por la organización del evento XXVI Jornadas Internacionales sobre Actualización en Vacunas, que estaba financiada por GSK. B. Guzmán Herrador ha recibido honorarios por parte de Sanofi Pasteur en el área de formación de medicina del viajero.