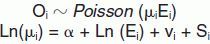Aunque la experiencia en el estudio de las desigualdades en la mortalidad en las ciudades españolas es amplia, quedan grandes núcleos urbanos que no han sido investigados utilizando la sección censal como unidad de análisis territorial. En este contexto se sitúa el proyecto coordinado «Desigualdades socioeconómicas y medioambientales en la mortalidad en ciudades de España. Proyecto MEDEA», en el cual participan 10 grupos de investigadores de Andalucía, Aragón, Cataluña, Galicia, Madrid, Comunitat Valenciana y País Vasco. Cabe señalar cuatro particularidades: a) se utiliza como área geográfica básica la sección censal; b) se emplean métodos estadísticos que tienen en cuenta la estructura geográfica de la región de estudio para la estimación de riesgos; c) se aprovechan las oportunidades que ofrecen 3 fuentes de datos complementarias (información sobre contaminación atmosférica, información sobre contaminación industrial y registros de mortalidad), y d) se emprende un análisis coordinado de gran alcance, favorecido por la implantación de la redes temáticas de investigación. El objetivo de este trabajo es explicar los métodos para la suavización de indicadores de mortalidad en el proyecto MEDEA. El artículo se centra en la metodología y los resultados del modelo de mapa de enfermedades de Besag, York y Mollié (BYM). Aunque en el proyecto se han suavizado, mediante el modelo BYM, las rezones de mortalidad estandarizadas (RME) correspondientes a 17 grandes grupos de causas de defunción y 28 causas específicas, aquí se aplica esta metodología a la mortalidad por cáncer de tráquea, de bronquios y de pulmón en ambos sexos en la ciudad de Barcelona durante el período 1996-2003. Como resultado se aprecia un diferente patrón geográfico en las RME suavizadas en ambos sexos. En los hombres se observan unas RME mayores que la unidad en los barrios con mayor privación socioeconómica. En las mujeres este patron se observa en las zonas con un mayor nivel socioeconómico.
Although there is some experience in the study of mortality inequalities in Spanish cities, there are large urban centers that have not yet been investigated using the census tract as the unit of territorial analysis. The coordinated project «Socioeconomic and environmental inequalities in mortality in Spanish cities. The MEDEA project» was designed to fill this gap, with the participation of 10 groups of researchers in Andalusia, Aragon, Catalonia, Galicia, Madrid, Valencia, and the Basque Country. The MEDEA project has four distinguishing features: a) the census tract is used as the basic geographical area; b) statistical methods that include the geographical structure of the region under study are employed for risk estimation; c) data are drawn from three complementary data sources (information on air pollution, information on industrial pollution, and the records of mortality registrars), and d) a coordinated, large-scale analysis, favored by the implantation of coordinated research networks, is carried out. The main objective of the present study was to explain the methods for smoothing mortality indicators in the context of the MEDEA project. This study focusses on the methodology and the results of the Besag, York and Mollié model (BYM) in disease mapping. In the MEDEA project, standardized mortality ratios (SMR), corresponding to 17 large groups of causes of death and 28 specific causes, were smoothed by means of the BYM model; however, in the present study this methodology was applied to mortality due to cancer of the trachea, bronchi and lung in men and women in the city of Barcelona from 1996 to 2003. As a result of smoothing, a different geographical pattern for SMR in both genders was observed. In men, a SMR higher than unity was found in highly deprived areas. In contrast, in women, this pattern was observed in more affluent areas.
En estos últimos años abundan los estudios que han considerado el área geográfica como un determinante de la salud. De hecho, la salud está afectada no sólo por determinantes individuales sino también por otros ecológicos o contextuales1–3. Así, por ejemplo, es ampliamente conocido que la pobreza afecta a la salud de las personas de forma individual, pero el análisis del contexto permite averiguar si la pobreza del área de residencia también es un determinante de la salud. Además, la salud de un grupo es más que la suma de la salud de los miembros individuales, y la perspectiva brindada por estos estudios permite un abordaje más cercano a la salud pública que los estudios individuales4.
Sin embargo, la proliferación del análisis de las desigualdades en salud teniendo en cuenta el territorio ha sido impulsada por, al menos, dos factores adicionales. En primer lugar, la demanda proveniente del campo de las políticas sanitarias, ya que estos estudios permiten identificar áreas geográficas con indicadores socioeconómicos y de salud más desfavorables. En segundo lugar, y en ocasiones el motivo determinante, los datos sólo están disponibles por área geográfica (por motivos de confidencialidad o por la inexistencia de series temporales completas5,6).
Durante la década de 1990 se llevaron a cabo algunos estudios ecológicos sobre desigualdades en mortalidad en ciudades españolas, como Barcelona7–10, Granada11, Málaga12 y Valencia9. Posteriormente, se realizaron investigaciones en otras ciudades españolas que, al igual que las anteriores, fueron desarrolladas tomando como unidad territorial de análisis grandes divisiones administrativas o sanitarias, fundamentalmente distritos y zonas básicas de salud13,14.
Actualmente, además de ser la unidad de desagregación más pequeña disponible con datos oficiales, la sección censal está reconocida como el área geográfica óptima para el estudio de la variabilidad espacial de resultados en salud dentro de las ciudades15. En ellas la población es más homogénea en cuanto a hábitos de vida y condiciones socioeconómicas, el entorno presenta características medioambientales similares, la información necesaria para llevar a cabo estudios ecológicos se encuentra habitualmente disponible en organismos oficiales y hay pocos problemas de confidencialidad asociados. Todas estas propiedades, entre otras, han fomentado la aceptación de la sección censal como la unidad geográfica más apropiada para este tipo de estudios15,16. Este hecho ha propiciado la reciente aparición de estudios de desigualdades en salud en algunas ciudades de Cataluña y el País Vasco que, a diferencia de las investigaciones realizadas en años anteriores, utilizan la sección censal como unidad de análisis territorial17,18. En la misma línea de trabajo se sitúa el proyecto coordinado «Atlas de la mortalidad en las capitales de provincia de Andalucía y Cataluña» (AMCAC), el cual ha permitido además estudiar de forma conjunta la distribución geográfica de la mortalidad y su relación con factores socioeconómicos en las 12 ciudades que constituyen las capitales de provincia de Andalucía y Cataluña19–21. Como particularidad, además de utilizar la sección censal como unidad geográfica, el proyecto AMCAC usó una metodología común basada en modelos jerárquicos bayesianos que hasta el momento no se había aplicado en España para el estudio de las desigualdades en salud en el ámbito urbano.
A pesar de que la experiencia en el estudio de las desigualdades en la mortalidad en las ciudades españolas es amplia, aún quedan grandes núcleos urbanos que no han sido investigados utilizando la sección censal como unidad de análisis territorial. En este contexto se sitúa el proyecto coordinado «Desigualdades socioeconómicas y medioambientales en la mortalidad en ciudades de España. Proyecto MEDEA», financiado por el Fondo de Investigaciones Sanitarias del Instituto Carlos III (años 2005-2007). En dicho proyecto, 10 grupos de investigadores pertenecientes a 7 comunidades autónomas (Andalucía, Aragón, Cataluña, Galicia, Madrid, Comunitat Valenciana y País Vasco) se plantearon los siguientes objetivos:
- –
Describir las desigualdades en indicadores socioeconómicos y de mortalidad en las secciones censales de grandes ciudades del Estado español (Madrid, Barcelona, Valencia, Sevilla, Zaragoza, Málaga, Bilbao, Córdoba, Alicante y Vigo) durante los años 1996-2003.
- –
Analizar la relación entre las desigualdades en mortalidad y los indicadores socioeconómicos en las áreas estudiadas de cada una de las ciudades seleccionadas.
- –
Comparar las desigualdades en mortalidad y según el nivel socioeconómico entre las ciudades seleccionadas, teniendo en cuenta el sexo, los grupos de edad y las causas de defunción.
- –
Estudiar las desigualdades medioambientales en salud, así como sus relaciones con las desigualdades socioeconómicas. Tratar de conocer la influencia de factores medioambientales, como la contaminación ambiental e industrial, en los patrones de mortalidad y su posible asociación con las desigualdades socioeconómicas.
Cabe señalar 4 particularidades del Proyecto MEDEA. En primer lugar, se utiliza como área geográfica básica la sección censal. En segundo lugar, se emplean métodos estadísticos que tienen en cuenta la estructura geográfica de la región de estudio para la estimación de riesgos. Hasta la fecha, en el Estado español no se han utilizado unidades geográficas inframunicipales, excepto en el proyecto AMCAC y en el Atlas de mortalidad en áreas pequeñas de Cataluña22, donde se analizó Barcelona por áreas básicas de salud. Por otra parte, el uso de métodos que tienen en cuenta la estructura espacial sólo tiene como precedente el proyecto AMCAC. Aunque son relativamente recientes, estos métodos se han convertido en referente en la literatura especializada23. De hecho, comienza a ser habitual su aplicación en estudios de la variabilidad geográfica24–30. En tercer lugar, se aprovechan las oportunidades que ofrecen 3 fuentes de datos complementarias, a saber, la información sobre contaminación atmosférica, la información sobre contaminación industrial aportada por el Registro Europeo de Emisiones Contaminantes (EPER)31 y el desarrollo de los registros de mortalidad. Y por último se emprende, por primera vez en nuestro país, un análisis coordinado de gran alcance favorecido por la implantación de la redes temáticas de investigación.
El objetivo de este trabajo es explicar los métodos para la suavización de indicadores de mortalidad en el contexto del proyecto MEDEA. En particular, el contenido del manuscrito se centrará en ilustrar la metodología y los resultados del modelo de mapa de enfermedades de Besag, York y Mollié aplicado a los datos del proyecto MEDEA.
MétodosEpidemiología espacialEl estudio de las desigualdades en salud, teniendo en cuenta la perspectiva geográfica, se enmarca en el contexto de la epidemiología espacial. El término epidemiología espacial o geográfica se emplea para describir estudios sobre las causas y la prevención de las enfermedades utilizando diferentes perspectivas de análisis en las cuales la localización geográfica de los eventos es uno de los componentes fundamentales32,33.
Uno de sus principales objetivos es mostrar qué parte de la variación espacial de la distribución de la frecuencia de una enfermedad no está explicada por la distribución espacial de factores explicativos, ni se puede atribuir al azar. De hecho, a menudo, interesa encontrar pistas sobre algún factor de riesgo desconocido de esta enfermedad.
El enfoque de análisis adoptado en el proyecto MEDEA se enmarca en las dos primeras perspectivas en que, siguiendo a Elliott y Watenberg34, podría dividirse la epidemiología espacial: mapas de enfermedades y estudios de asociación geográfica.
Análisis de la mortalidad en áreas pequeñasNo hay una definición exacta de lo que se considera un área geográfica pequeña, ya que esta definición dependería del contexto de estudio y del número de casos de la enfermedad analizada. Algunos autores han definido un área pequeña como cualquier región cuyo tamaño muestral en un estudio es demasiado pequeño como para producir estimaciones con un nivel de precisión aceptable; por este motivo, es necesario hacer uso de áreas relacionadas para realizar estimaciones más precisas35. Otros autores consideran que las áreas pequeñas son las que presentan menos de 20 casos de enfermedad y con una población que debería ser al menos de 10.000 habitantes36. La ventaja de las áreas pequeñas es que suelen ser más homogéneas en cuanto a la exposición, y una limitación es el reducido número de eventos.
Los mapas de enfermedades proporcionan un resumen visual de información geográfica compleja y permiten identificar patrones geográficos de la enfermedad que de otro modo podrían pasar inadvertidos en las presentaciones tabulares21,37. De hecho, se utilizan con propósitos descriptivos; con el objetivo de generar hipótesis etiológicas; para la vigilancia de la salud pública, a fin de detectar áreas con un aparente mayor riesgo, y como ayuda en la definición de políticas de salud y de asignación de recursos. Son también útiles para localizar conglomerados, o agrupaciones específicas de enfermedades, así como para situar los resultados de otros estudios de focos contaminantes21,33,37–39.
Los mapas de enfermedades más simples representan los casos o muertes observadas en cada área geográfica. Sin embargo, cualquier interpretación de la estructura geográfica de los casos está limitada por la falta de información sobre la distribución espacial de la población que podría estar «en riesgo» y, consecuentemente, ha generado esos casos observados. Por tanto, se prefiere la representación de tasas que permitan incorporar el efecto de la población en riesgo, en vez de representar los casos brutos. Sin embargo, el uso directo de las tasas brutas no permite la comparación entre distintas áreas, ya que las diferencias observadas entre ellas pueden deberse a factores de riesgo que no hayan sido tenidos en cuenta, como la edad. Una medida de la mortalidad que tiene en cuenta la estructura de edad es la tasa estandarizada por edad. Hay 2 métodos para la estandarización por edad, que se conocen como estandarización directa e indirecta. En la representación de los mapas de mortalidad se prefiere la utilización del método indirecto, que consiste en la comparación de las muertes observadas en un área con las esperadas si los riesgos para cada grupo de edad fueran los mismos que en cierta población de referencia. La razón observada/esperada se llama razón de mortalidad estandarizada (RME), que no es más que un estimador del riesgo relativo del área, es decir, del riesgo de muerte en relación con el grupo considerado de referencia.
Las RME, aun cuando han sido ampliamente utilizadas en los atlas de mortalidad, tienen algunas limi- taciones40,41. Dependen en gran medida del tamaño po- blacional, puesto que la varianza de las RME es inversamente proporcional a los valores esperados; así, áreas con poca población presentarán estimadores con gran variabilidad. En este sentido, las RME extremas y, por tanto, dominantes en el aparente patrón geográfico, son las estimadas con menos precisión en las áreas que tienen pocos casos.
Además, la variabilidad de los casos observados suele ser bastante mayor que la esperada en una distribución de Poisson, produciéndose lo que se denomina extravariabilidad. De hecho, cuando se dispone de datos espaciales es importante distinguir 2 fuentes de extravariación. En primer lugar, la fuente más importante suele ser la denominada «dependencia espacial» y es consecuencia de la correlación de la unidad espacial con unidades espaciales vecinas, generalmente las contiguas geográficamente. De este modo, las RME de áreas contiguas, o cercanas, son más similares que las RME de áreas distantes espa- cialmente. Parte de esta dependencia no es realmente una dependencia estructural, sino que se debe, principalmente, a la existencia de variables no controladas, es decir, no incluidas en el análisis. Respecto a la segunda fuente, debe asumirse la existencia de extrava- riación independiente e incorrelacionada espacial- mente, denominada «heterogeneidad incorrelacionada» o «no espacial», debida a variables no observadas sin estructura espacial que podrían influir en el riesgo15,39.
Métodos de suavización de las razones de mortalidad estandarizadaCon el fin de solucionar los problemas derivados de la utilización directa de las RME se han propuesto varias alternativas para «suavizarlas», es decir, reducir la extravariación. Se parte del supuesto de que los casos observados se distribuyen como una Poisson:
Entonces, el estimador máximo verosímil del riesgo relativo en cada área, μˆ, no es más que la RMELos métodos de suavización, en resumen, implican la formulación de modelos complejos cuyos parámetros necesitan ser estimados. La primera aproximación (al menos desde el punto de vista cronológico) consiste en el método de estimación denominado bayesiano em- pírico40–42. En segundo lugar, se han utilizado modelos jerárquicos bayesianos completos23,43,44. En un contexto completamente bayesiano se asignan a todos los parámetros del modelo distribuciones a priori. Alternativamente, en el contexto bayesiano empírico, los parámetros del modelo pueden estimarse maximizan- do directamente su distribución a posteriori.
El método bayesiano empírico, además de suponer una distribución de probabilidad para los casos observados, habitualmente una Poisson, asume que el riesgo relativo también es una variable aleatoria. Se puede suponer que éste se distribuye según una determinada distribución de probabilidad (habitualmen- te una gamma40, aunque también pueden ser otras como una log-normal), o bien se puede dejar libre, y no suponer ninguna distribución determinada. El modelo resultante, a pesar de su nombre, se estima utilizando un enfoque frecuentista, por máxima verosimilitud no completa, habitualmente mediante el algoritmo EM.
En el enfoque bayesiano completo, la idea es introducir en el modelo uno o más efectos aleatorios que recojan (toda) la variabilidad no explicada. Lo más habitual para suavizar las razones es utilizar el modelo propuesto por Besag, York y Mollie43,44 (BYM), el cual incluye 2 efectos aleatorios: uno de ellos recoge la dependencia espacial, mientras que el otro la heterogeneidad o la sobredispersión (no espacial) desestructurada.
Hace ya 20 años, Clayton y Kaldor40 mostraron que ambos métodos, el empírico y el bayesiano completo, aunque proporcionan diferentes valores para los estimadores del riesgo relativo, en términos absolutos, coinciden en el rango y en el orden del riesgo, en términos relativos. Además, utilizando una gran variedad de escenarios con datos simulados, así como aplicaciones reales, Lawson et al42 muestran que ambos métodos son los que proporcionan los resultados más consistentes respecto a otras alternativas23. El problema más importante de los métodos bayesianos empíricos, en relación con los modelos completamente bayesianos, es que no son capaces de modelizar, al menos fácilmente, la dependencia (extravariabilidad) espacial, ya que no tienen en cuenta la incertidumbre inicial de los parámetros del modelo43. Sin embargo, los estimadores bayesianos empíricos pueden ser útiles a la hora de realizar una valoración inicial de la distribución espacial de los datos. Esto se debe a que en comparación con los completamente bayesianos su estimación es computacionalmente menos exigente. De todos modos, en la actualidad, los modelos de efectos aleatorios, como el BYM, son los más utilizados23.
Un aspecto que debe tenerse muy en cuenta, ya sea mediante la utilización de un método u otro, es el grado de suavización que se consiga34. Este grado determina un compromiso entre una alta sensibilidad (áreas de exceso de riesgo correctamente identificadas) y una alta especificidad (áreas que no tienen exceso de riesgo correctamente identificadas)45. Un resultado sensible pero no específico generará falsos positivos, mientras que uno específico pero no sensible no identificará las áreas con un riesgo alto. Tras un exhaustivo estudio de simulación, Richardson et al45 mostraron que, con un riesgo relativo en torno a 2, se requieren como mínimo 20 casos esperados (cuando el riesgo relativo es de 2-3, «sólo» se requieren 5 casos esperados) para que el método de suavización proporcione resultados «suficientemente sensibles» (en el sentido de detectar correctamente áreas con un riesgo alto). Si en vez de utilizar las razones suavizadas se utiliza la probabilidad a posteriori, PrP (es decir, que las razones sean mayores que la unidad), alternativa preferida por estos autores, el resultado será «suficientemente específico» cuando la probabilidad sea mayor del 80%.
Estudios ecológicos de asociación geográficaEl objetivo en este tipo de estudios es examinar, desde un punto de vista geográfico (y ecológico) la relación entre las variables respuesta de salud y las exposiciones tanto a factores medioambientales de tipo ecológico (contaminación atmosférica, del agua y del suelo) como de tipo ocupacional, las condiciones socioeconómicas y demográficas, o las variables relacionadas con el estilo de vida (como el hábito tabáquico y la dieta).
Suele ser habitual, sobre todo con datos espaciales, que la extravariabilidad no desaparezca por completo. Puede ocurrir, por ejemplo, que se trate de un problema de escala. Así, los datos pueden ser «escasos» (sparseness), es decir, puede que no se observe ningún caso en (relativamente) bastantes áreas geográficas. Sin embargo, parte de la extravariabilidad puede atribuirse a la falta de control de la confusión. De hecho, si se han omitido variables confuso- ras del riesgo esperado (privación, otras variables socioeconómicas), éstas deberían incluirse en el análisis.
Precisamente, en el proyecto MEDEA se incluyen, como variables explicativas, varios indicadores socioeconómicos, así como variables medioambientales. En este sentido, Domínguez-Berjón et al46 describen la metodología seguida en la construcción de un índice de privación por sección censal, que permite identificar las secciones con situaciones más desfavorables, y analizan la relación de este índice con la mortalidad general.
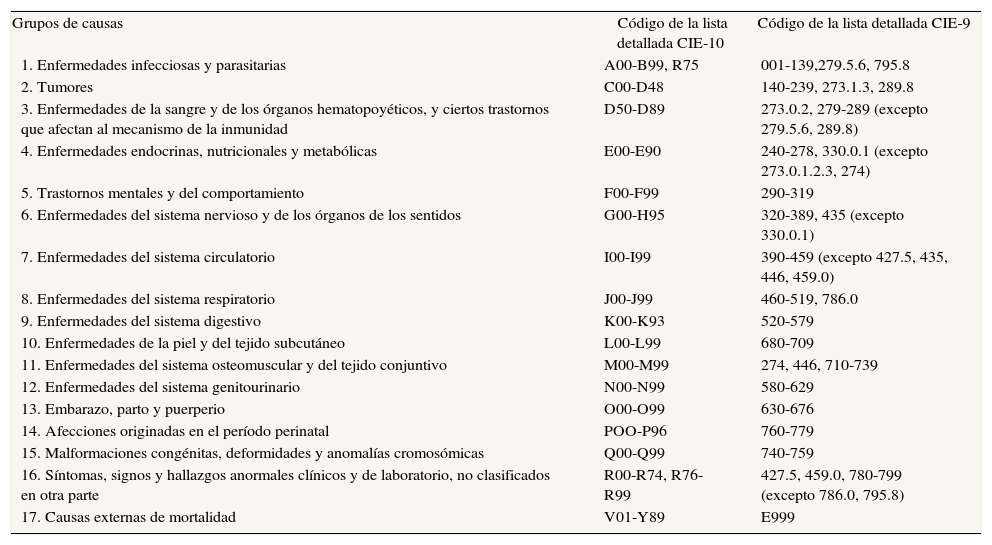
Métodos de análisis en el proyecto MEDEACon el fin de cumplir los objetivos del proyecto MEDEA, el análisis se ha realizado estratificando por sexo y por ciudad, según 17 grandes grupos de causas de defunción y 28 causas específicas (3 de ellas opcionales) consensuadas por los miembros del proyecto (tabla 1).
Grandes grupos de causas de defunción
| Grupos de causas | Código de la lista detallada CIE-10 | Código de la lista detallada CIE-9 |
| 1. Enfermedades infecciosas y parasitarias | A00-B99, R75 | 001-139,279.5.6, 795.8 |
| 2. Tumores | C00-D48 | 140-239, 273.1.3, 289.8 |
| 3. Enfermedades de la sangre y de los órganos hematopoyéticos, y ciertos trastornos que afectan al mecanismo de la inmunidad | D50-D89 | 273.0.2, 279-289 (excepto 279.5.6, 289.8) |
| 4. Enfermedades endocrinas, nutricionales y metabólicas | E00-E90 | 240-278, 330.0.1 (excepto 273.0.1.2.3, 274) |
| 5. Trastornos mentales y del comportamiento | F00-F99 | 290-319 |
| 6. Enfermedades del sistema nervioso y de los órganos de los sentidos | G00-H95 | 320-389, 435 (excepto 330.0.1) |
| 7. Enfermedades del sistema circulatorio | I00-I99 | 390-459 (excepto 427.5, 435, 446, 459.0) |
| 8. Enfermedades del sistema respiratorio | J00-J99 | 460-519, 786.0 |
| 9. Enfermedades del sistema digestivo | K00-K93 | 520-579 |
| 10. Enfermedades de la piel y del tejido subcutáneo | L00-L99 | 680-709 |
| 11. Enfermedades del sistema osteomuscular y del tejido conjuntivo | M00-M99 | 274, 446, 710-739 |
| 12. Enfermedades del sistema genitourinario | N00-N99 | 580-629 |
| 13. Embarazo, parto y puerperio | O00-O99 | 630-676 |
| 14. Afecciones originadas en el período perinatal | POO-P96 | 760-779 |
| 15. Malformaciones congénitas, deformidades y anomalías cromosómicas | Q00-Q99 | 740-759 |
| 16. Síntomas, signos y hallazgos anormales clínicos y de laboratorio, no clasificados en otra parte | R00-R74, R76-R99 | 427.5, 459.0, 780-799 (excepto 786.0, 795.8) |
| 17. Causas externas de mortalidad | V01-Y89 | E999 |
Las fuentes de información utilizadas fueron el INE y los Registros de Mortalidad de las ciudades correspondientes. Como población de estudio se consideraron todas las personas residentes en estas ciudades. El período de estudio considerado fue 1996-2003.
Tras un estudio descriptivo previo, las RME se han suavizado mediante el modelo BYM43,44, dentro de una perspectiva bayesiana completa. Para el cálculo de los casos esperados se tomaron como referencia las tasas de España correspondientes al año 2001, con el fin de poder comparar unas ciudades con otras.
En el caso del proyecto MEDEA, el modelo BYM se especifica como un modelo lineal generalizado mixto (GLMM) con variable respuesta de Poisson y considerando como offset los casos esperados33:
donde Oi denota los casos observados en la sección censal i, Ei son los casos esperados en esa sección censal, μi es el riesgo relativo en la sección i, vi es el efecto aleatorio no espacial y Si el efecto aleatorio espacial.El efecto aleatorio no espacial, también denominado heterogeneidad, se supone distribuido normalmente con media cero y varianza constante. Para el efecto aleatorio, que recoge la variabilidad espacial, se utiliza un modelo condicional autorregresivo CAR47,48. Esta aproximación, la más habitual y la computacionalmen- te más sencilla, aproxima la dependencia espacial como un promedio del efecto espacial de sus áreas vecinas33.
En el proyecto MEDEA, las áreas consideradas son las secciones censales de cada una de las ciudades, y por vecindad se entiende contigüidad.
La estimación bayesiana completa requiere que se proporcione la función de verosimilitud, es decir, que se especifique el modelo, BYM en el caso del proyecto MEDEA, y las distribuciones a priori de los parámetros de interés. En concreto, distribuciones a priori para los efectos aleatorios (normal intercambiable para la heterogeneidad y CAR para la dependencia espacial), para los parámetros del modelo, si los hubiera (p. ej., el asociado a alguna variable explicativa), así como para la desviación estándar (DE) de los efectos aleatorios.
En el caso de las DE de los efectos aleatorios, en el proyecto MEDEA se han escogido distribuciones a priori «vagamente» o «débilmente» informativas. El problema es que la elección de una distribución a priori no informativa y «propia» (en el sentido de que su integral sea la unidad) implica que la inferencia posterior dependa de los parámetros de la distribución a priori. Esta (excesiva) sensibilidad es particularmente problemática si no se tiene suficiente evidencia de la heterogeneidad entre unidades49. Por este motivo se ha optado por utilizar una a priori que no presente este problema, una distribución uniforme en un rango finito (05) de la DE tanto de los efectos aleatorios espaciales (dependencia espacial) como de los efectos aleatorios desestructurados (heterogeneidad no espacial)49.
Una vez especificado el modelo (la verosimilitud) y las distribuciones a priori, se obtiene la distribución a posteriori. Cuando se deben estimar varios nodos es- tocásticos, como en el caso del proyecto MEDEA (RME, DE de los efectos aleatorios, etc.), deben utilizarse integrales múltiples. Al no poderse obtener los resultados de una manera analítica, debe recurrirse a métodos de simulación. En particular, se utiliza el muestreo dependiente a partir de cadenas de Markov, MCMC50,51. Hay varios algoritmos para diseñar cadenas de Markov. El más conocido es el denominado Gibbs sampling52–54, que es uno de los que utiliza el programa WinBUGS55.
Como consecuencia de su forma iterativa, la convergencia de las simulaciones resulta crucial a la hora de validar los resultados obtenidos mediante estos métodos bayesianos completos. Por este motivo, en el proyecto MEDEA, para cada nodo estimado, se utilizan 3 cadenas y se ejecuta un gran número de simulaciones (50.000 como mínimo), de las que se «desprecian» el 10% de las iniciales (procedimiento denominado burn- in), y cada cierto número de iteraciones se guardan los nodos estimados, descartándose el resto de iteraciones con el fin de evitar la autocorrelación que se da en las cadenas (procedimiento denominado thinning).
Una vez obtenidos los resultados del modelo, la convergencia se comprueba en detalle mediante el estadístico de Brooks-Gelman-Rubin56 (denominado R-hat en la librería R2WinBUGS en el entorno de software libre R) y el tamaño muestral efectivo de las cadenas57,58 (n.eff en la librería R2WinBUGS en el entorno de software libre R). Como criterios de convergencia se acordó que el R-hat fuese menor que 1,1 y el n.eff mayor que 100 en las estimaciones de las DE de los efectos aleatorios espacial y heterogéneo, ya que son los parámetros más problemáticos en cuanto a la convergencia. Si no se cumplían dichos criterios se aumentaba el número de simulaciones hasta que se produjese la convergencia.
Una vez han convergido las simulaciones de las desviaciones de los efectos heterogéneo y espacial, se obtiene, como resultado, una muestra de la distribución posterior para las RME suavizadas, la PrP (probabilidad de que la RME suavizada sea mayor que la unidad), así como diversos histogramas, con el fin de comprobar la suavización y la distribución de frecuencias de las RME suavizadas.
ResultadosAunque en el proyecto MEDEA se ha aplicado la metodología descrita a la totalidad de las causas contenidas en la tabla 1 y para todas las ciudades que forman parte del proyecto, en este artículo la metodología anteriormente expuesta se aplica, a modo de ejemplo, a la mortalidad por cáncer de tráquea, de bronquios y de pulmón (códigos de la Clasificación Internacional de Enfermedades, novena revisión [CIE-9] 162, y décima [CIE- 10] C33, C34) en ambos sexos en la ciudad de Barcelona durante el período 1996-2003.
Lista de causas específicas de defunción
| Grupos de causas | Código de la lista detallada CIE-10 | Código de la lista detallada CIE-9 |
| 1 Sida | B20-B24 | 279.5.6 |
| 2. Tumor maligno del estómago | C16 | 151 |
| 3. Tumor maligno del colon | C18 | 153 |
| 4. Tumor maligno del recto, de la porción rectosigmoide y del ano | C19-C21 | 154 |
| 5. Tumor maligno de la laringe | C32 | 161 |
| 6. Tumor maligno de la tráquea, de los bronquios y del pulmón | C33, C34 | 162 |
| 7. Tumor maligno de peritoneo, mesotelioma de peritoneo | C45.1, C48 | |
| 8. Mesotelioma | C45.9 | — |
| 9. Tumor maligno de pleura, mesotelioma de pleura | C38.4, C45.0 | 163 |
| 10. Tumor maligno de la mama (mujer) | C50 | 174 |
| 11. Tumor maligno de la próstata | C61 | 185 |
| 12. Tumor maligno de la vejiga | C67 | 188 |
| 13. Tumores hematológicos | C81-C96 | 200-208 |
| 14. Diabetes mellitus | E10-E14 | 250 |
| 15. Trastornos mentales orgánicos, senil y presenil | F00-F09 | 290 (excepto 290.1) |
| 16. Enfermedad de Alzheimer | G30 | 290.1, 331.0 |
| 17. Enfermedad isquémica del corazón | I20-I25 | 410-414 |
| 18. Enfermedades cerebrovasculares | I60-I69 | 430-434, 436-438 |
| 19. Enfermedades crónicas de las vías respiratorias inferiores (excepto asma) | J40-J44, J47 | 490-492, 494, 496 |
| 20. Cirrosis y otras enfermedades crónicas del hígado | K70, K72.1, K73, K74, K76.1.9 | 571 |
| 21. Caídas accidentales | W00-W19 | E880-E888 (excepto E887) |
| 22. Envenenamiento accidental por psicofármacos y drogas de abuso | X41, X42, X44, X45 | E850.0.9, E851-E855, E858.9, E860 |
| 23. Suicidio y lesiones autoinfligidas | X60-X84 | E950-E959 |
| 24. Accidentes de tráfico de vehículos a motor | V02-V04 con .1.9 | E810-E819 |
| V09.2.3 | ||
| V12-V14.3.4.5.9 | ||
| V19.4.5.6.9 | ||
| V20-V28.3.4.5.9 | ||
| V29.4.5.6.9 | ||
| V30-V38.4.5.6.7.9 | ||
| V39.4.5.6.9 | ||
| V40-V48.4.5.6.7.9 | ||
| V50-V58.4.5.6.7.9 | ||
| V59.4.5.6.9 | ||
| V60-V68.4.5.6.7.9 | ||
| V69.4.5.6.9 | ||
| V70-V78.4.5.6.7.9 | ||
| V79.4.5.6.9 | ||
| V80.3.4.5 | ||
| V81.1 | ||
| V82.1 | ||
| V83.0.1.2.3 | ||
| V84.0.1.2.3 | ||
| V85.0.1.2.3 | ||
| V86.0.1.2.3 | ||
| V87.0.1.2.3.4.5.6.7.8 | ||
| V89.2.9 | ||
| 25. Resto de defunciones | ||
| 26. Mesotelioma (opcional) | C45 | – |
| 27. Tumor maligno del esófago (opcional) | C15 | 150 |
| 28. Tumor maligno del riñón (opcional) | C64-C66, C68 | 189 |
La diferencia entre el mesotelioma de la posición 8 y el de la posición 26 (opcional) es que el primero sólo incluye el mesotelioma de sitio no especificado y el segundo todo el grupo de mesotelioma.
Como se ha mencionado, la unidad de análisis utilizada es la sección censal. El proyecto MEDEA utiliza el seccionado censal correspondiente al año 2001. En ese año, Barcelona contaba con 1.491 secciones censales, con una población media de 1.009 habitantes por sección (mediana de 993 habitantes); la sección menos poblada contaba con 91 habitantes y la más poblada con 7.003.
El 3,76% de las secciones de Barcelona en el caso de los hombres y el 53,92% en el caso de las mujeres no presentaron ninguna defunción por cáncer de pulmón en el período considerado. El número medio de defunciones en las secciones que presentaron al menos un fallecido fue de 4,11 en el caso de los hombres y de 1,42 en las mujeres (mediana de 4 y 1, respectivamente), con una DE de 2,57 en el caso de los hombres y de 0,65 en las mujeres.
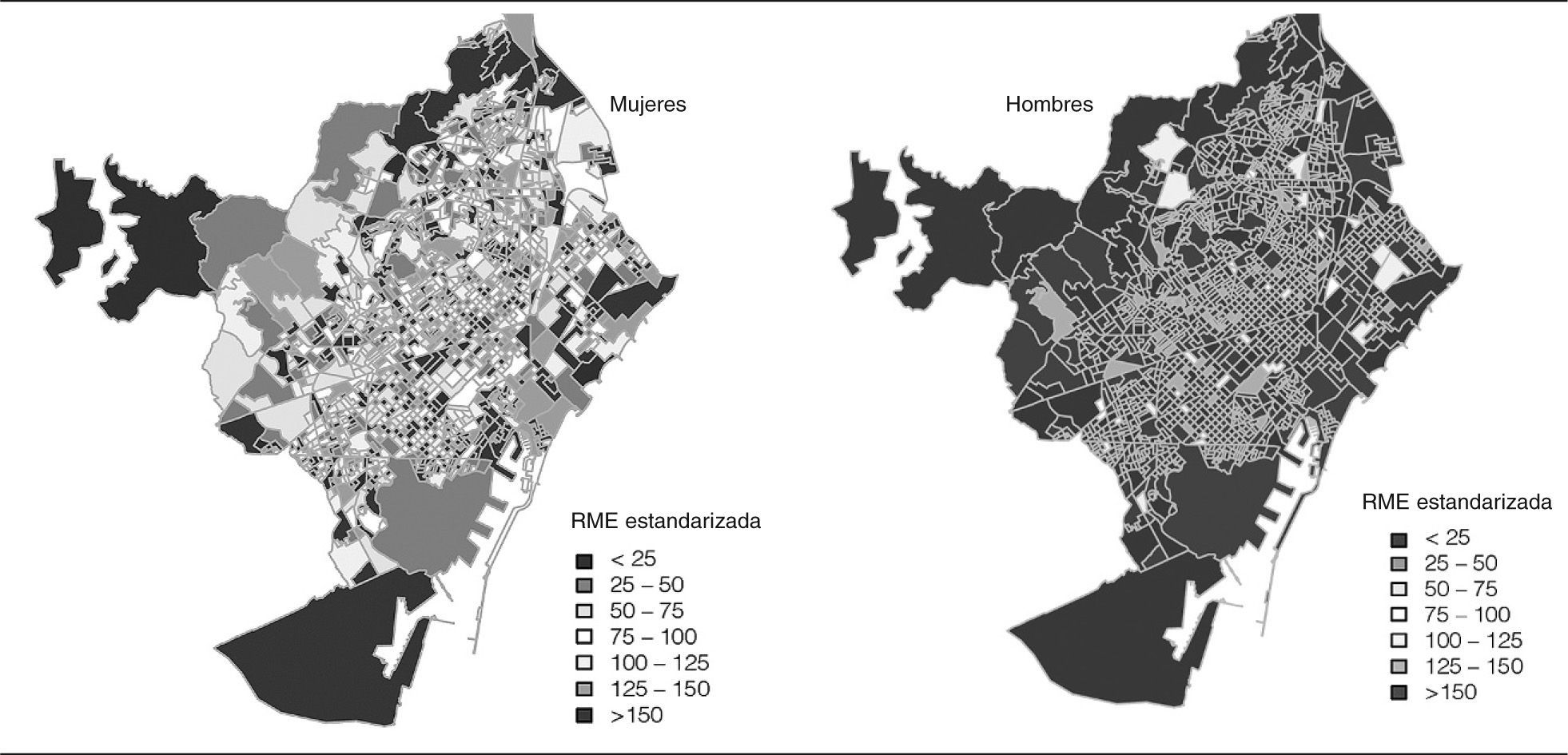
En la figura 1 se muestra la representación en un mapa de la ciudad de Barcelona por secciones censales de las RME para cada sexo. Aunque sería posible apreciar cierto patrón geográfico, la variabilidad, sobre todo en el caso de las mujeres, es considerable.
Estratificando por sexo, las RME fueron suavizadas mediante el modelo BYM (especificado en la fórmula anterior), utilizando los métodos de análisis descritos anteriormente. Se utilizaron, además de los entornos de software libre R (versión 2.4.1)59 y Win- BUGS55, las librerías R2WinBUGS60 (que permite conectar ambos entornos), maptools61 (herramientas para lectura y manipulación de objetos espaciales) y RColorBrewer62 (paletas para facilitar la coloración de mapas). La sintaxis y los códigos utilizados pueden ser consultados en la página web del grupo GRECS63.
En el ajuste se utilizaron 3 cadenas, 200.000 simulaciones, con un burn-in de 20.000 y un thinning igual a 30. Los modelos cumplieron los criterios de convergencia (R-hat de las DE del efecto aleatorio espacial igual a 1,002282 en hombres y 1,000615 en mujeres, R-hat de las DE de la heterogeneidad igual a 1,094476 en hombres y 1,048364 en mujeres, y n.eff mayor que 100 en todos los casos).
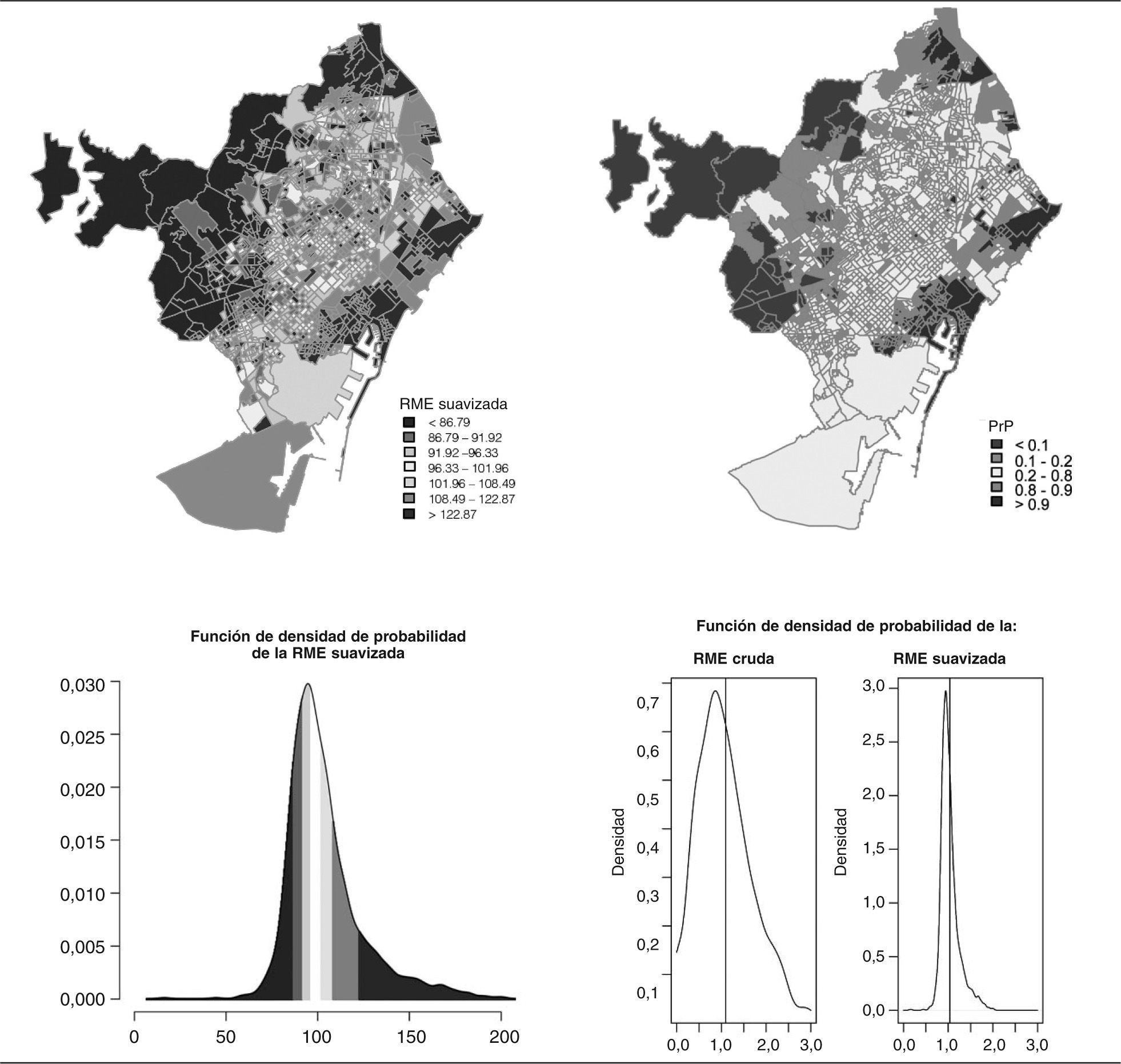
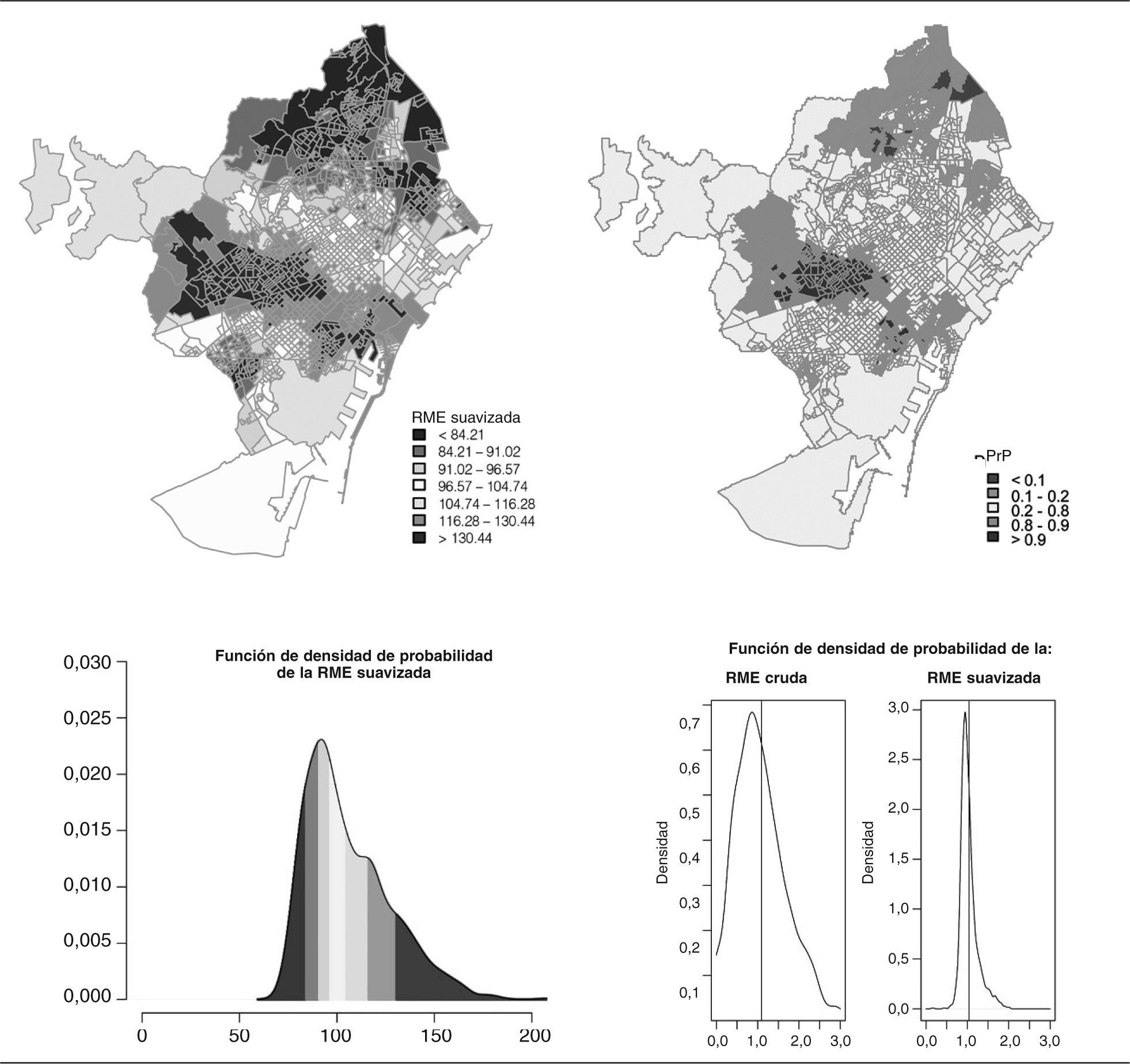
En las figuras 2 y 3 se muestran los resultados de la suavización obtenida aplicando los métodos expuestos anteriormente, una vez comprobada la convergencia de las simulaciones. En la parte superior izquierda se muestra el mapa de la razón de mortalidad estandarizada suavizada; en la parte superior derecha, el mapa de la probabilidad a posteriori (probabilidad de que el riesgo relativo fuese mayor que 1). La gama de colores rojo muestra las secciones con un exceso de riesgo, y la de verdes las que presentan un defecto. Se consideró exceso de riesgo las secciones cuya PrP fuese mayor que 0,8 y defecto de riesgo aquellas cuya PrP fuese menor que 0,2. En la parte inferior, a la izquierda, se encuentra la función de densidad de probabilidad de la RME suavizada (con el mismo rango de colores que el mapa), y a la derecha la función de densidad de probabilidad de las RME crudas y de la razón estandarizada suavizada.
El resultado de la suavización puede observarse en las funciones de densidad de probabilidad de las RME crudas y suavizadas. En este sentido, obsérvese el caso de las mujeres, en las cuales el modelo BYM suaviza unas RME excesivamente inestables (compárese la figura 1 con la figura 3). Nótese asimismo el diferente patrón geográfico presente en las RME suavizadas en ambos sexos, patrones que, como muestran las PrP, se corresponden a agrupaciones de áreas con exceso o defecto de riesgo. En el caso de los hombres se observan unas RME mayores que la unidad en los barrios con mayor privación socioeconómica. Contrariamente, en las mujeres este patrón se observa en las zonas con un mayor nivel socioeconómico.
De hecho, este fenómeno podría explicarse, en gran parte, por el consumo de tabaco. En las décadas de 1980 y 1990 empezaron a fumar más los hombres de clases sociales menos favorecidas y, posteriormente, fueron las mujeres de clases sociales más privilegiadas las que iniciaron el hábito con más frecuencia64–67.
DiscusiónCabría aquí señalar algunas limitaciones. En primer lugar, independientemente de la metodología empleada en los estudios ecológicos de desigualdades en salud, es importante destacar que las técnicas aplicadas son capaces de describir la distribución geográfica de la mortalidad, pero no permiten explicar por qué el riesgo es más elevado en algunas secciones censales. Para ello, será necesario realizar estudios con datos individuales en los que se analicen los factores de riesgo relacionados con causas específicas de mortalidad.
De hecho, en los estudios ecológicos no se puede obtener una relación entre la exposición y el factor de riesgo estudiado, puesto que no se conoce si los individuos más expuestos a un determinado factor en cada área geográfica son los que han muerto. Cuando se extrapolan al ámbito individual los resultados obtenidos en estudios poblacionales aparece la llamada «falacia ecológica»68. En este caso, los mapas obtenidos acerca de los factores socioeconómicos o ambientales nos ofrecerán una descripción de las secciones censales en las distintas zonas geográficas; observando dichos mapas se puede determinar cómo son las condiciones ambientales y sociales, así como la mortalidad, pero no se puede concluir que las personas que residen en una sección con una tasa de mortalidad alta y malas condiciones ambientales están más expuestas que las que viven en una sección con otras características. Ambas secciones son comparables a la población de referencia utilizada (España, 2001), pero no entre sí. Por otro lado, al realizar análisis con datos agregados, los riesgos para la salud estimados proporcionan una información realmente válida69,70.
En tercer lugar, los cambios de residencia de la población podrían constituir un sesgo de clasificación en la exposición de los sujetos; sin embargo, el uso de datos agregados en este tipo de estudios hace que no sea posible el control individual de las migraciones. También puede llevar a la aparición de este sesgo la ubicación de los centros residenciales para personas mayores, ya que contribuirá a un aumento de la mortalidad. Dicho sesgo se supone controlado al ajustar por edad, puesto que la población de los centros mencionados ha de encontrarse censada correctamente.
Cabe señalar también, como limitación del estudio, el denominado «efecto frontera». Este efecto se produce al ignorar la distribución del riesgo fuera del área de estudio, pero que puede influir en la distribución del riesgo dentro del área estudiada. Este efecto puede ser particularmente acusado en grandes ciudades en las que el cinturón metropolitano se entremezcla con otras ciudades circundantes.
Desde un punto de vista más metodológico, la sección censal no es más que una división meramente administrativa. Como ventajas de su utilización cabe mencionar que se trata de áreas de, más o menos, la misma población (lo que facilita la estandarización de las incertidumbres en la estimación de tasas); sobre todo, son áreas para las que se dispone de información procedente de los Censos de Población y Viviendas. Sin embargo, su uso no está libre de inconvenientes. El área de éstas es muy variable, por propia definición, lo que puede causar problemas en el análisis espacial y en la representación de mapas. Además, los límites de las secciones no permanecen constantes en el tiempo. Por último, suelen contener pocos casos (a veces muy pocos) de la enfermedad de in- terés71.
De hecho, un «exceso de ceros» en la distribución de los casos entre secciones censales, es decir, si hubiese muchas secciones sin ningún caso, podría implicar que la distribución de probabilidad no fuese, en realidad, una Poisson, sino una mixtura de distribuciones. Este problema podría limitar la aplicación de modelos como el BYM. Sin embargo, este aspecto presenta cierta controversia. Recientemente, Best et al23 comparaban la mayoría de los modelos que se han aportado para obtener los riesgos relativos en estudios de mapas de enfermedades, incluido el BYM. Los resultados sugieren que el modelo BYM proporciona los mejores resultados, al menos por lo que se refiere al análisis de una única enfermedad. Por tanto, estos autores aconsejan el uso de este modelo para el análisis espacial en áreas pequeñas.
A pesar de sus limitaciones, el estudio de las desigualdades territoriales en mortalidad constituye un elemento importante para ampliar los conocimientos sobre la salud de la población. Los métodos de suavi- zación resultan particularmente indicados en entornos urbanos, especialmente para secciones censales, ya que éstas son, salvo excepciones, pequeñas en extensión además de serlo en población. Por ello, los posibles factores de riesgo excederán habitualmente el ámbito geográfico de las secciones, por lo que resulta particularmente aconsejable la utilización de términos de efectos aleatorios con estructura espacial que basa las estimaciones del riesgo en las de las secciones vecinas.
Las conclusiones que puedan extraerse de estos estudios supondrán una aportación relevante para la planificación de recursos sanitarios, la implantación de programas de prevención y la disminución de las desigualdades en salud.
Respecto a las líneas de futuro del proyecto MEDEA, además de profundizar en diferentes aspectos medioambientales (comparación de desigualdades medioambientales en salud y su relación con factores socioeconómicos), se pretende realizar un atlas presentando las desigualdades en mortalidad en áreas pequeñas.
AgradecimientosEstudio parcialmente financiado por el proyecto «Mortalidad en áreas pequeñas Españolas y Desigualdades socioEconómicas y Ambientales (MEDEA)»: PI04/0399 (GRECS, Universitat de Girona), PI04/2013 (ASPB, Barcelona), PI04/0388 (Departamento de Sanidad y Servicio Vasco de Salud, Gobierno Vasco), PI04/0041 (CNE, ISCIII), PI04/0170 (Conselleria de Sanitat, Valencia); por la Red de Centros de Epidemiología y Salud Pública (FISS C03/09); y por el CIBER de Epidemiología y Salud Pública (CIBERESP).
Agradecemos los comentarios de Patxi Cirarda (Dirección Territorial de Sanidad de Bizkaia) y Andreu Nolasco (Valencia) así como los de tres revisores anónimos a una versión anterior de este trabajo.