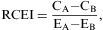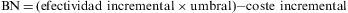Los modelos de Markov son el método estándar utilizado en los estudios de coste-efectividad para representar la historia natural de la enfermedad. El objetivo de este trabajo es mostrar los elementos clave en la construcción de modelos de Markov de tipo probabilístico.
MétodosSe ha utilizado el ejemplo de un nuevo tratamiento para una enfermedad genérica. Para ello se ha construido un modelo de Markov con parámetros introducidos como distribuciones estadísticas para llevar a cabo el análisis de sensibilidad probabilístico mediante simulaciones de Monte Carlo. Los resultados se analizaron en forma de plano coste-efectividad y curva de aceptabilidad.
ResultadosLa razón coste-efectividad incremental para el paciente medio es de 22.855€/año de vida ajustado por calidad (AVAC). En el análisis de sensibilidad probabilístico el resultado de todas las simulaciones se sitúa en el cuadrante nordeste, que corresponde a coste y efectividades positivas. El 67% de las simulaciones se sitúa por debajo del umbral de los 30.000€/AVAC.
ConclusiónLa utilización de los modelos de Markov de tipo probabilístico requiere la integración de conceptos provenientes de la economía, la epidemiología, la estadística y la clínica. Algunas etapas del proceso, como la construcción y el procesamiento del modelo, la gestión de los riesgos absolutos y relativos, y el manejo de las distribuciones estadísticas, suelen plantear mayores dificultades, pero son necesarias para que el modelo reproduzca la enfermedad de forma válida.
Markov models are the standard method used in cost-effectiveness studies to represent the natural history of disease. The objective of this study was to show the key elements in building probabilistic Markov models.
MethodsWe used the example of a new treatment for a generic disease. A probabilistic Markov model was constructed using statistical distributions. Monte Carlo simulations were carried out to obtain the probabilistic sensitivity analysis. The results were analyzed in terms of the cost-effectiveness plane and acceptability curve.
ResultsThe incremental cost-effectiveness rate for the average patient was €22,855/quality adjusted life years (QALY). In the probabilistic sensitivity analysis, the results from all simulations were located in the northeast quadrant, corresponding to positive cost and effectiveness. However, 67% of the simulations were below the threshold of €30,000/QALY.
ConclusionThe use of probabilistic Markov models requires the integration of concepts from economics, epidemiology, statistics, and the clinical setting. Some stages of the process, such as the construction and processing of these models, the management of absolute and relative risks and of statistical distributions, often pose major difficulties but are key steps required to reproduce the disease with validity.
Los modelos de Markov son el método estándar utilizado en los estudios de coste-efectividad para representar la historia natural de la enfermedad1–3. Su uso permite calcular tanto la esperanza de vida por estado de salud como la ocurrencia de sucesos con implicaciones en términos de coste o efectividad4–7. Los motivos de su éxito son varios: en primer lugar, su facilidad para representar matemáticamente los elementos clínicos y epidemiológicos de la enfermedad de una forma tanto rigurosa como sencilla de entender; y en segundo lugar, la disponibilidad de programas como Excel8 y Data-TreeAge9, que resuelven el cálculo matricial y que han permitido a los investigadores interesados abordar estos proyectos sin necesidad de grandes recursos. Por último, el desarrollo de mejoras tales como el análisis de sensibilidad probabílistic10,11 o el valor esperado de la información perfecta11,12, y su aplicación por el National Institute for Clinical Excellence (NICE) de forma generalizada en Reino Unido, han dotado a estos estudios de un marco de aplicación riguroso13.
Sin embargo, estos modelos también tienen sus puntos débiles. La falta de memoria del modelo, lo que se conoce como la asunción markoviana, es su principal limitación6. Otra dificultad es la necesidad de disponer de información válida para rellenar su contenido. En la medida en que un modelo se hace más complejo requiere más datos para proceder a la obtención de resultados. Su calidad depende de la calidad de los parámetros que se han introducido, y en algunas ocasiones la falta de datos representa un serio problema para la validez del modelo.
Los modelos de Markov no se emplean de forma generalizada en la evaluación económica, aunque constituyen, tras los árboles de decisión, la forma más frecuente de modelar. En la base de datos EURONHEED14, de resúmenes de evaluaciones económicas referidas a los países europeos y publicadas entre 1995 y 2005, se constata que, de 1323 estudios, 146 se basaron en modelos de Markov (en España, 28 de un total de 211).
El objetivo de este trabajo es presentar de forma detallada los elementos clave de la construcción de modelos de Markov de tipo probabilístico. Con el fin de facilitar la comprensión se utiliza el ejemplo de un nuevo tratamiento hipotético para una enfermedad genérica. El ejercicio sirve para llevar a cabo un estudio de coste-efectividad confrontando un nuevo tratamiento con el estándar mediante un modelo probabilístico.
Material y métodosLos modelos de MarkovLos modelos de Markov son especialmente útiles para la representación matemática de la historia natural de las enfermedades que cursan con estados de salud que cambian en el tiempo y que presentan eventos debidos a la exposición a riesgos6,12,15. Entre esos riesgos se pueden citar la muerte y las complicaciones clínicas de cualquier tipo. En estos modelos, los individuos solo pueden permanecer en un estado concreto incluido dentro del conjunto finito de los estados de Markov definidos.
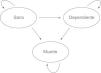
Los modelos de Markov hacen un uso discreto del tiempo consistente en que el modelo avanza mediante incrementos de tiempo fijos, llamados ciclos de Markov. La duración ideal del ciclo debería ser el intervalo de tiempo más corto clínicamente significativo. Lo habitual es que se utilicen ciclos anuales, pero según las características de la enfermedad representada también se pueden usar ciclos trimestrales o mensuales. En cada ciclo el paciente lleva a cabo una transición de un estado a otro en función de las probabilidades especificadas para el estado y el ciclo en que se encuentra. Estas probabilidades se denominan «probabilidades de transición». En la vida real los riesgos cambian con el tiempo, ya que las tasas de muerte, eventos cardiovasculares o cáncer aumentan con la edad. Los modelos resuelven este punto definiendo las probabilidades mediante fórmulas que incorporan la tasa en función de la edad, y modificando esta de forma automática en cada ciclo. Desde algunos estados, como la muerte, no hay transición posible, y por eso se llaman «estados absorbentes». El modelo funciona hasta que todos los individuos están en el estado absorbente o hasta que se alcanza el horizonte temporal del estudio.
Los modelos se denominan «deterministas» cuando los parámetros de que dependen se introducen como valores fijos7,16. La forma de analizar la influencia de la incertidumbre de los parámetros en el resultado final es el «análisis de sensibilidad». El análisis de sensibilidad probabilístico se basa en realizar cientos o miles de simulaciones variando en cada una los valores de los parámetros de forma aleatoria11,12,17, empleando distribuciones estadísticas de probabilidad; es decir, los parámetros del modelo tienen la consideración de variables aleatorias.
En la evaluación económica los resultados son distintos para cada una de las alternativas analizadas, ya que implican diferentes probabilidades de transición y costes, y permiten calcular la razón coste-efectividad incremental (RCEI). La fórmula para su obtención es:
donde CA y EA representan el coste y la efectividad de la alternativa objeto de estudio, mientras que CB y EB son los correspondientes a la alternativa estándar de comparación.Distribuciones de las variables del modeloLos programas utilizados con más frecuencia, como Excel y TreeAge, disponen de una serie de distribuciones de probabilidad en forma de funciones que permiten obtener valores aleatorios a partir de los parámetros que definen a cada distribución8,9. En consecuencia, no se requiere manejar los fundamentos estadísticos de cada distribución. Al investigador le basta con conocer cuál es la distribución adecuada para cada variable y calcular sus parámetros a partir de los datos primarios. La elección de la distribución estadística que mejor se ajusta a las características de variables como los costes, las probabilidades o los riesgos relativos, se puede llevar a cabo fácilmente consultando la literatura12.
Cuando las probabilidades de transición dependen de la proporción de pacientes que han seguido un curso determinado, sus valores se obtienen a partir de distribuciones beta, puesto que siempre generan valores entre 0 – 1. En cambio, para los riesgos relativos la distribución log normal es la más adecuada. Los costes se obtienen aleatoriamente a partir de la distribución log normal o la distribución gamma, que se representan como curvas asimétricas con un máximo próximo al origen y una cola muy larga hacia la derecha. El motivo es que generalmente muchos pacientes tienen costes bajos, pero unos pocos pacientes generan costes muy altos porque el tratamiento se complica.
Las utilidades plantean problemas especiales a la hora de conseguirlas aleatoriamente, por moverse en el intervalo de (−∞,1). Cuando no hay valores negativos, la distribución beta puede ser una buena opción, y en caso de que ese estado de salud requiera la posibilidad de obtener valores negativos se puede transformar la utilidad en desutilidad (d=1−utilidad) y ajustar ésta a las distribuciones log normal o gamma12.
Con el objeto de conseguir parámetros aleatorios se utilizan las funciones estadísticas inversas (recíprocas) de las distribuciones, ya que son las que permiten obtener valores paramétricos a partir de probabilidades. Estas últimas se incorporan a la función mediante un generador de números aleatorios, que produce aleatoriamente una probabilidad a partir de una distribución uniforme entre 0 – 112.
Resultado del procesamiento de los modelos de MarkovEl procesamiento de los modelos de Markov consiste en la multiplicación del vector fila, que indica la distribución inicial de la cohorte en los diferentes estados de salud, por la matriz o tabla de probabilidades de transición6; así se obtiene el vector fila que indicará la distribución de la cohorte al inicio del siguiente ciclo. Este proceso se repite tantas veces como ciclos markovianos requiera el estudio. El resultado es la matriz de permanencia por estado y ciclo, a partir de la cual se calcula el tiempo que un individuo permanece en cada estado de salud durante el intervalo desde el comienzo del modelo hasta el final del horizonte temporal establecido. En la tabla 1 se muestra un ejemplo de la obtención de la matriz de permanencia a partir de una cohorte de 1.000 individuos, y las probabilidades de transición descritas al comienzo de la tabla. El ciclo 0 contiene la distribución de la cohorte inicial entre los tres estados. En este caso se parte de que todos los individuos están sanos, pero la distribución podría ser distinta según las características de esa cohorte. El contenido de la cohorte inicial depende de las características de la población que se analiza. Algunas veces todos los casos parten del mismo estado10,11,17. Por el contrario, los estudios de evaluación económica de la hepatitis C suelen partir de una cohorte inicial repartida en varios estados18. Los individuos pueden pasar en cada ciclo de un estado a otro solamente cuando las probabilidades de transición se lo permiten. Al estado «sano» solamente se puede llegar desde el estado sano, pero al «dependiente» se llega desde los estados «sano» y «dependiente», y al estado «muerte» se llega desde los tres estados. Así, los 195 dependientes del ciclo 2 proceden, por un lado, 105 del estado sano (700×0,15), y por otro 90 del dependiente (150×0,6). Si la duración del ciclo es de un año, el modelo de Markov obtiene la esperanza de vida de cada individuo de la cohorte en el estado sano, que es de 2,33 años, y en el estado dependiente, que es de 1,25. Estos resultados desagregados permiten su conversión en coste y AVAC con y sin descuento.
Procesamiento de un modelo de Markov a partir de una cohorte inicial de 1.000 individuos sanos
| Matriz de probabilidades de transición | |||
| A sano | A dependiente | A muerto | |
| De sano | 0,7 | 0,15 | 0,15 |
| De dependiente | 0 | 0,6 | 0,4 |
| De muerto | 0 | 0 | 1 |
| Matriz de permanencia tras 25 ciclos (n.° de individuos) | |||
| Ciclo | Sano | Dependiente | Muerto |
| 0 | 1000 | 0 | 0 |
| 1 | 700 | 150 | 150 |
| 2 | 490 | 195 | 315 |
| 3 | 343 | 191 | 467 |
| 4 | 240 | 166 | 594 |
| 5 | 168 | 135 | 696 |
| 6 | 118 | 106 | 776 |
| 7 | 82 | 82 | 836 |
| 8 | 58 | 61 | 881 |
| 9 | 40 | 45 | 914 |
| 10 | 28 | 33 | 938 |
| 11 | 20 | 24 | 956 |
| 12 | 14 | 17 | 969 |
| 13 | 10 | 13 | 978 |
| 14 | 7 | 9 | 984 |
| 15 | 5 | 6 | 989 |
| 16 | 3 | 5 | 992 |
| 17 | 2 | 3 | 994 |
| 18 | 2 | 2 | 996 |
| 19 | 1 | 2 | 997 |
| 20 | 1 | 1 | 998 |
| 21 | 1 | 1 | 999 |
| 22 | 0 | 1 | 999 |
| 23 | 0 | 0 | 999 |
| 24 | 0 | 0 | 1000 |
| 25 | 0 | 0 | 1000 |
| Suma total | 2333 | 1250 | |
| Supervivencia | 2,33 | 1,25 | |
Por enfermedad genérica entendemos una situación en la cual un grupo de personas presenta un riesgo mucho mayor de sufrir un evento que la población general. Su ocurrencia hace que el individuo pase de la situación de sano a la de enfermo o a la de muerte (fig. 1). El estado «enfermo» se caracteriza por una situación de discapacidad o dependencia que implica una peor calidad de vida y, por tanto, una utilidad menor. Como sucede con la hipertensión en el caso del ictus, podemos suponer que la enfermedad genérica se comporta como un factor de riesgo, lo que provoca que el riesgo de sufrir un evento cardiovascular y de muerte sea mucho mayor que en la población general. La definición del evento se ha basado conceptualmente en el ictus, a modo de ejemplo. Nótese que los resultados no serán relevantes porque los parámetros se han fijado de manera aproximada y el modelo es más sencillo para poder ser más didáctico. En función de sufrir un ictus, los individuos pueden pasar a un estado de salud con discapacidad o dependiente. Las probabilidades de transición dependen de las tasas de mortalidad por todas las causas, de mortalidad por ictus y de dependencia por ictus.
La enfermedad genérica tiene un tratamiento convencional que se administra de forma continua a lo largo de la vida del paciente (alternativa B). Hay un nuevo tratamiento (alternativa A), más caro, pero que mejora el pronóstico al disminuir el riesgo relativo de ictus y por tanto la probabilidad de transición a enfermo y muerte. El objetivo del ejercicio es llevar a cabo un estudio de coste-efectividad del nuevo tratamiento frente a la alternativa convencional.
Definición de las alternativasLa alternativa B es más barata, pero produce más eventos (ictus). La alternativa A tiene como ventajas que aumenta la esperanza de vida ajustada por calidad y que ahorra algunos costes porque produce una esperanza de vida mayor en el estado sano. Su inconveniente es que el tratamiento es más caro. En la tabla 2 se muestra un resumen de las variables del modelo con sus distribuciones.
Resumen de los elementos del modelo probabilístico con las funciones de Excel y los parámetros que las determinan
| Parámetro | Distribución |
| RR ictus alternativa 1 | DISTR.LOG.INV(1,793;0,143) |
| RR ictus alternativa 2 | DISTR.LOG.INV(1,793;0,143) ¿ Beneficio |
| Beneficio | DISTR.LOG.INV(−0,964;0,163) |
| Coste alternativa 1 | 6,5¿Peso |
| Coste alternativa 2 | 65¿Peso |
| Peso | DISTR.NORMAL.INV(75,9;12,29) |
| Coste dependencia por año | DISTR.LOG.INV(6,936;0,643) |
| Sexo | BINOM.CRITIC(1;221/(221+314)) |
| Edad | ENTERO [DISTR.NORMAL.INV(70,9;12,29)] |
| Utilidad dependencia | DISTR.NORMAL.INV(0,701;0,0347) |
BINOM.CRITIC: distribución binomial; DISTR.LOG.INV: distribución log normal inversa; DISTR.NORMAL.INV: distribución normal inversa; RR: riesgo relativo.
La mortalidad de cada alternativa se basa en las tablas de mortalidad de la población general por todas las causas por edad y sexo, y en las tablas de mortalidad de la población general por ictus por edad y sexo ajustadas según el riesgo relativo (RR) correspondiente. La morbilidad por ictus se basa en las tablas de morbilidad (ictus no mortal) de la población general por edad y sexo ajustadas según el RR correspondiente. El ictus no mortal es el que da lugar al estado enfermo o dependiente. El RR de ictus en la población con el tratamiento B (estándar) se obtuvo de ensayos clínicos en los cuales se comparaba con placebo. El beneficio del tratamiento A en relación con el tratamiento B procede de un ensayo clínico que comparó ambas alternativas. El RR de la alternativa A es el producto del riesgo con la alternativa B multiplicado por el beneficio del tratamiento A. El coste de cada tratamiento depende del peso del paciente. El coste de la medicación convencional por año es de 6,5€/kg y el de la alternativa es de 65€/kg.
Los otros elementos son comunes para las dos alternativas (en la tabla 2 se muestra un resumen de ellos con sus distribuciones). La utilidad en el estado sano es 1. Para conocer la utilidad del estado dependiente se hizo una encuesta con el cuestionario de salud Euroquol 5D, que dio una media de 0,701 y un error estándar de 0,0347. Los costes de la dependencia se obtuvieron de una encuesta a pacientes. A partir de los datos de costes de pacientes se calcularon la media del logaritmo neperiano del coste (6,936) y la desviación típica (0,643).
Los datos de edad, sexo y peso del individuo se obtuvieron de un estudio descriptivo de la enfermedad en población española. Para la edad se usó la distribución normal, con una media de 70,9 años y una desviación típica de 12,29. Para obtener los valores hay que añadir la función «parte entera» porque los ciclos sólo funcionan con números enteros. El sexo de cada simulación es el resultado de combinar una distribución binomial con una sola extracción (distribución de Bernoulli) y los datos primarios del ensayo clínico (221 mujeres y 314 hombres). Para obtener valores aleatorios del peso se utiliza la distribución normal, con una media de 75,9kg y una desviación estándar de 12,29. El descuento fue del 3% para costes y utilidades.
Probabilidades de transiciónLas probabilidades de transición desde sano derivan de la incidencia de ictus, que determina el paso al estado dependiente. Las probabilidades de transición dependen de la edad y, por tanto, cambian a lo largo de los ciclos. Ya que se ha utilizado un modelo epidemiológico de riesgos proporcionales, se calculan a partir de las tasas de incidencia anual de ictus no mortal por edad y sexo, y del riesgo relative19. La fórmula de la probabilidad (P) en relación con la tasa (r) y el RR es p=1−e−r×RR. El RR se introduce en el modelo como distribución log normal. Los parámetros se muestran en la tabla 2. El RR de la alternativa A es el producto del RR de la alternativa B por el beneficio del tratamiento, que se traduce en valores inferiores a 1. La probabilidad de permanencia en el estado sano es el complemento a la unidad. La tasa total de muerte de esta población es la de la población general más el exceso por el ictus. Su cálculo requiere disponer de las tablas de mortalidad por todas las causas y de mortalidad por ictus por edad y sexo, de los riesgos relativos y del beneficio del tratamiento.
La probabilidad desde dependiente a sano es 0. La probabilidad de dependiente a muerto (0,4) se ha obtenido de un estudio observacional con 200 pacientes, de los cuales morían 80 cada año. Se usa la distribución beta con parámetros α=80 y β=120. En la tabla 3 se muestra un resumen de las probabilidades de transición.
Probabilidades de transición del modelo
| De | A | Probabilidad de transición |
| Sano | Sano | # |
| Sano | Dependiente | 1-EXP(-tasa de ictus no mortal) |
| Sano | Muerte | 1-EXP(-tasa de muerte) |
| Dependiente | Dependiente | # |
| Dependiente | Muerte | DIST.BETA.INV(80;120) |
| Muerte | Muerte | 1 |
1- EXP: número e; DIST.BETA.INV: distribución beta inversa; #: complemento a.
En el caso base se ha usado una edad de 71 años. Para analizar la incertidumbre en función de la edad se ha obtenido la RCEI con edades desde los 30 hasta los 75 años (análisis de sensibilidad por edad) (tabla 4). El horizonte temporal aplicado ha sido el de la muerte de los pacientes. La menor valoración del coste y de la efectividad futuros se ha corregido mediante un descuento en ambos conceptos del 3%.
Análisis de sensibilidad por edad
| Edad | Coste incremental | Efectividad incremental | Razón coste-efectividad incremental |
| (años) | (euros) | (AVAC) | (euros/AVAC) |
| 30 | 82.965 | 0,13 | 629.764 |
| 35 | 82.043 | 0,22 | 379.414 |
| 40 | 80.430 | 0,34 | 236.622 |
| 45 | 77.792 | 0,53 | 145.525 |
| 50 | 73.946 | 0,82 | 90.321 |
| 55 | 68.637 | 1,19 | 57.855 |
| 60 | 61.582 | 1,58 | 39.092 |
| 65 | 52.987 | 1,81 | 29.202 |
| 70 | 43.904 | 1,82 | 24.177 |
| 75 | 34.993 | 1,62 | 21.558 |
AVAC: año de vida ajustado por calidad.
En este trabajo se realizaron 1.000 simulaciones de Monte Carlo. Su análisis se formaliza mediante el plano coste-efectividad y las curvas de aceptabilidad. El plano coste-efectividad consiste en un gráfico de dispersión de puntos en el cual los valores del eje de abscisas son la efectividad incremental (medida en AVAC) y los del eje de ordenadas el coste incremental (expresado en euros) de cada simulación.
La curva de aceptabilidad es un gráfico de líneas donde los valores de la serie son el porcentaje de simulaciones en que se acepta la intervención analizada, y los rótulos del eje de abscisas son las etiquetas de los diferentes umbrales. A medida que aumenta el umbral también aumenta el porcentaje de simulaciones en que se acepta la intervención. Ese valor se basa en el número de simulaciones con beneficio neto positivo20,21. La fórmula de cálculo del beneficio neto (BN) es:
Dadas las diferencias por edad, se llevó a cabo un análisis de sensibilidad probabilístico para tres grupos de edad: 30, 60 y 80 años. Para cada grupo se obtuvo el plano de coste-efectividad y la curva de aceptabilidad.
ResultadosPara un paciente de 71 años el coste de la alternativa B es de 3.484€, mientras que el de la alternativa A sube hasta 40.268€, lo que genera un coste incremental de 36.784€. Las efectividades respectivas son 6,518 y 8,128 AVAC, que dan una efectividad incremental de 1,609 AVAC. El cociente de ambos cálculos incrementales permite estimar la RCEI, que es de 22.855€/AVAC. Puesto que está por debajo del umbral de eficiencia estándar (30.000€/AVAC) podríamos decir que la alternativa A debería ser aceptada. Sin embargo, los resultados del análisis de sensibilidad por edad (tabla 4) indican que por debajo de los 65 años el tratamiento se puede considerar ineficiente, ya que sobrepasa el umbral. La definición del umbral estándar es un tema sujeto a debate y que se sale del ámbito de este trabajo. La razón de utilizar el criterio de los 30.000€/AVAC se debe a que es el más habitual en la literatura22,23.
Considerando la influencia de la edad en el resultado, en la figura 2 se presenta el plano de coste-efectividad para tres edades diferentes (30, 60 y 80 años) junto con la línea del umbral de los 30.000€/AVAC, y en la figura 3 las correspondientes curvas de aceptabilidad. El resultado de todas las simulaciones se sitúa en el cuadrante nordeste, que corresponde a coste y efectividades positivas. Si en el modelo global tenemos en cuenta el criterio de los 30.000€/AVAC, el 67% de los puntos están por debajo del umbral. La curva de aceptabilidad (fig. 3) permite ver cómo se modifica ese porcentaje en función del tipo de umbral.
La evaluación económica del tratamiento de la enfermedad elegida con la alternativa A mediante un modelo de Markov de tipo probabilístico indica que es eficiente para un umbral de aceptabilidad de 30.000€/AVAC con una probabilidad del 67%. La incertidumbre en la decisión como consecuencia de la variabilidad de los parámetros depende fundamentalmente de la estructura de edad de la población, ya que se ha utilizado un modelo epidemiológico de riesgos proporcionales19. Dado que el riesgo absoluto aumenta con la edad y que el coste del tratamiento es proporcional a la supervivencia, por ser un coste de estado, la RCEI disminuye de forma continuada al aumentar la edad de inicio del tratamiento. Estamos analizando una única decisión para poblaciones con riesgos distintos. La solución es separar esta población por grupos de edad y analizar cada grupo de forma independiente. El tratamiento se rechazaría para las edades de 30 y 60 años, y se aceptaría para la edad superior puesto que la RCEI es inferior a 30.000€/AVAC en el 99,3% de las simulaciones. La valoración del grupo más joven es muy clara, pues se puede rechazar la decisión y el riesgo de equivocarse es 0 para los umbrales inferiores a 90.000€/AVAC. El grupo de edad de 60 años es más complicado de valorar porque con el umbral habitual (30.000€/AVAC) el tratamiento es eficiente solamente en el 4,5%, pero alcanza el 73% cuando el límite se dobla. En este último caso, la decisión final dependerá del criterio de eficiencia que se utilice.
La utilización de los modelos de Markov de tipo probabilístico requiere la integración de conceptos provenientes de la economía, la epidemiología, la estadística y la clínica. Aunque el trabajo en equipo ayude en esta tarea, siempre se requiere que un investigador sea capaz de manejar todos esos elementos para construir el modelo, procesarlo e interpretar sus resultados. Las etapas del proceso que suelen plantear mayores dificultades son la construcción y el procesamiento del modelo, la gestión de los riesgos absolutos y relativos, y el manejo de las distribuciones estadísticas. Algunos artículos de la bibliografía son de lectura obligatoria para cualquier investigador interesado en los modelos de Markov. En primer lugar hay que citar el trabajo de Sonnenberg y Beck6 referido a los conceptos básicos de los modelos de Markov. Si lo que se pretende aplicar es el enfoque probabilístico, la referencia obligada es la descripción detallada llevada a cabo por Briggs et al10,12.
Material adicionalEste artículo se acompaña de una serie de ejercicios y soluciones en Excel que permiten reproducir el estudio de coste-efectividad presentado. Se incluye también un ejercicio para el aprendizaje del manejo de las distribuciones estadísticas citadas. El material puede descargarse libremente de la página web del Hospital Alto Deba (http://www.osakidetza.euskadi.net/v19-hadb0005/es/contenidos/informacion/hadb_investigacion/es_hadb/hospital_alto_deba.html).
ContribuidoresJ. Mar y F Antoñanzas plantearon el artículo y realizaron la búsqueda bibliográfica. R. Pradas y A. Arrospide construyeron el modelo matemático y obtuvieron los parámetros requeridos. J. Mar escribió el borrador inicial, en el cual todos los autores aportaron ideas, interpretaron los hallazgos y revisaron el manuscrito. Todos los autores aprobaron la versión final del artículo. J. Mar es el responsable principal del estudio.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.