Describir un brote de hepatitis A en la ciudad de Albacete y valorar la efectividad de las medidas de control adoptadas.
MétodosConstatada la existencia del brote, se establecieron las definiciones de caso. Se recogieron los datos clínicos y epidemiológicos de los casos mediante encuesta. Se describió la distribución temporoespacial, mediante la localización de los casos y la curva epidémica. Se pusieron en marcha, como medidas de control y prevención inmediatas, la administración de inmunoglobulina (IG) y educación sanitaria a la población en riesgo.
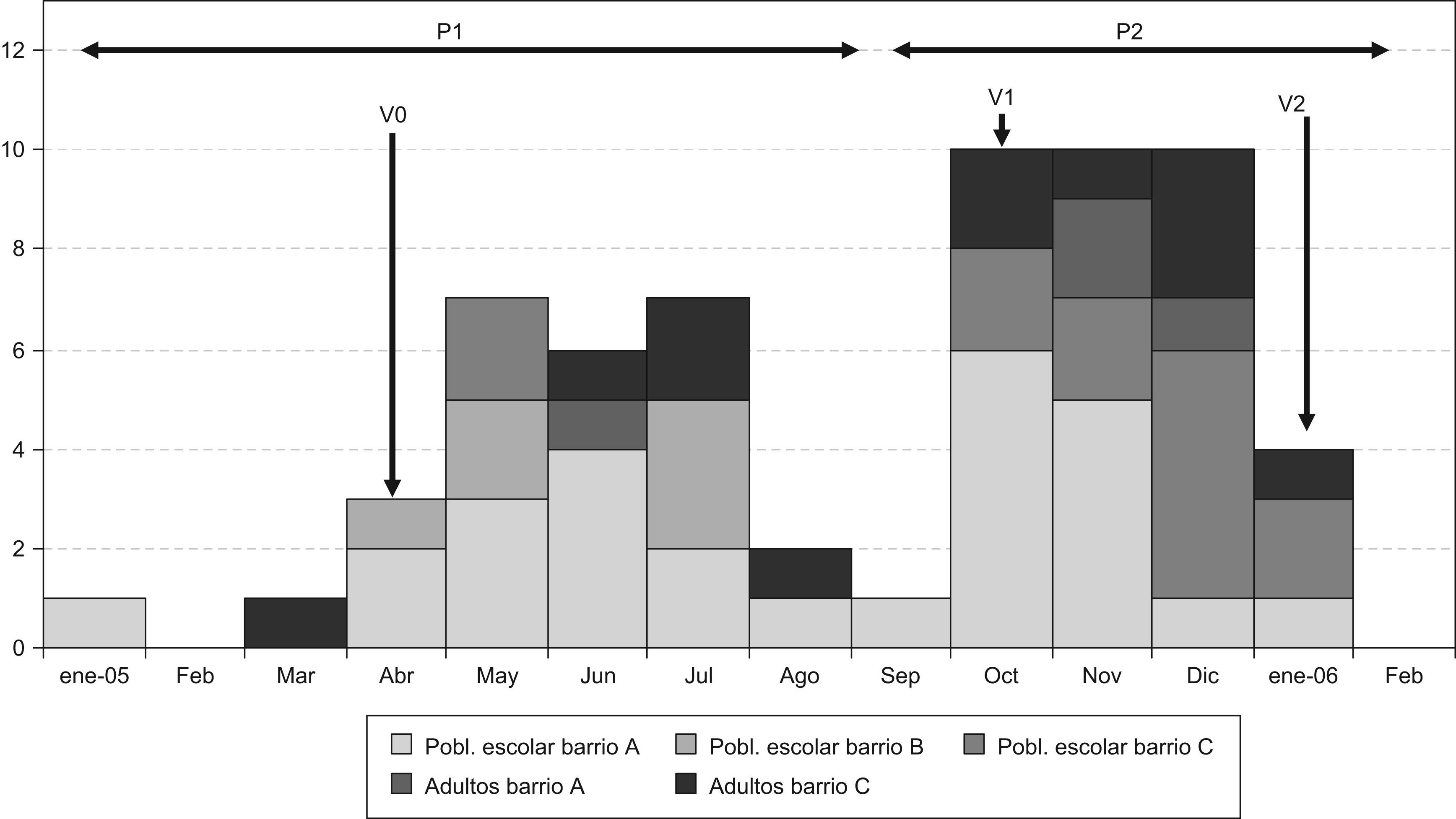
ResultadosDesde enero de 2005 a enero de 2006 se declararon 62 casos. Los grupos de edad más afectados fueron los escolares y los adultos jóvenes. El mecanismo de transmisión fue de persona a persona. La curva epidémica presenta dos periodos. Las medidas de control iniciales fueron higiénicas y administración de IG a los contactos; en el segundo periodo se complementaron con la vacunación contra la hepatitis A, administrada a los alumnos de los centros de enseñanza de los dos barrios inicialmente implicados. La extensión del brote a los barrios colindantes y la alarma social que ocasionó hicieron que se ampliara la vacunación a los centros de enseñanza próximos a aquellos en que se habían detectado casos. Después de la última vacunación, en enero de 2006, no se notificó ningún caso.
ConclusionesEl uso de la vacuna postexposición frente al virus de la hepatitis A en la población escolar y los adultos jóvenes parece ser una medida efectiva para el control de un brote.
To describe an outbreak of hepatitis A in the city of Albacete (Spain) and to assess the effectiveness of the control measures implemented.
MethodsWhen the outbreak was noted, definitions of a case were established. Clinical and epidemiological data were collected through a survey. The temporal-spatial distribution was identified through mapping and the epidemic curve. Health education and immunoglobulin (IG) administration were conducted as immediate prevention and control measures in the population at risk.
ResultsFrom January 2005 to January 2006, 62 cases were reported. The most affected age groups were school children and young adults. Transmission was person to person. The epidemic curve was divided into two periods. Initial control measures consisted of hygiene measures and IG administration to contacts. In the second period, these measures were complemented with vaccination against hepatitis A in students of the school centers of the two neighborhoods initially involved. Due to public alarm and spread of the outbreak to adjacent neighborhoods, vaccination was extended to schools close to those where cases had been detected. No cases were notified after the last vaccination in January 2006.
ConclusionsThe use of vaccination after exposure to the hepatitis A virus in young adults and the school population seems to be an effective outbreak control measure.
La hepatitis A es una enfermedad de etiología viral producida por un virus RNA perteneciente a la familia de los Picornaviridae. Su periodo de incubación es de 15–50 días, y su mayor contagiosidad coincide con la fase preclínica y los primeros días de las manifestaciones clínicas1–3.
En nuestro medio, tanto la incidencia de la hepatitis A como la seroprevalencia de anticuerpos frente al virus de la hepatitis A (AC anti-VHA) han disminuido significativamente en las últimas décadas, y también se ha observado un retraso en la edad de la infección. Actualmente el patrón epidemiológico de la hepatitis A es el propio de los países más desarrollados, con un elevado nivel higiénico sanitario2,4,5. En los años 1970, los estudios seroepidemiológicos mostraban una prevalencia de AC anti-VHA del 70% al 80% en la población de 20 a 40 años de edad, mientras que los realizados en la década de 1990 hallaban cifras del 50%6. Este cambio implica la existencia de un mayor número de personas susceptibles que llegarían a la edad adulta7 sin haber tenido contacto con el virus de la hepatitis A, y por tanto sin anticuerpos protectores y con un mayor riesgo de desarrollar la enfermedad clínicamente sintomática y más grave que a edades tempranas8.
Los brotes de hepatitis A se producen por transmisión directa entre personas, especialmente en grupos de alto riesgo con hábitos higiénicos insuficientes9 y en instituciones relacionadas con niños (guarderías, centros escolares, etc.), o a través de vehículos contaminados como el agua o los alimentos. En estos brotes los niños suponen una importante fuente de diseminación de la enfermedad, ya que la infección en este grupo de edad a menudo es asintomática y la eliminación del virus en las heces persiste durante el periodo de incubación10,11.
Las medidas preventivas y de control que se recomiendan en España, según la Red Nacional de Vigilancia Epidemiológica (RENAVE)2, contemplan la profilaxis postexposición con inmunoglobulina humana inespecífica (IG), el uso de vacuna de virus inactivados, o ambas. En caso de brote se recomienda únicamente la administración de IG a los contactos.
Diversos estudios12–17 han cuestionado el éxito limitado de esta recomendación en el control de los brotes, sobre todo cuando inciden en poblaciones de alto riesgo18, y sugieren el uso de la vacuna antihepatitis A para el control de brotes comunitarios puesto que la inmunización activa que proporciona la vacuna confiere una protección efectiva y duradera.
El objetivo de nuestro estudio es describir la investigación de un brote de hepatitis A en la ciudad de Albacete entre enero de 2005 y enero de 2006, que afectó principalmente a población escolar, y valorar la efectividad de las medidas de control que se adoptaron.
MétodosEl día 20 de abril de 2005 se notificó a la Sección de Epidemiología de la Delegación Provincial de Sanidad un brote de hepatitis A con afectación inicial de dos escolares residentes en dos barrios colindantes al sudeste de la ciudad de Albacete (barrios A y B).
Inicialmente se definió como caso aquel paciente que reuniera las tres características siguientes: sintomatología compatible con hepatitis A, detección de IgM anti-VHA en suero y criterios epidemiológicos de relación con un caso, ya fuese por residencia, vínculo familiar, laboral, escolar o de ocio.
Posteriormente utilizamos una definición más sensible y consideramos caso a todo paciente con criterios clínicos y de laboratorio compatibles y residente en cualquier barrio de Albacete.
Se diseñó un estudio epidemiológico descriptivo que incluyó variables de persona, lugar y tiempo, así como las medidas de control a adoptar en el curso del brote.
Se utilizó una encuesta epidemiológica para recoger la información, que incluía variables de filiación (edad, sexo, barrio de residencia, centro de enseñanza), clínicas (síntomas y signos), de laboratorio (transaminasas y anticuerpos IgM) y epidemiológicas (fecha de inicio de los síntomas y antecedente de contacto con otro paciente).
Se adoptó la decisión de que cualquier caso sospechoso de padecer hepatitis A fuera notificado de manera individualizada y urgente a la Sección de Epidemiología. En colaboración con el Servicio de Medicina Preventiva del Hospital Clínico Universitario se llevó a cabo una búsqueda activa de casos para identificar los no notificados que respondían a las definiciones dadas.
La frecuencia se determinó por las tasas de ataque. Los casos se describieron por su localización en la ciudad, y la evolución del brote mediante una curva epidémica.
Las medidas de control se establecieron inicialmente siguiendo los protocolos de las Enfermedades de Declaración Obligatoria (EDO) de la RENAVE2, que en caso de brote incluyen educación sanitaria y administración de IG a los contactos.
ResultadosEl brote fue identificado por la Sección de Epidemiología en abril de 2005. Los casos iniciales estaban relacionados por vínculos familiares y residían en dos barrios colindantes al sureste de la ciudad de Albacete (barrios A y B). En la búsqueda activa retrospectiva de casos de hepatitis A se identificó uno previo, con fecha de inicio en el mes de enero de 2005.
La duración del brote fue de 13 meses, de enero de 2005 a enero de 2006.
La curva epidémica presenta dos ondas o periodos (P1 y P2), separadas por el mes de septiembre de 2005 con un solo caso. La forma se corresponde con una transmisión de persona a persona. Los periodos se han identificado en función del tiempo de aparición de los casos, su localización en los barrios y las medidas de control adoptadas (fig. 1).
El P1 se caracteriza por una afectación mayoritaria de población escolar residente en los barrios A y B (tabla 1). En el P2 hay una mayor diversificación en la presentación de los casos, tanto espacial (aparecen por distintos barrios y centros de enseñanza de la ciudad) como por grupos de edad (afectación en adultos, en su mayoría menores de 40 años) y sin relación aparente con otros casos conocidos (fig. 1 y tabla 2).
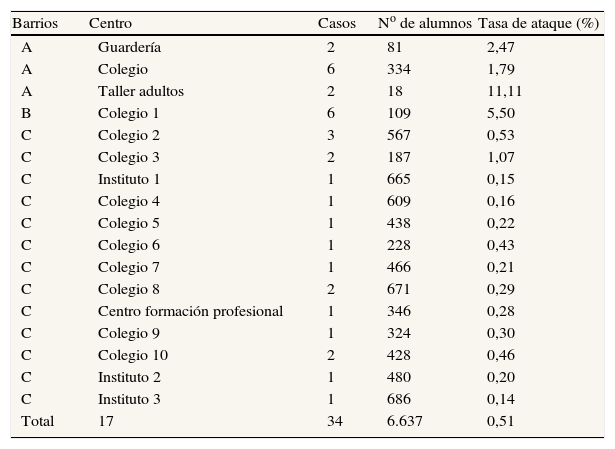
Número de alumnos afectados y tasa de ataque por 100 según centro de enseñanza y barrio
| Barrios | Centro | Casos | No de alumnos | Tasa de ataque (%) |
| A | Guardería | 2 | 81 | 2,47 |
| A | Colegio | 6 | 334 | 1,79 |
| A | Taller adultos | 2 | 18 | 11,11 |
| B | Colegio 1 | 6 | 109 | 5,50 |
| C | Colegio 2 | 3 | 567 | 0,53 |
| C | Colegio 3 | 2 | 187 | 1,07 |
| C | Instituto 1 | 1 | 665 | 0,15 |
| C | Colegio 4 | 1 | 609 | 0,16 |
| C | Colegio 5 | 1 | 438 | 0,22 |
| C | Colegio 6 | 1 | 228 | 0,43 |
| C | Colegio 7 | 1 | 466 | 0,21 |
| C | Colegio 8 | 2 | 671 | 0,29 |
| C | Centro formación profesional | 1 | 346 | 0,28 |
| C | Colegio 9 | 1 | 324 | 0,30 |
| C | Colegio 10 | 2 | 428 | 0,46 |
| C | Instituto 2 | 1 | 480 | 0,20 |
| C | Instituto 3 | 1 | 686 | 0,14 |
| Total | 17 | 34 | 6.637 | 0,51 |
A: barrio A; B: barrio B; C: barrios colindantes.
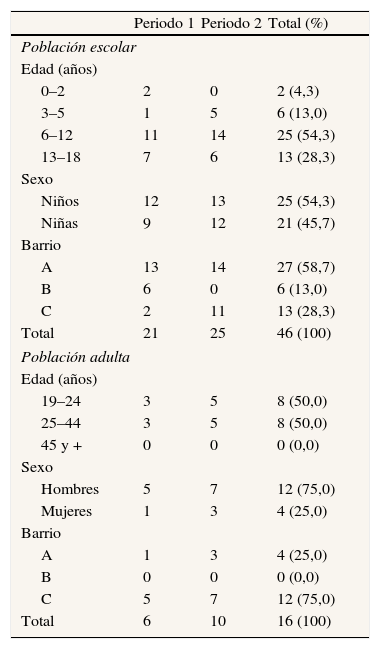
Número y porcentaje de casos por grupo de edad, sexo y barrio de residencia, según periodo y población adulta y escolar
| Periodo 1 | Periodo 2 | Total (%) | |
| Población escolar | |||
| Edad (años) | |||
| 0–2 | 2 | 0 | 2 (4,3) |
| 3–5 | 1 | 5 | 6 (13,0) |
| 6–12 | 11 | 14 | 25 (54,3) |
| 13–18 | 7 | 6 | 13 (28,3) |
| Sexo | |||
| Niños | 12 | 13 | 25 (54,3) |
| Niñas | 9 | 12 | 21 (45,7) |
| Barrio | |||
| A | 13 | 14 | 27 (58,7) |
| B | 6 | 0 | 6 (13,0) |
| C | 2 | 11 | 13 (28,3) |
| Total | 21 | 25 | 46 (100) |
| Población adulta | |||
| Edad (años) | |||
| 19–24 | 3 | 5 | 8 (50,0) |
| 25–44 | 3 | 5 | 8 (50,0) |
| 45 y + | 0 | 0 | 0 (0,0) |
| Sexo | |||
| Hombres | 5 | 7 | 12 (75,0) |
| Mujeres | 1 | 3 | 4 (25,0) |
| Barrio | |||
| A | 1 | 3 | 4 (25,0) |
| B | 0 | 0 | 0 (0,0) |
| C | 5 | 7 | 12 (75,0) |
| Total | 6 | 10 | 16 (100) |
A: barrio A; B: barrio B; C: barrios colindantes.
El 73% de los afectados estaba escolarizado, y no hubo casos en adultos mayores de 44 años (tabla 2). La razón de masculinidad fue de 1,3. Requirió hospitalización un 12,5% de los afectados y no se produjo ningún fallecimiento.
El estudio serológico mediante IgM frente al VHA fue positivo en 21 casos (34%).
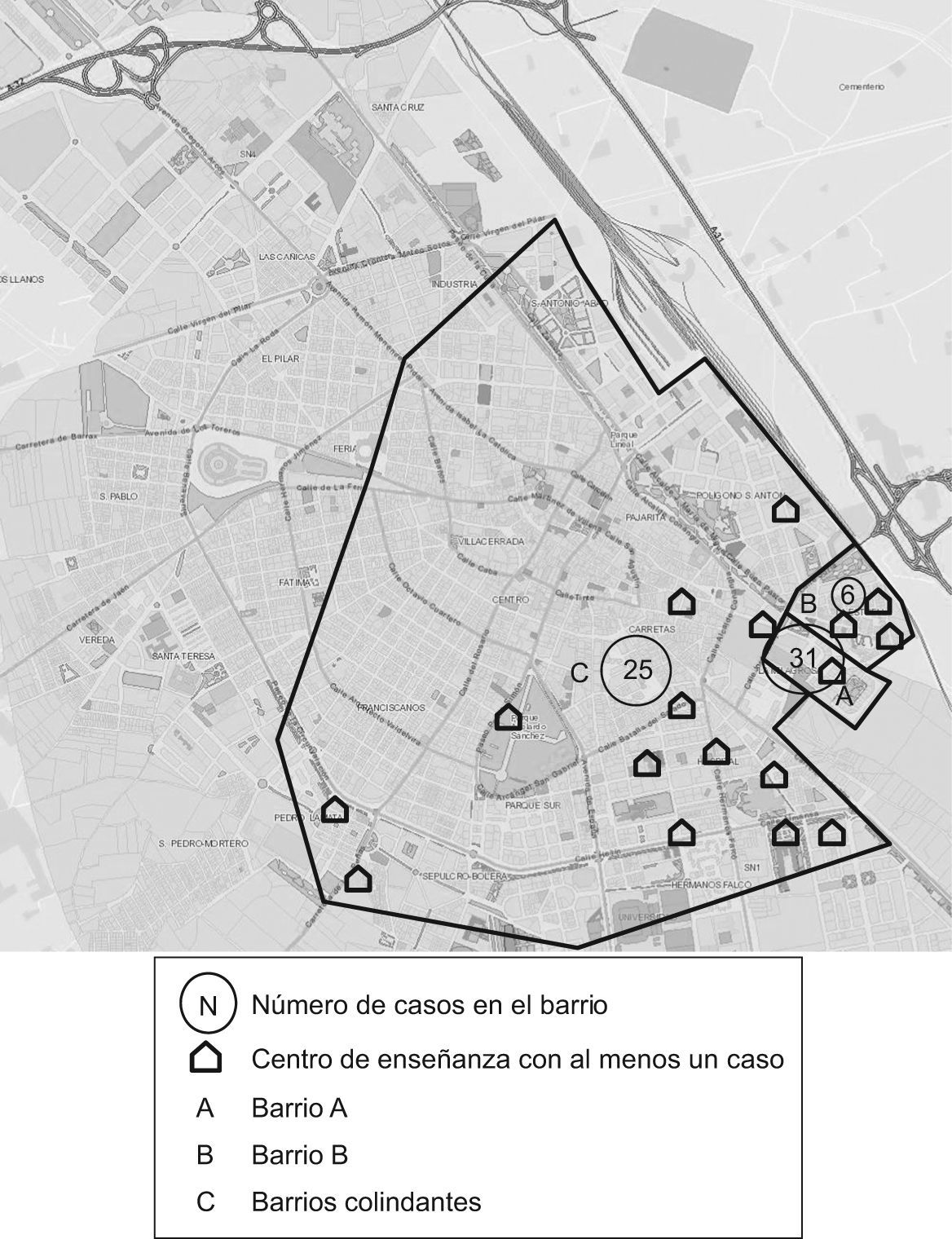
En total se vieron implicados 17 centros de enseñanza (11 colegios, tres institutos, una guardería, un centro de formación profesional y un taller de adultos), aunque en el P1 sólo hubo casos en seis de ellos (tabla 1 y fig. 2).
La tasa de ataque para el conjunto de los centros de enseñanza fue de un 0,5%. La mayor frecuencia de aparición se observó en los centros de los barrios iniciales (A y B) (tabla 1).
Las medidas de control fueron variando según la evolución del brote (fig. 2):
- •
Los primeros casos estaban relacionados familiarmente, por lo que siguiendo el protocolo de la RENAVE se recomendó la administración de IG y educación sanitaria a los contactos familiares y convivientes. A lo largo del P1, debido a la agrupación de casos en el medio escolar se optó por recomendar la administración de IG a 319 alumnos pertenecientes a 15 aulas de ocho centros de enseñanza donde habían ocurrido casos (V0).
- •
En el P2, al observar el repunte del brote se inició la vacunación contra el VHA como medida para frenar la transmisión a largo plazo. Se vacunó a los alumnos de tres colegios de los barrios implicados, así como a los de dos colegios próximos a los que acudían niños residentes en los barrios A y B, y a los asistentes a un taller formativo. La cobertura vacunal fue de un 81% sobre un total de 1.586 alumnos (V1). A partir de esta vacunación sólo se declaró un caso de hepatitis A en el barrio A, en una niña previamente vacunada (con fecha de inicio de los síntomas a los 6 días de la administración de la primera dosis de la vacuna contra la hepatitis A).
- •
La extensión a los barrios colindantes y la aparición de casos en adultos, alguno de ellos muy grave, generó en la población un estado de alarma social, por lo que al final del P2 se amplió la vacunación a la población escolar de los centros próximos a aquellos donde se había detectado algún caso de hepatitis A. Finalmente se incluyeron 26 centros de enseñanza, con un total de 15.000 alumnos. También se ofertó la vacunación a todos los profesores y monitores de comedores, menores de 45 años, que trabajaban en estos centros (V2). Después de la última vacunación, en enero de 2006, no se notificó ningún caso.
Se ha expuesto la evolución de un brote de hepatitis A ocurrido en el periodo comprendido entre enero de 2005 y enero de 2006, con un total de 62 casos, haciendo hincapié en las dificultades encontradas desde la primera definición de caso hasta la adopción de las medidas de control. En efecto, la definición inicial de caso resultó poco sensible debido a la aparición de enfermos con características epidemiológicas distintas de las iniciales, tanto en edad como en el barrio de residencia, pero en los que no podía descartarse su conexión con el brote por la posibilidad de infecciones subclínicas y su concurrencia en el tiempo.
En ninguno de los dos periodos descritos se aprecia un aumento brusco del número de casos, y se descarta una posible fuente común, como podría ser alimentos o agua. Las sucesivas ondas epidémicas vienen a confirmar una transmisión de persona a persona.
Las tasas de ataque en los centros docentes han sido muy bajas, lo que indica que las medidas fueron efectivas para el control, pero no para evitar la transmisión de la enfermedad de forma global.
La mejoría de las condiciones higiénico-sanitarias de nuestro país en las últimas décadas ha tenido como consecuencia la disminución de casos de hepatitis A, al tiempo que ha aumentado la proporción de sujetos susceptibles. Los estudios serológicos nacionales indican que, en la actualidad, más del 65% de la población menor de 40 años no tiene inmunidad frente al VHA19, lo cual facilita la transmisión en los brotes. Así, en los últimos años se han comunicado brotes epidémicos en adultos jóvenes, como el que se extendió durante un periodo de varios meses y afectó a un poblado de etnia gitana en el municipio de Balaguer en 19969, u otro que afectó a un poblado marginal ubicado en el sur de Madrid20, o el que ocurrió en una escuela infantil entre octubre de 2002 y febrero de 200321 en la misma ciudad.
Aunque el brote se identificó con una mayoría de enfermos de 6 a 18 años de edad, su origen y difusión podría estar en cualquier otro grupo de edad. Hay que tener en cuenta que no se conoce el volumen de casos que se presentan de manera suclínica1, y por lo tanto no son notificados. La población infantil podría ser el origen, debido a que es la que más cantidad de virus excreta y por consiguiente la mayor transmisora de la enfermedad3.
Es importante destacar que las notificaciones iniciales se demoraron por esperar a la confirmación analítica de los casos sospechosos, lo cual impidió la toma inmediata de las medidas de control recomendadas en el periodo de máxima infectividad, como la administración de IG en las dos semanas siguientes a la exposición, según el protocolo de las EDO2. Esto se pretendió solucionar mediante la declaración urgente de cualquier sospecha de caso. A pesar de ello, la efectividad de la medida propuesta inicialmente, la administración de IG, en el control de este brote, no fue definitiva ni siquiera individualmente, dado que la duración del brote fue mayor que el efecto protector de la IG, lo que obligó repetir la administración a las personas en riesgo.
Éste es un ejemplo de la necesidad de actualizar periódicamente los citados protocolos, ya que lo que debería ser una herramienta de uniformidad y ayuda a la hora de afrontar urgencias epidemiológicas se convierte en un inconveniente. Otros países han modificado sus recomendaciones conforme se ha observado su poca utilidad22–27. La menor concentración de AC anti-VHA en los preparados comerciales actuales de IG en todos los países occidentales, debido a la disminución de la prevalencia de portadores de anticuerpos en la población de donantes de plasma, en paralelo con la reducción de la incidencia de hepatitis A, también puede α estar influyendo en una menor duración de la protección inducida por la gammaglobulina y, por tanto, en su baja efectividad para combatir un brote epidémico2.
En vista de los buenos resultados obtenidos con la V1 (periodo 2), y ante la alarma social que se produjo en toda la ciudad por la extensión del brote a otras zonas, se consensuó por parte de las distintas autoridades sanitarias extender la vacunación contra el VHA a otros sectores de la población (V2), como medida de salud pública encaminada a romper la transmisión comunitaria del virus a largo plazo.
Como conclusión del estudio de este brote, coincidimos con otros trabajos12–17 que ponen de manifiesto la utilidad de la vacuna para el control de los brotes, si se puede delimitar y abordar el grupo de individuos susceptibles. En este mismo sentido se ha publicado un estudio aleatorizado y doble ciego28, que aun demostrando que tanto la vacuna como la IG proveen una buena protección después de la exposición, para personas entre 12 meses y 40 años, es preferible la vacuna a la IG.
El uso de la vacuna en este grupo de edad estaría justificado porque, aparte de conferir inmunidad a largo plazo, su administración es fácil y puede aplicarse a grandes grupos de población. Para personas mayores de 40 años no se dispone de información sobre la vacuna. Las manifestaciones clínicas de la enfermedad en este grupo de edad son más graves, y la protección se conseguiría de forma más rápida con la IG.
Al ser la población escolar y adulta joven la más afectada en este brote, cabría considerar que la edad y las prácticas que conlleva (escolaridad, actividades extraescolares, de ocio, etc.) son un importante factor de origen y transmisión del brote, por lo que se podría sugerir la vacunación universal a edades más tempranas y así proteger a los más jóvenes. Así mismo, el conocimiento de la magnitud de los casos sin expresión clínica, por medio de estudios de seroprevalencia en distintos grupos de población y en distintos tiempos, podría ayudar a decidir las estrategias de control y prevención en este tipo de brotes comunitarios.
FinanciaciónSin financiación.
AgradecimientosQueremos expresar nuestro agradecimiento a los profesionales asistenciales y no asistenciales del Área de Salud de Albacete, por su colaboración en el estudio y el control del brote.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
I. de la Cruz, A. Gómez, E. Almar, A. Mateos, C. Navarro y C. Ramírez concibieron el estudio. I. de la Cruz, A. Gómez y E. Almar fueron los encargados de la recogida de datos. I. de la Cruz, A. Gómez, E. Almar y M.J. Díaz realizaron el análisis de los datos. M.J. Díaz realizó el primer borrador del artículo. P. Segura contribuyó en la revisión y la versión final. Todos los autores aportaron ideas, interpretaron los hallazgos y revisaron los borradores del artículo. Todos los autores aprobaron la versión final. E. Almar es el responsable del artículo.