El auge de la medicina regenerativa y el crecimiento de la oferta de terapias autólogas obtenidas a partir de sangre, células o tejidos de los propios pacientes se ha visto favorecido por la actual disponibilidad de diversos dispositivos comerciales de fácil manejo que permiten la elaboración de los productos y su aplicación dentro de un mismo procedimiento. Independientemente de las dudosas eficacia y seguridad de muchos de los tratamientos que se ofrecen bajo el reclamo de las células madre o la medicina regenerativa, la mayor parte de los centros y de los profesionales que ofrecen estos tratamientos desconocen los requisitos y las implicaciones legales de su uso. Una confusión frecuente consiste en no distinguir entre la autorización que requiere el propio dispositivo, considerado producto sanitario, y la autorización para el uso del producto obtenido, que en general se trata de un medicamento, ya sea de terapia avanzada o no, o de un trasplante. Por otra parte, es frecuente que estos tratamientos tengan un carácter experimental, por lo que su administración en ese caso, además de requerir la evaluación ética correspondiente y la autorización de diversos organismos reguladores, debe ofrecerse de forma gratuita y tras recabar el consentimiento informado del paciente y contratar una póliza de seguros específica. En este artículo se presentan, de forma resumida, los principales requisitos para la aplicación de estos productos biológicos autólogos, con el objetivo de que puedan servir de guía tanto para los profesionales que los prescriben como para aquellos que inspeccionan los centros donde se administran. Por último, se ofrecen algunas recomendaciones para los pacientes.
The rise of regenerative medicine and the growth of the offer of autologous therapies, obtained from blood, cells or tissues of the patients, have been favoured by the current availability of an increasing number of commercial devices. Most of these devices are easy to use, allowing the elaboration of products and its application within the same procedure. Regardless of the questionable efficacy and safety of many of the treatments offered under the claim of stem cells or regenerative medicine, most of the centres and professionals offering these treatments are unaware of the legal requirements and implications of their use. A common confusion consists in not distinguishing between the authorization required by the equipment itself, considered a medical device, and the authorization for the use of the product obtained, usually considered a medicinal product (whether advanced therapy or not) or a transplant. Moreover, these treatments frequently have an experimental nature. In that case, in addition to requiring the corresponding ethical evaluation and the authorization of various regulatory bodies, their administration must be offered free of charge, obtaining the patient's informed consent and after contracting a specific insurance policy. In this article we present a brief summary of the main requirements for the application of these autologous biological products with the aim of serving as a guide both for the professionals who prescribe them and for those who inspect the centres where the products are administered. Finally, we include some recommendations for patients.
En los últimos años hemos asistido a una oferta creciente de tratamientos de medicina regenerativa por parte de numerosos establecimientos o clínicas, en especial de medicina deportiva, cirugía ortopédica y traumatología, medicina estética, dermatología, odontología, cirugía plástica, cirugía maxilofacial y oftalmología, gracias a la introducción en el mercado de diversos dispositivos de fácil manejo que, a partir de sangre, células o tejidos de los propios pacientes, permiten la elaboración de productos biológicos autólogos y su aplicación dentro de un mismo procedimiento1–3. Estas terapias, basadas en concentrados de plaquetas o de células, habitualmente denominadas «madre», se ofrecen como tratamientos innovadores y se anuncian, a pesar de estar prohibida su publicidad4,5, a modo de marchamo de calidad de establecimientos que buscan diferenciarse de sus competidores6. No obstante, más allá de las dudosas eficacia y seguridad de muchos de los tratamientos que se ofrecen bajo el reclamo de las células madre o de la medicina regenerativa, que muchas veces conllevan riesgos para la salud infravalorados7, la mayor parte de los centros que ofrecen estos tratamientos desconocen los requisitos y las implicaciones legales de su uso. El principal error radica en confundir las autorizaciones que requiere el propio dispositivo con las que requiere el producto obtenido para su aplicación en pacientes5; confusión propiciada, en ocasiones, por las propias empresas que comercializan los equipamientos. Una práctica observada en empresas del sector es publicitar que sus dispositivos disponen de todas las autorizaciones necesarias, cuando en realidad la autorización solo se refiere al equipamiento, no al uso del producto obtenido8, y se traslada una falsa seguridad a los profesionales involucrados en la indicación y la administración de los productos habitualmente sin la autorización requerida, quienes asumen responsabilidades muchas veces desconocidas.
En este artículo se presentan, de forma resumida, los principales requisitos para el uso de estos productos biológicos autólogos obtenidos mediante diversos dispositivos con el objetivo de que puedan servir de guía tanto para los profesionales que los prescriben como para aquellos que inspeccionan los centros donde se administran. También se ofrecen algunas recomendaciones para los pacientes. El ámbito de revisión se limita a la principal regulación europea y española vigente de aplicación a productos celulares y plasmáticos autólogos, específicamente los medicamentos de terapia avanzada, los trasplantes de células y tejidos, y el plasma rico en plaquetas (PRP), incluyendo los documentos con carácter de consideraciones, notas informativas e informes de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) y la Organización Nacional de Trasplantes.
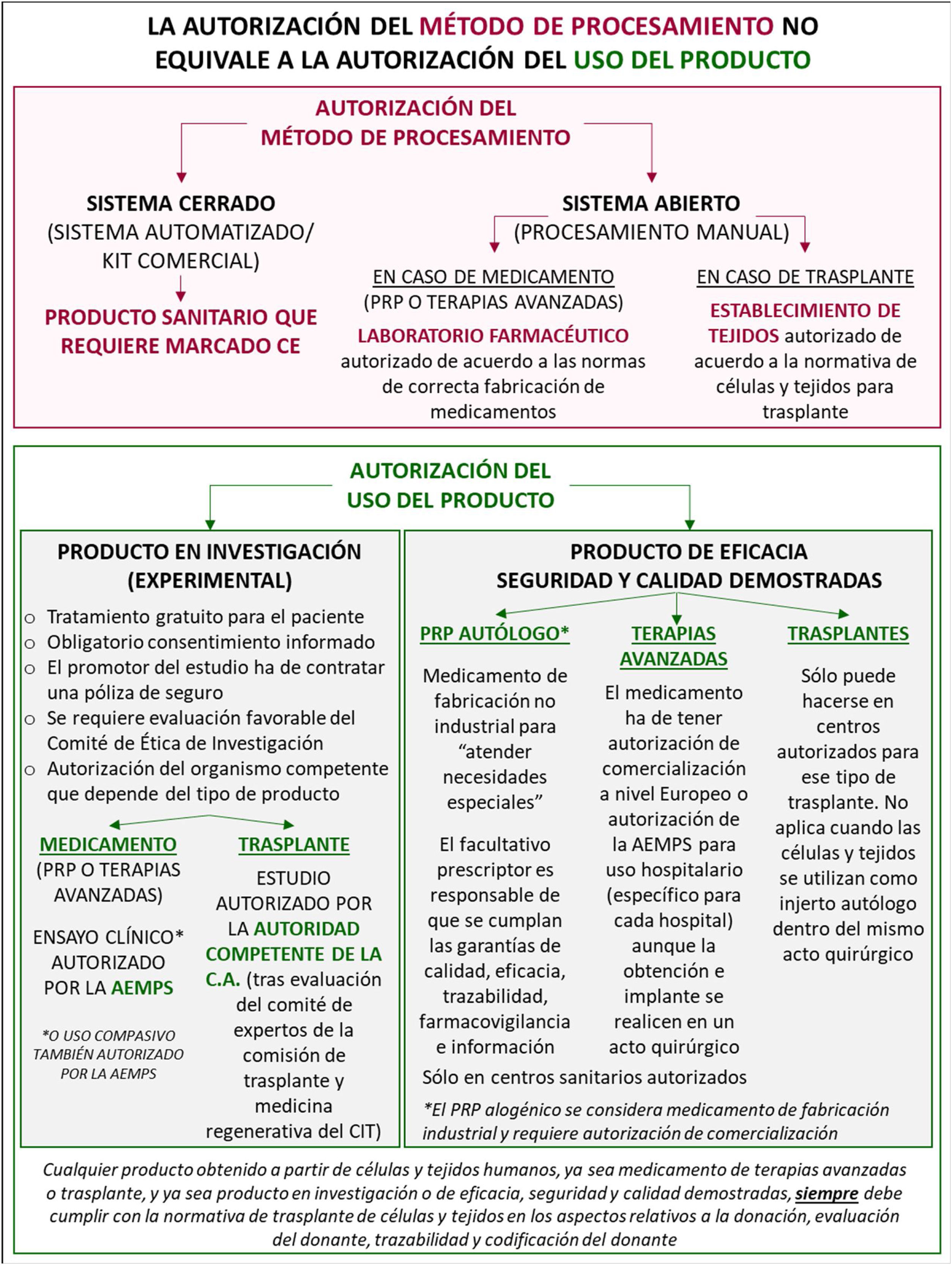
Consideración legal de los dispositivos y de los productos obtenidosLos dispositivos utilizados para la elaboración de productos biológicos autólogos tienen la consideración de productos sanitarios y, como tales, requieren disponer del correspondiente marcado CE otorgado por un Organismo Notificado dentro de la Unión Europea. Dicho marcado CE solo certifica un mecanismo de producción, no el producto final, y no implica la autorización del uso del producto obtenido4,5.
Respecto a los productos obtenidos, se distinguen fundamentalmente dos tipos: el PRP y los concentrados celulares. El PRP se obtiene a partir de la sangre del paciente y, dependiendo del protocolo de producción empleado, tiene una concentración variable de plaquetas, leucocitos, eritrocitos y moléculas bioactivas, y puede contener diferentes factores de crecimiento, citocinas y proteínas implicadas en la adhesión celular (fibrina, fibronectina y vitronectina). Bajo la nomenclatura de PRP se engloban el preparado rico en factores de crecimiento (PRGF), el plasma rico en plaquetas y factores de crecimiento (PRPGF), el plasma rico en plaquetas (PRP), el plasma pobre en plaquetas (PPP), el plasma rico en plaquetas y rico en leucocitos (LR-PRP), y el plasma rico en plaquetas y pobre en leucocitos (LP-PRP). El PRF (fibrina rica en plaquetas) se considera una segunda generación de PRP que también contiene leucocitos, citocinas y factores de crecimiento, pero dentro de una matriz tridimensional de fibrina. El PRF, cuando es autólogo, se considera medicamento de uso humano de fabricación no industrial para «atender necesidades especiales»4.
Los concentrados de células progenitoras o células troncales (denominadas coloquialmente «células madre») son productos que pueden aislarse a partir de diferentes tejidos, entre ellos la médula ósea, la sangre periférica y otros de fácil acceso, como la dermis obtenida a partir de una biopsia o sacabocados de piel, o la fracción vascular estromal que se obtiene de tejido adiposo previamente lipoaspirado. La composición celular de estos productos es variable y, según el tipo de manipulación y el uso que quiera darse al producto, puede tratarse de células para trasplante o, con más frecuencia, de medicamentos de terapia avanzada5, que están sometidos a una estricta regulación9. El producto celular se considera medicamento de terapia avanzada si las células o tejidos han sufrido una modificación sustancial10,11. No se consideran modificaciones sustanciales el corte, la trituración, el moldeo, la centrifugación, la imbibición en disoluciones antibióticas o antimicrobianas, la esterilización, la irradiación, la separación, concentración o purificación celular, el filtrado, la liofilización, la congelación, la criopreservación o preservación, ni la vitrificación10. Especialmente relevante es que también se considera medicamento de terapia avanzada si las células, aun no habiendo sido modificadas de forma sustancial, se utilizan buscando una función que difiere de las suyas esenciales10,11. Por tanto, aun en el caso de sistemas de obtención celular que no conllevan manipulación sustancial, si el producto celular se utiliza para una función diferente de la suya originaria, se trataría de un medicamento de terapia avanzada. Este es el caso, por ejemplo, de las células obtenidas de tejido adiposo, de mucosa o de piel que se utilizan con finalidad regenerativa de otros tejidos, como hueso, tendones, ligamentos o cartílago. La Agencia Europea de Medicamentos (EMA) se ha pronunciado en reiteradas ocasiones clasificando este tipo de productos como medicamento de terapia avanzada12. En cambio, la obtención de tejido o de células de una zona del cuerpo con el objetivo único de aplicarlo en otra zona diferente para su misma función no se consideraría un medicamento de terapia avanzada; este sería el caso, por ejemplo, de la obtención de tejido adiposo de una zona del cuerpo para proceder al relleno de otra zona diferente, como en los procedimientos de lipoescultura.
Métodos de obtención de PRP y concentrados celulares autólogos. Principales requisitos de calidadEl crecimiento experimentado en la oferta de terapias regenerativas se debe fundamentalmente a la actual disponibilidad de diversos dispositivos comerciales que, como ya se ha comentado, deben disponer del correspondiente marcado CE. En general, estos dispositivos consisten en sistemas cerrados semiautomatizados.
También existe la posibilidad de obtener concentrados celulares y PRP mediante métodos manuales que implican sistemas denominados «abiertos», cuyos requisitos de calidad varían en función del tipo de producto (fig. 1). En el caso del PRP, el procesamiento tiene que hacerse de acuerdo con las Normas de Correcta Fabricación de Medicamentos y en laboratorios que han de ser inspeccionados por la autoridad competente de las comunidades autónomas13,14. Los medicamentos de terapia avanzada deben fabricarse en laboratorios que cumplan con las Normas de Correcta Fabricación específicas de medicamentos de terapia avanzada15. Finalmente, en el caso de los productos considerados como trasplante, el procesamiento tiene que hacerse en establecimientos de tejidos autorizados por las autoridades sanitarias de las comunidades autónomas de acuerdo con los requisitos establecidos por la legislación española16.
Aspectos fundamentales de la autorización de los métodos de procesamiento y del uso de productos biológicos autólogos en medicina regenerativa. AEMPS: Agencia Española de Medicamentos y Productos Sanitarios; CA: comunidad autónoma; CIT: Consejo Interterritorial del Sistema Nacional de Salud; PRP: plasma rico en plaquetas (denominación genérica que engloba diversos productos, incluida la fibrina rica en plaquetas, que varían en el contenido de distintos tipos de células, citocinas y factores de crecimiento).
Con independencia del método de obtención del PRP, su uso se regula de igual manera, de acuerdo con lo establecido por la AEMPS4,13,14. Este tipo de medicamentos solo pueden ser prescritos por médicos, odontólogos o podólogos, en el ámbito de sus competencias respectivas, con la cualificación adecuada, con experiencia en el tratamiento, con el equipamiento o instrumentación adecuada, y en establecimientos y centros sanitarios que estén debidamente autorizados de acuerdo con la normativa vigente en las respectivas comunidades autónomas. Además, como cualquier otro medicamento sujeto a prescripción médica, queda prohibido cualquier tipo de publicidad destinada al público en general.
Es especialmente relevante saber que el prescriptor es el responsable de garantizar el cumplimiento de las garantías de calidad antes mencionadas (aunque el procesado y la obtención los realice otro). El facultativo prescriptor también es responsable de que se cumplan el resto de las garantías que exige la regulación, como las de trazabilidad, farmacovigilancia e información, así como las garantías de eficacia, es decir, que se va a utilizar el PRP para indicaciones en las que existe suficiente evidencia científica sobre su eficacia. La propia AEMPS subraya que en pocas indicaciones se han realizado ensayos clínicos de buena calidad. Por otra parte, la AEMPS informa de que, en colaboración con expertos y con las principales sociedades científicas implicadas, establecerá un listado de aplicaciones sobre las que existe evidencia de un balance beneficio-riesgo favorable al uso de cada PRP y aquellas en las que será necesario realizar ensayos clínicos para aceptar dicho uso, si bien hasta la fecha no se ha publicado ese listado. No obstante, recientemente el Consejo de Europa ha publicado la cuarta edición de su guía de calidad y seguridad de tejidos y células para uso humano, en la que se señala, respecto al uso del PRP, la falta de evidencia científica obtenida a partir de ensayos clínicos controlados y aleatorizados a gran escala, y se indica la necesidad de su realización para demostrar la eficacia17. Por ello, antes de poner en marcha la técnica para una determinada indicación, recomendamos consultar con la AEMPS.
Principales implicaciones y requisitos para el uso de concentrados celulares autólogosEn el caso de los medicamentos de terapia avanzada, la normativa que los regula se aplica en todos los casos, aunque sean medicamentos obtenidos con dispositivos que permiten su utilización dentro de un procedimiento quirúrgico (punto 2.47 de las normas de correcta fabricación de medicamentos de terapia avanzada)15. Es imprescindible tener presentes las consideraciones publicadas por la AEMPS en julio de 2018 sobre los productos sanitarios utilizados para la obtención de células autólogas y la clasificación del producto resultante como medicamento de terapia avanzada5. Dado que actualmente ningún medicamento de terapia avanzada obtenido mediante dispositivos o kits (que permiten su uso dentro de un procedimiento quirúrgico) dispone de autorización de comercialización18,19 (que solo puede obtenerse a través de la EMA10) ni de autorización de uso hospitalario20,21 (que solo puede obtenerse de la AEMPS), todos estos tratamientos se consideran medicamentos en investigación que únicamente pueden ser ofrecidos a los pacientes de forma gratuita y dentro de un ensayo clínico autorizado por la AEMPS22, o como uso compasivo23 que también debe ser autorizado por la AEMPS. Además, es obligatorio informar al paciente del carácter experimental del tratamiento y recabar su consentimiento.
Por otra parte, en el caso de trasplantes de células y tejidos que tengan consideración de terapias experimentales, el promotor, además de remitir el estudio para su evaluación al comité de ética de la investigación correspondiente, tiene que solicitar la autorización a la autoridad competente de su comunidad autónoma (habitualmente la Coordinación Autonómica de Trasplantes), que ha de requerir su evaluación por el comité de expertos de la Comisión de Trasplantes y Medicina Regenerativa del Consejo Interterritorial del Sistema Nacional de Salud24.
Finalmente, los medicamentos de terapia avanzada fabricados a partir de células y tejidos humanos, sean autólogos o no, y tanto medicamentos en investigación como autorizados para su uso hospitalario o para su comercialización, siempre deben cumplir con la normativa de trasplante de células y tejidos en los aspectos relativos a donación, evaluación del donante, trazabilidad y codificación del donante9. Por tanto, al igual que en los trasplantes, solo pueden obtenerse células y tejidos en centros debidamente autorizados para ello por las autoridades sanitarias de la comunidad autónoma de acuerdo con los requisitos establecidos en la legislación española16.
Algunas conclusiones y recomendacionesEl uso de productos biológicos autólogos basados en plasma o en células de los propios pacientes está cada vez más extendido, y se ofrecen como tratamientos de medicina regenerativa sencillos y rápidos. No obstante, a pesar de que España dispone de una regulación de las más avanzadas del mundo y de los esfuerzos de los organismos reguladores por difundir los requisitos para su adecuada aplicación en los pacientes, muchas veces estos tratamientos se aplican sin las suficientes garantías o incluso fuera de la legalidad.
Es preocupante en especial la utilización de medicamentos, ya sean de terapia avanzada o no, que aún no disponen de las suficientes garantías de calidad, seguridad y eficacia, y que por tanto deberían ofrecerse exclusivamente dentro de un ensayo clínico autorizado, tras recabar el consentimiento informado del paciente para someterse a un tratamiento experimental y de forma gratuita. Estas prácticas podrían suponer tanto un fraude para el paciente como un riesgo para su salud.
Por todo ello, es importante el esfuerzo que diversas sociedades científicas y organismos reguladores estamos haciendo por difundir los requisitos para la adecuada aplicación de estos tratamientos entre profesionales, inspectores sanitarios y pacientes. Estos últimos, antes de someterse a un tratamiento con sus propias células fuera de un ensayo clínico y pagar por ello, deberían solicitar a quien se lo prescribe la correspondiente autorización para el uso hospitalario del producto (de la AEMPS) o para su comercialización (de la Comisión Europea). Si el prescriptor afirma que se trata de un tratamiento de medicina regenerativa no considerado medicamento, el paciente debería preguntar al profesional que se lo prescribe por el pronunciamiento de la AEMPS al respecto, dado que es el organismo al que corresponde establecer dicha consideración5. En caso de dudas, siempre es recomendable contactar directamente con la propia AEMPS o con la Organización Nacional de Trasplantes.
Editor responsable del artículoJavier García Amez.
Contribuciones de autoríaLa escritura del artículo ha sido llevada a cabo por la autora para la correspondencia, pero todos/as los/las autores/as han participado en la concepción y el diseño del trabajo, y en su revisión crítica, haciendo importantes contribuciones intelectuales. Todas las personas firmantes han aprobado la versión final para su publicación y se hacen responsables y garantes de todos los aspectos que integran el manuscrito, que han sido revisados y discutidos entre todos/as con la finalidad de que sean expuestos con la máxima precisión e integridad.
FinanciaciónNinguna.
Conflictos de interesesNinguno.