Describir la secuencia de hechos acontecidos respecto al caso Glivec® en la India y analizar las opiniones generadas en diferentes ámbitos.
MétodoBúsqueda sistemática de artículos sobre la patente de imatinib (Glivec®) en la India. Se seleccionaron los que describían los acontecimientos, las decisiones de las instancias implicadas y las opiniones en la prensa general y científica, con identificación de las fechas y de los argumentos de las partes implicadas.
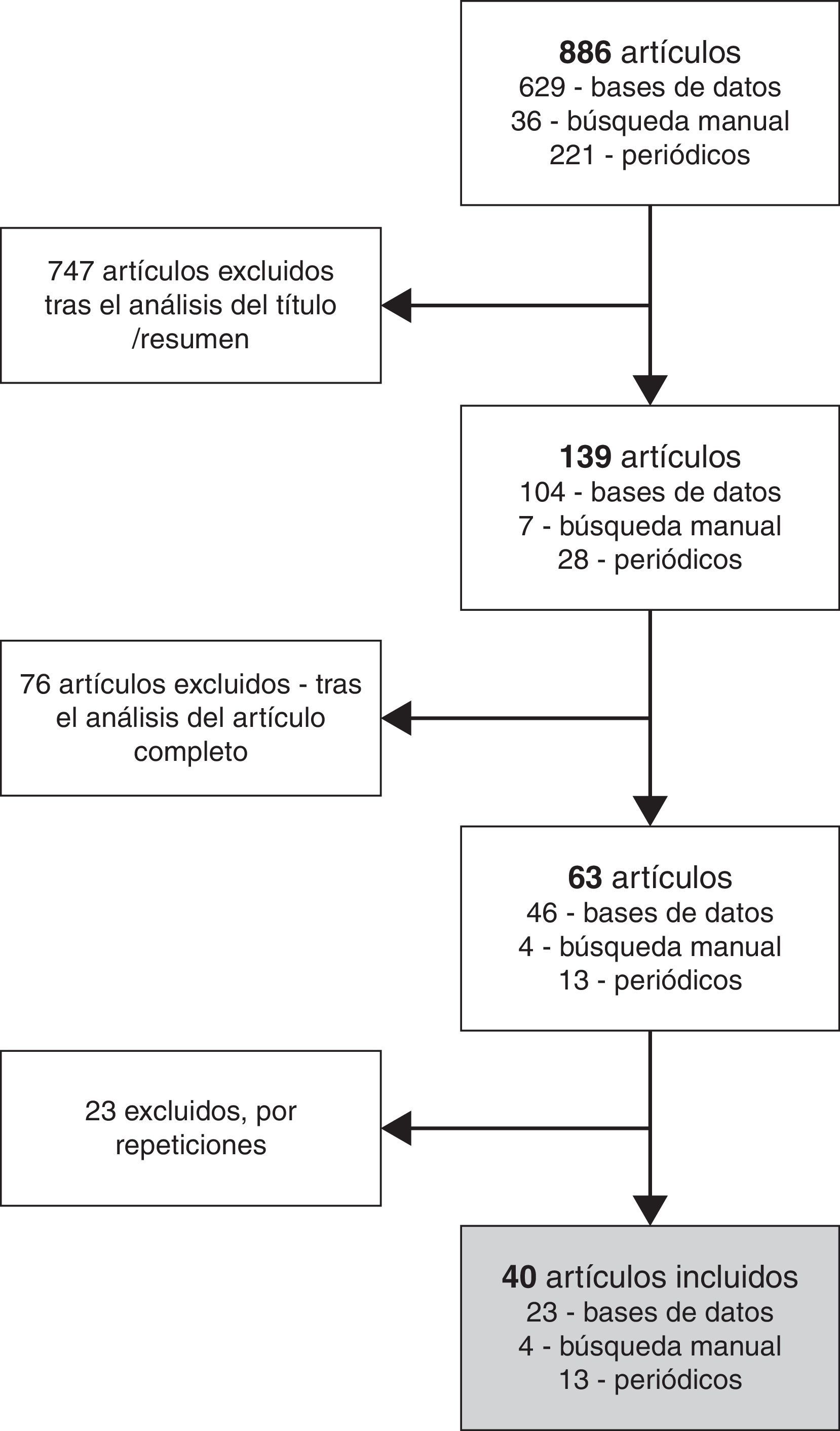
ResultadosDe los 886 documentos obtenidos se seleccionaron 40, publicados entre 2003 y 2013, mayoritariamente de tipo periodístico y comentarios. El caso duró 7 años, desde el rechazo de la patente presentada por Novartis ante la oficina de patentes de la India en 2006 hasta la ratificación de esta decisión por el tribunal supremo en 2013. Entre las controversias surgidas destacaron los argumentos en defensa de la ley de patentes India, promulgada para favorecer el acceso a los medicamentos en los países del Tercer Mundo. El fallo judicial ha recibido el apoyo de diversas instituciones, si bien un análisis objetivo implica considerar también los argumentos presentados por las empresas farmacéuticas y otras instituciones.
ConclusiónEl caso Glivec® ha planteado el debate sobre la adecuación de las normas internacionales, su aplicabilidad en el entorno económico y su adaptación en cada país. Este caso, y otros, deberían contribuir a la reflexión sobre el sistema internacional de patentes a fin de preservar la salud de la población más necesitada de una atención sanitaria adecuada en equilibrio con la protección de la propiedad intelectual y la innovación.
To describe the sequence of events involving the Glivec® case in India and to analyze the opinions generated in distinct settings.
MethodWe performed a systematic search for articles concerning the imatinib (Glivec®) patent in India. We selected those sources that described the events, decisions of the authorities involved, and press and scientific opinions. Dates and arguments presented by the involved parties were clearly identified.
ResultsOf 886 documents initially obtained, we selected 40 documents published between 2003 and 2013. Most of them were press news and commentaries. The process lasted 7 years, starting in 2006 when the Indian Patent Office rejected the patent application filed by Novartis. It ended in 2013 when the Indian Supreme Court upheld this decision. It was argued that the Indian Patent Law would facilitate access to medicines in the Third World and the final decision has received support by the general population. Although the court's final decision has been supported by several institutions, an objective analysis should also take into account the arguments of the pharmaceutical companies and other entities.
ConclusionThe Glivec® case gave rise to an intense debate on the appropriateness of international standards on patents, their applicability and how they should be adopted in each country. This case, as well as other cases, should serve to stimulate reflection on the international patent system and to achieve scenarios in which the health of the poorest populations is protected but also balanced against intellectual property protection and innovation.
La entrada en vigor de la ley de patentes en la India en 2005, como modificación de la ley previa de 1970, supuso una mejora en el sistema de patentes indio porque introdujo la posibilidad de patentar productos farmacéuticos cuando hasta el momento sólo permitía la patente de procesos1. Sin embargo, implicó una limitación para casos específicos considerados como no patentables, puesto que la sección 3d de la nueva ley excluye la posibilidad de proteger nuevas formas de una sustancia conocida que no suponga una «mejora de la eficacia», expresión que puede conducir a diferentes interpretaciones. Desde entonces, y en aplicación de esta ley, la oficina de patentes india (Indian Patent Office) ha retirado o negado la patente de al menos 12 medicamentos por no suponer una mejora de la eficacia2. Una de estas decisiones afectó la patente del imatinib (Glivec®), de Novartis, cuando la solicitó para la forma cristalina beta del mesilato de imatinib. El desacuerdo de esta compañía con la negativa generó un largo conflicto entre ella y las instancias judiciales de la India. Conocido como «el caso Glivec®», condujo al primer juicio a la luz de la nueva ley y se le considera el paradigma de tales conflictos. Este caso abrió el debate internacional sobre el sistema de protección de patentes, su impacto en la innovación y el acceso a los medicamentos en el Tercer Mundo3. En realidad, no se debatía sólo la patente del mesilato de imatinib, sino una interpretación de la norma jurídica que podía tener importantes consecuencias para la comercialización de muchos medicamentos en los países del Tercer Mundo.
El imatinib es un fármaco de gran interés para el tratamiento de la leucemia mieloide crónica. En los años 1960 se estableció que esta enfermedad era consecuencia de una alteración genética, fundamentada en la formación del llamado cromosoma Filadelfia y la producción de la oncoproteína BCR-Abl4. No fue hasta principios de la década de 1990 que se obtuvo el imatinib, primer inhibidor selectivo frente a la tirosina-cinasa de las células proliferativas de la leucemia mieloide crónica5. Novartis obtuvo diversas patentes vinculadas al principio activo imatinib, y tras la realización de los estudios necesarios para su registro consiguió la autorización para comercializarlo en más de 30 países a partir de 20016.
En el año 2006, a raíz de las peculiaridades de la legislación india, la oficina de patentes de este país rechazó la protección para la forma cristalina beta del mesilato de imatinib, polimorfo finalmente seleccionado para la preparación farmacéutica. Así, tras varios años de juicios, sentencias y apelaciones por parte de Novartis, el tribunal supremo de la India (Indian Supreme Court), como máxima instancia judicial del país, dictaminó a favor de su oficina de patentes en abril de 20137.
El objetivo del presente artículo es describir con detalle la secuencia de hechos del caso Glivec® y recoger las opiniones generadas, a fin de poder analizar objetivamente, desde una perspectiva global, las posibles consecuencias tanto para el sistema de patentes del Tercer Mundo como para la salud pública mundial.
MétodosEn primer lugar, se realizó una búsqueda sistemática de los artículos científicos que incluyesen información sobre el caso Glivec®. Se utilizaron las bases de datos Medline, EMBASE, Web of Science y Google Scholar. A continuación se realizó una búsqueda de artículos periodísticos de la prensa internacional escrita a través de The Wall Street Journal y The New York Times. Esta búsqueda se completó con la española y portuguesa, mediante la consulta de las bases de datos de La Vanguardia, El Mundo, El País, Expresso, Sol, Jornal de Notícias, Diário de Notícia y Público. La búsqueda de noticias publicadas en la prensa general se justifica por la repercusión social del caso Glivec® y por el limitado debate generado en nuestro entorno científico. Asimismo, se realizó una búsqueda manual de la información aparecida en las páginas web de Novartis y del gobierno de la India.
Para la realización de las búsquedas en las bases de datos se utilizaron las palabras clave: India* AND patent AND (glivec OR imatinib OR gleevec OR novartis OR cancer) hasta septiembre de 2013. Para la búsqueda en Google Scholar se empleó la estrategia (“patent” OR “patents”) AND (”India” OR “Indian”) AND (“gleevec” OR “glivec” OR “imatinib”) AND (“novartis” AND “court”), desde 2006 hasta septiembre de 2013.
Se procedió a la selección inicial de los artículos a partir de la lectura de los títulos y de los resúmenes. Como criterios de selección se consideró que los artículos debían describir objetivamente los acontecimientos y decisiones relacionados con el caso Glivec® en la India con una clara identificación de la fecha de los hechos y la descripción de los argumentos de las partes interesadas, ya fuesen el gobierno, otras organizaciones gubernamentales o la compañía farmacéutica. En una segunda fase se revisaron los textos completos de todos los artículos seleccionados con el fin de asegurar que se cumplieran los criterios citados. La recogida de datos se realizó con un formulario que incluía el año de publicación del artículo, el primer autor, el título, el tipo de artículo (periodístico, de opinión, editorial, original, revisión o informe), la fuente y el país de origen; se anotaban también la fecha y los acontecimientos relatados, así como otras observaciones de interés.
ResultadosEn la figura 1 se presenta el proceso de selección de los artículos de acuerdo con los criterios definidos. La búsqueda en las cuatro bases de datos, los diez periódicos y los sitios web de la compañía farmacéutica y del gobierno de la India llevó a la obtención de 886 documentos, de los cuales se seleccionaron 40 para proceder a su análisis detallado. Los artículos seleccionados se habían publicado entre 2003 y 2013, con un mayor número en 2007 (n=12) y 2013 (n=17), coincidiendo con las decisiones de los tribunales indios. La mayoría de los artículos eran de tipo periodístico (n=25), publicados en periódicos generalistas y en revistas científicas, seguidos de artículos de opinión (n=8). No se encontró ningún artículo científico de revisión en el cual se detallasen los hechos de forma cronológica.
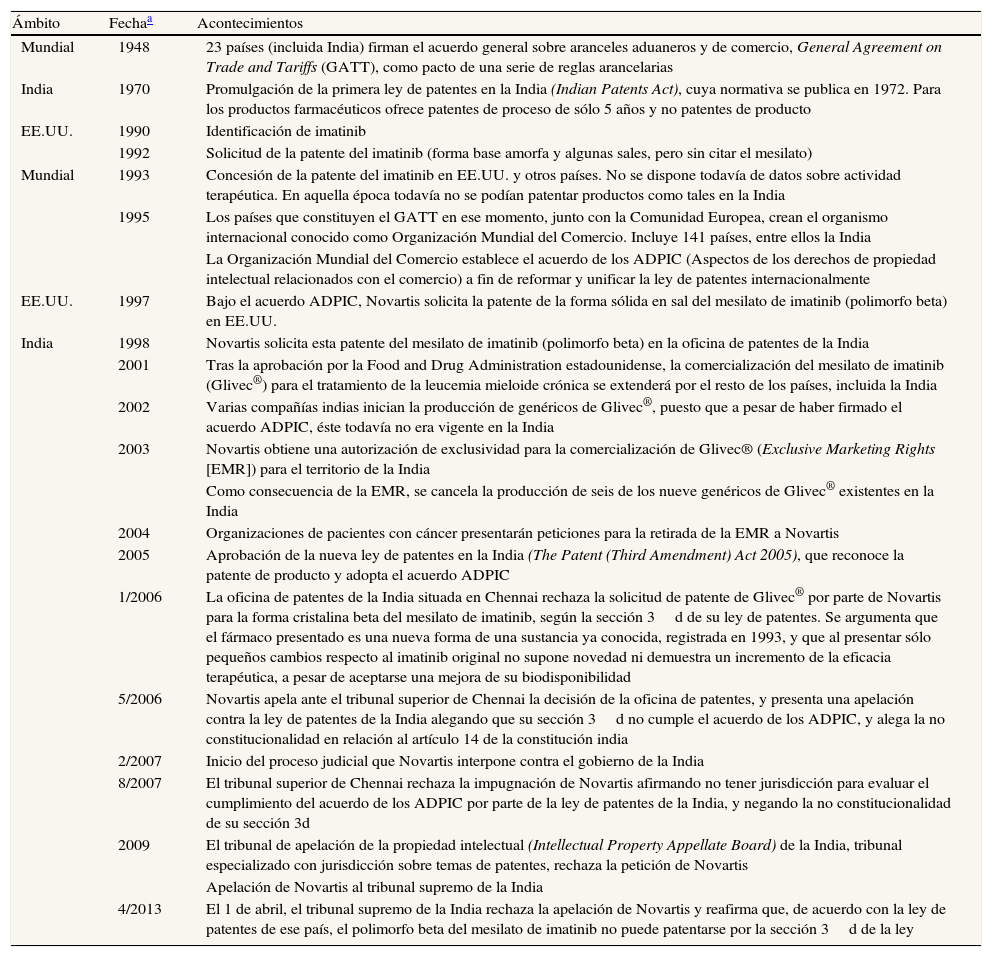
La tabla 1 incluye los datos más destacados para entender el caso Glivec®. Puede observarse que el proceso jurídico se alargó durante 7 años, desde el primer rechazo por parte de la oficina de patentes de Chennai en 2006 hasta la decisión final del tribunal supremo en abril de 2013. El rechazo inicial se justificó basándose en la sección 3d de la ley de patentes, y consideraba que la forma cristalina beta del mesilato de imatinib no era un producto novedoso y que no se aportaban pruebas sobre un incremento de la eficacia terapéutica frente a la primera patente8. A su vez, Novartis defendió que la patente inicial presentada en 1993 no incluía la evaluación de la actividad terapéutica que se realizó después de las modificaciones que originaron la síntesis de la sal mesilato de imatinib (que inicialmente contenía tanto polimorfos alfa como beta) y, más tarde, de su nueva forma cristalina beta (forma farmacéutica de Glivec®). La compañía farmacéutica apeló al tribunal superior de Chennai (órgano de representación territorial del tribunal supremo indio), alegando que se había vulnerado el cumplimiento del acuerdo ADPIC (Aspectos de los derechos de propiedad intelectual relacionados con el comercio) (tabla 1) y reclamando la inconstitucionalidad de la sección 3d de la ley de patentes2,9. La división de patentes de dicho tribunal rechazó la patente con el argumento de la falta de jurisdicción para evaluar el incumplimiento del acuerdo ADPIC, y negando la inconstitucionalidad de la sección 3d de su ley de patentes. A consecuencia de esta decisión, la compañía farmacéutica presentó una nueva apelación a la más alta instancia judicial del país, el tribunal supremo indio. El fallo final de este tribunal ratificó la decisión de la oficina de patentes. Además, rechazó la inconstitucionalidad de la sección 3d de la ley de patentes y consideró que era esencial para garantizar el acceso a los medicamentos y el control de las extensiones de patentes sin evidencias de un incremento de la eficacia2,10,11.
Descripción en orden cronológico de los principales hechos relacionados con el caso Glivec®
| Ámbito | Fechaa | Acontecimientos |
| Mundial | 1948 | 23 países (incluida India) firman el acuerdo general sobre aranceles aduaneros y de comercio, General Agreement on Trade and Tariffs (GATT), como pacto de una serie de reglas arancelarias |
| India | 1970 | Promulgación de la primera ley de patentes en la India (Indian Patents Act), cuya normativa se publica en 1972. Para los productos farmacéuticos ofrece patentes de proceso de sólo 5 años y no patentes de producto |
| EE.UU. | 1990 | Identificación de imatinib |
| 1992 | Solicitud de la patente del imatinib (forma base amorfa y algunas sales, pero sin citar el mesilato) | |
| Mundial | 1993 | Concesión de la patente del imatinib en EE.UU. y otros países. No se dispone todavía de datos sobre actividad terapéutica. En aquella época todavía no se podían patentar productos como tales en la India |
| 1995 | Los países que constituyen el GATT en ese momento, junto con la Comunidad Europea, crean el organismo internacional conocido como Organización Mundial del Comercio. Incluye 141 países, entre ellos la India | |
| La Organización Mundial del Comercio establece el acuerdo de los ADPIC (Aspectos de los derechos de propiedad intelectual relacionados con el comercio) a fin de reformar y unificar la ley de patentes internacionalmente | ||
| EE.UU. | 1997 | Bajo el acuerdo ADPIC, Novartis solicita la patente de la forma sólida en sal del mesilato de imatinib (polimorfo beta) en EE.UU. |
| India | 1998 | Novartis solicita esta patente del mesilato de imatinib (polimorfo beta) en la oficina de patentes de la India |
| 2001 | Tras la aprobación por la Food and Drug Administration estadounidense, la comercialización del mesilato de imatinib (Glivec®) para el tratamiento de la leucemia mieloide crónica se extenderá por el resto de los países, incluida la India | |
| 2002 | Varias compañías indias inician la producción de genéricos de Glivec®, puesto que a pesar de haber firmado el acuerdo ADPIC, éste todavía no era vigente en la India | |
| 2003 | Novartis obtiene una autorización de exclusividad para la comercialización de Glivec® (Exclusive Marketing Rights [EMR]) para el territorio de la India | |
| Como consecuencia de la EMR, se cancela la producción de seis de los nueve genéricos de Glivec® existentes en la India | ||
| 2004 | Organizaciones de pacientes con cáncer presentarán peticiones para la retirada de la EMR a Novartis | |
| 2005 | Aprobación de la nueva ley de patentes en la India (The Patent (Third Amendment) Act 2005), que reconoce la patente de producto y adopta el acuerdo ADPIC | |
| 1/2006 | La oficina de patentes de la India situada en Chennai rechaza la solicitud de patente de Glivec® por parte de Novartis para la forma cristalina beta del mesilato de imatinib, según la sección 3d de su ley de patentes. Se argumenta que el fármaco presentado es una nueva forma de una sustancia ya conocida, registrada en 1993, y que al presentar sólo pequeños cambios respecto al imatinib original no supone novedad ni demuestra un incremento de la eficacia terapéutica, a pesar de aceptarse una mejora de su biodisponibilidad | |
| 5/2006 | Novartis apela ante el tribunal superior de Chennai la decisión de la oficina de patentes, y presenta una apelación contra la ley de patentes de la India alegando que su sección 3d no cumple el acuerdo de los ADPIC, y alega la no constitucionalidad en relación al artículo 14 de la constitución india | |
| 2/2007 | Inicio del proceso judicial que Novartis interpone contra el gobierno de la India | |
| 8/2007 | El tribunal superior de Chennai rechaza la impugnación de Novartis afirmando no tener jurisdicción para evaluar el cumplimiento del acuerdo de los ADPIC por parte de la ley de patentes de la India, y negando la no constitucionalidad de su sección 3d | |
| 2009 | El tribunal de apelación de la propiedad intelectual (Intellectual Property Appellate Board) de la India, tribunal especializado con jurisdicción sobre temas de patentes, rechaza la petición de Novartis | |
| Apelación de Novartis al tribunal supremo de la India | ||
| 4/2013 | El 1 de abril, el tribunal supremo de la India rechaza la apelación de Novartis y reafirma que, de acuerdo con la ley de patentes de ese país, el polimorfo beta del mesilato de imatinib no puede patentarse por la sección 3d de la ley |
Los 7 años de batalla legal del caso Glivec® han desencadenado un amplio debate sobre la adecuación del sistema de patentes, su impacto en la innovación farmacéutica y el acceso a los medicamentos en los países del Tercer Mundo. A la luz de los datos analizados, la decisión final del tribunal supremo indio ha generado opiniones enfrentadas.
En primer lugar destaca la postura del gobierno de la India, que se ha erigido en pionero de la defensa de los intereses de los países del Tercer Mundo. Con la interpretación dada a su nueva ley por parte de los tribunales, dispone de más libertad en la evaluación de las patentes. Con esta medida defiende el fomento del amplio acceso a los medicamentos y potencia las compañías farmacéuticas de medicamentos genéricos de su país. A raíz de ello, la industria farmacéutica india ha crecido exponencialmente a expensas de la producción de medicamentos genéricos, convirtiéndose en una especie de farmacia low cost de los países en desarrollo y en la tercera potencia mundial en producción de medicamentos7,10,12. El liderazgo de la India ha generado posteriormente conflictos sobre la protección de la propiedad intelectual también en otros países, como Sudáfrica13. Independientemente de lo justificadas que estén estas iniciativas, existen importantes aspectos que deben tenerse en cuenta. Se plantea el respeto por las leyes internacionales para no frenar la innovación dentro de sus propias fronteras ni en otros países14. Por ejemplo, se ha acusado de competencia desleal la protección de las empresas de genéricos indias, que ingresan importantes beneficios económicos sin que fomenten la innovación15. Otro aspecto controvertido se refiere a si la introducción más precoz de medicamentos genéricos sería la forma más adecuada de favorecer el acceso a los medicamentos en los países del Tercer Mundo, pues probablemente el factor coste no resulte tan decisivo ni el precio de los genéricos sea asequible para muchos de ellos15. Asimismo, la posición del gobierno indio podría generar reacciones poco deseables, como el desvío de la inversión farmacéutica hacia otros países, como China2,12, e incluso poner en peligro el acceso a nuevos medicamentos en la propia India16.
En la línea de las críticas, también se ha reclamado al gobierno indio mayor atención hacia aspectos deficitarios propios de salud pública, como el acceso a medicamentos esenciales seguros y eficaces, a servicios hospitalarios y a asistencia médica en general, entre otros, lo que beneficiaría a grupos mucho más amplios de la población17. Igualmente, debería afrontar las limitaciones del funcionamiento de su sistema de regulación de medicamentos, su limitada infraestructura reglamentaria, la deficitaria regulación de los ensayos clínicos y la proliferación de las combinaciones de fármacos en dosis fijas18.
Respecto a la regulación de los medicamentos en los países en vías de desarrollo, se requieren medios y esfuerzos que aseguren la calidad de estos productos, y para ello deberían alcanzarse acuerdos globales por tratarse de una prioridad en salud pública19.
Otras acciones del gobierno indio en el ámbito farmacéutico siguen siendo polémicas. Por ejemplo, resulta muy difícil comprender las ventajas de la reciente estrategia de implantación de licencias obligatorias en la India. En el año 2012 se concedió una licencia obligatoria del antineoplásico sorafenib, desarrollado por Bayer, a la empresa de genéricos india Natco Pharma, que ahora lo produce y comercializa aunque se trata de un fármaco innovador protegido por patente. Infringiendo las normas internacionales, el gobierno indio justificó la autorización de este genérico por el alto precio del medicamento original12,20.
Por otro lado se encuentran los argumentos de las compañías farmacéuticas y de instituciones afines a la defensa del sistema de patentes internacional, basado en el acuerdo general sobre aranceles aduaneros y de comercio, conocido por la siglas en inglés GATT (General Agreement on Trade and Tariffs), y las ADPIC de la Organización Mundial de Comercio. La principal justificación referida en las publicaciones es la gran inversión que implica la comercialización de nuevos medicamentos debido a la investigación biomédica de alto riesgo, como soporte a la importancia del cumplimiento de las normas internacionales de protección de la propiedad intelectual, defendiendo la economía de mercado y argumentando que la mayoría de los avances farmacológicos no habrían sido posibles sin el apoyo de las compañías farmacéuticas21,22. Sin embargo, estos argumentos no convierten a las compañías farmacéuticas en inmunes a las críticas, incluyendo el denominado evergreening, término usado para describir la práctica de extender la vida de una invención mediante una nueva patente que incluye pequeñas alteraciones sobre el compuesto protegido por la patente original. Además, en los últimos años se han producido acontecimientos desafortunados relacionados con el uso de medicamentos, y también se ha criticado la baja inversión de las empresas farmacéuticas en las enfermedades huérfanas. En su defensa, las compañías presentan sus campañas solidarias y de apoyo a organizaciones sin ánimo de lucro, mediante las cuales se promueven programas de disponibilidad de fármacos con el fin de mejorar la salud en las poblaciones más necesitadas. Una de estas campañas, promovida por Novartis, permitió el acceso gratuito al mesilato de imatinib a más de 15.000 pacientes en la India23.
En realidad, el conflicto de las patentes no ha hecho más que precipitar el debate público en torno a la actividad de la industria farmacéutica. Por todo ello, y por el trasfondo solidario de los argumentos del gobierno indio, una parte importante de la opinión pública y algunas organizaciones no gubernamentales se han manifestado en contra de ellas y ha celebrado el rechazo de la patente de Glivec®15. Éste es el primer caso en que un conflicto local sobre patentes de medicamentos ha tenido una repercusión global, con un posible impacto en el descrédito de un sector industrial. Justificado o no, está en sus manos revertir esta situación adversa24.
No debe olvidarse que el limitado acceso a los medicamentos en el Tercer Mundo ha constituido y constituye uno de los principales problemas de salud pública14. Durante los últimos años, las normas de propiedad intelectual han causado serios problemas en los países en vías de desarrollo, y su incumplimiento ha generado juicios y sanciones entre multinacionales farmacéuticas, empresas de genéricos y los propios gobiernos de estos países25. Como ya se ha comentado, todos los agentes implicados esgrimen y defienden sus razones y críticas al sistema, que obedecen a posiciones e intereses contrapuestos. Es por ello que resulta difícil encontrar un equilibrio entre protección intelectual y accesibilidad de los medicamentos. Sin embargo, la protección intelectual de los nuevos medicamentos no debería estar reñida con la defensa de la salud pública, más aún si cabe cuando implica a países del Tercer Mundo. Se han publicado recomendaciones y propuestas diversas orientadas a aproximar ambas posiciones25. Entre ellas, se sugiere establecer políticas de soporte a las enfermedades huérfanas que favorezcan la colaboración entre instituciones públicas y privadas, con el fin de obtener nuevos y más eficaces medicamentos; se ha reclamado una mayor implicación de instituciones internacionales, como la Organización Mundial de la Salud, para mejorar la salud pública mundial preservando los problemas de la propiedad intelectual26; se ha solicitado que se identifiquen y traten adecuadamente las múltiples barreras en salud, además de la propiedad intelectual, a fin de favorecer el progreso de la salud mundial27, y se han reclamado prioridades para la planificación de la salud, los programas de salud pública, la investigación y el desarrollo de medicamentos, y la formación profesional en función de las previsiones en salud realizadas por instituciones de reconocido prestigio28. Finalmente, también se ha propuesto que si los gobiernos destinasen más recursos a la evaluación de las patentes de los medicamentos podría agilizarse considerablemente el proceso a favor de la innovación farmacéutica29.
Si el sistema de patentes se justifica por el impulso de la innovación, también podría haber otras alternativas posibles que favoreciesen el adecuado acceso a los medicamentos y el fomento más equitativo de la salud pública. Se ha sugerido la adquisición de patentes mediante subasta por parte de los países pobres, el fortalecimiento del gasto en salud pública en los países más afectados por los problemas de acceso, el estímulo tanto público como privado a la demanda solvente que haga atractiva la inversión en investigación para determinadas enfermedades relevantes para la salud pública mundial, la discriminación de precios en función de los países con segregación de mercado y, finalmente, que los propietarios de patentes útiles en enfermedades globales puedan elegir entre protección en países ricos o protección en países pobres, pero no ambas30.
A modo de conclusión, el caso Glivec® ha servido para aflorar el debate sobre la adecuación de las normas internacionales y su adaptación en cada país. Los datos presentados podrán servir para debatir objetivamente el sistema de patentes y su posible trascendencia tanto en la salud de la población más necesitada como en la innovación. Para ello es importante tener en cuenta los diferentes puntos de vista de los agentes implicados y estudiar vías de diálogo para poder garantizar el acceso a los medicamentos sin comprometer la innovación farmacéutica y la defensa de la salud pública. Está claro que queda mucho por hacer y que se requieren cambios más profundos en las reglas del juego con el fin de mejorar la salud en el Tercer Mundo.
El debate sobre las patentes de los compuestos farmacéuticos se ha reactivado a raíz del rechazo, por parte de las autoridades indias, de la patente del antineoplásico imatinib, lo que se ha conocido como «el caso Glivec®». Si bien se han publicado artículos de opinión y noticias en prensa al respecto, no se dispone de una revisión exhaustiva que presente la realidad de los hechos acontecidos.
¿Qué añade el estudio realizado a la literatura?Se describen cronológicamente y de forma sistematizada los principales hechos acontecidos en torno al caso Glivec® entre la compañía farmacéutica y el gobierno indio. Se discuten las diferentes opiniones e implicaciones del sistema de patentes, y su impacto en la innovación y el acceso a los medicamentos, tras años de enfrentamientos por este caso, así como las principales repercusiones en salud pública.
Carlos Álvarez-Dardet.
Contribuciones de autoríaI. Moital ha contribuido en la definición de la metodología del trabajo, la recogida, el análisis y la interpretación de los resultados, así como en la redacción del artículo y la aprobación final de la versión para sumisión. F. Bosch ha contribuido en la concepción del estudio, la definición de la metodología de trabajo, la interpretación de los resultados, la redacción del artículo y la aprobación final de la versión para sumisión. M. Farré ha contribuido en la definición de la metodología de trabajo, la revisión crítica del artículo y la aprobación final de la versión para sumisión. M. Maddaleno ha contribuido en la concepción del estudio, la recogida y el análisis de la información, la revisión crítica del artículo y la aprobación final de la versión para sumisión. J.E. Baños ha contribuido en la definición de la metodología del trabajo y la interpretación de los resultados, la redacción del artículo y la aprobación final de la versión para sumisión.
FinanciaciónNinguna.
Conflictos de interesesI. Moital colabora con Novartis Farma Portugal desde agosto de 2012 en el área de diabetes. Este artículo constituye una parte de su trabajo de investigación dentro del doctorado de farmacología. Los restantes autores no tienen conflictos de intereses.
Los autores agradecen la revisión final del texto y las sugerencias aportadas por Nicolás-Vincent Ruiz.