El objetivo de este estudio es evaluar la asociación entre antecedentes familiares (AF) de primer grado y cáncer colorrectal (CCR).
MétodoSe incluyeron 2857 controles y 1360 casos de CCR, del estudio MCC-Spain. La odds ratio (OR) y el intervalo de confianza del 95% (IC95%) de los AF de primer grado y el CCR se estimaron mediante regresión logística no condicional según la localización tumoral en los casos.
ResultadosLos AF de primer grado duplicaron el riesgo de CCR (OR: 2,19; IC95%: 1,80-2,66), incrementándose en aquellos que presentaban dos o más (OR: 4,22; IC95%: 2,29-7,78) y en aquellos cuyos familiares fueron diagnosticados antes de los 50 años (OR: 3,24; IC95%: 1,52-6,91). Presentar AF se relacionó con estilos de vida como un menor consumo de vegetales. En cuanto a la asociación de los AF con la localización no se observaron diferencias significativas entre colon y recto, pero sí en la relación de estas con la edad de diagnóstico, presentando más AF los diagnosticados antes de los 50 años (OR: 4,79; IC95%: 2,65-8,65).
ConclusionesPresentar AF de primer grado de CCR aumenta las probabilidades de desarrollar este cáncer, y también se elevan cuando el familiar es diagnosticado a edad temprana. Por ello, debe ser una población diana sobre la que incrementar las medidas de prevención.
To evaluate the association between first-degree family history and colorectal cancer (CRC).
MethodWe analyzed data from 2857 controls and 1360 CRC cases, collected in the MCC-Spain project. The adjusted odds ratio (OR) and 95% confidence interval (95% CI) of association with the family history of CRC was estimated by non-conditional logistic regression.
ResultsFirst-degree relatives doubled the risk of CRC (OR: 2.19; 95% CI: 1.80–2.66), increasing in those with two or more (OR: 4.22; 95% CI: 2.29–7.78) and in those whose relatives were diagnosed before 50 years (OR: 3.24; 95% CI: 1.52–6.91). Regarding the association of the family history with the location, no significant differences were observed between colon and rectum, but there were in the relation of these with the age of diagnosis, having more relatives those diagnosed before 50 years (OR: 4.79; 95% CI: 2.65–8.65).
ConclusionsFirst-degree relatives of CRC increase the chances of developing this tumor, they also increase when the relative is diagnosed at an early age. Therefore, it must be a target population on which to carry out prevention measures.
El cáncer colorrectal (CCR) es el tercer cáncer más común en todo el mundo, con las tasas más altas en las regiones desarrolladas, y el segundo en cuanto a mortalidad1. En España, en 2018, el CCR se mantuvo como el primer tipo de tumor diagnosticado, con 37.000 casos nuevos y 16.600 muertes estimadas2, y una tendencia ascendente3.
El desarrollo de CCR es un proceso multifactorial, que incluye factores genéticos y ambientales, así como la interacción de ambos4, y multietápico, en el cual se van acumulando mutaciones que pueden dar lugar al tumor. Los estilos de vida como el consumo de alcohol y de carnes procesadas o la inactividad física son algunos factores de riesgo para su desarrollo con fuerte evidencia, así como la grasa corporal y una mayor altura alcanzada en la edad adulta1.
Los antecedentes familiares (AF) de CCR son otro factor de riesgo conocido e incluyen tanto el riesgo genético como el riesgo ambiental compartido. Una familia es semejante en cuanto a riesgo de enfermedad debido a factores biológicos, culturales y de comportamiento compartidos5, y se sabe que en torno a un 20% de los casos de CCR se producen en personas con AF de CCR, cuando se excluyen los síndromes hereditarios6.
En la revisión llevada a cabo se han encontrado diversos estudios epidemiológicos y revisiones7–9 en los que se ha analizado la historia familiar en relación con el riesgo de CCR. Un metaanálisis10 concluyó que el riesgo de desarrollar CCR y síndromes hereditarios era mayor en las personas con AF, y que aumentaba con el número de AF y una edad temprana de diagnóstico del familiar. También se ha estudiado la asociación entre los estilos de vida y el CCR11 y sus diferentes localizaciones12,13. Sin embargo, pocos estudios relacionan los AF de CCR con los estilos de vida, contribuyendo a través del ambiente compartido14 o relacionando los AF con las diversas localizaciones del tumor7,15.
El objetivo de este estudio es evaluar la asociación entre los AF de primer grado de CCR y el desarrollo de CCR, según el número de familiares afectados, la edad de diagnóstico y la localización del tumor, así como relacionar los estilos de vida y la presencia o no de AF.
MétodoLas personas participantes forman parte del estudio MCC-Spain16,17, un estudio observacional, multicéntrico, multicaso-control, realizado entre 2008 y 2013 en 23 hospitales de 12 provincias españolas, cuyo objetivo fue evaluar exposiciones ambientales y su interacción con factores genéticos para varios tumores, entre ellos el CCR.
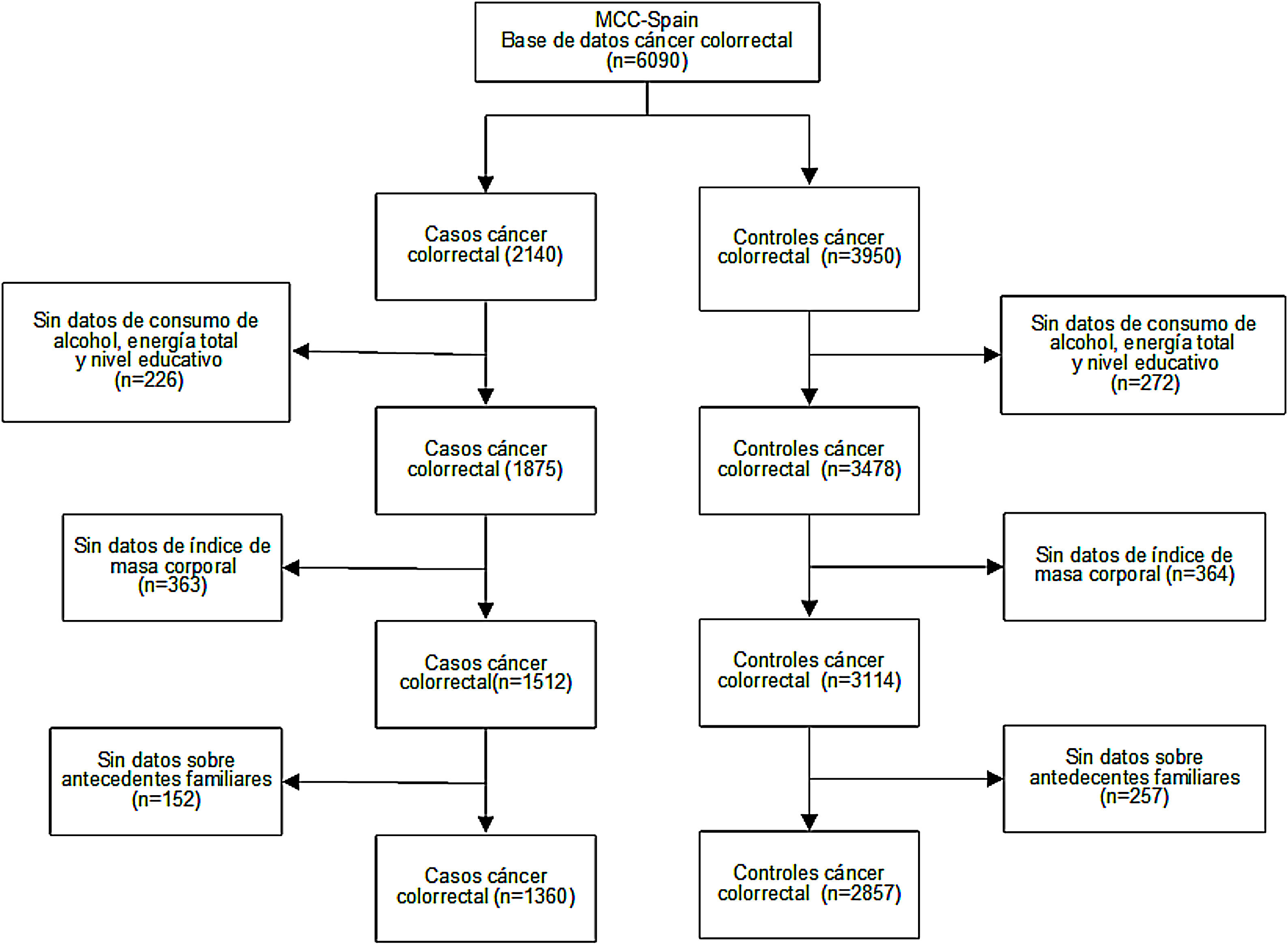
Población de estudioTodas las personas participantes tenían entre 20 y 85 años, residían en el área del hospital de reclutamiento de los casos como mínimo desde 6 meses antes de la entrevista y no tenían impedimentos físicos ni de comunicación para responder a los cuestionarios. Los casos de CCR fueron incidentes, con diagnóstico confirmado histológicamente (CIE-10: C18, C19, C20, D01.0, D01.1, D01.2). Para su captación, el personal del estudio contactó con ellos/ellas en los hospitales seleccionados. La tasa de participación de los casos fue del 68%. Para los controles, la media fue del 53% y varió según la región. Los controles fueron seleccionados aleatoriamente de las listas poblacionales asignadas a médicos de familia del área de los hospitales donde se reclutaron los casos, y con la misma distribución de sexo y edad (± 5 años). Para este análisis, tras eliminar aquellos/as participantes de quienes no se tenían datos sobre las variables de interés, se incluyeron 1360 casos de CCR y 2857 controles (fig. 1).
Recogida de informaciónLa información epidemiológica se obtuvo mediante entrevista personal y la información sobre la dieta con un cuestionario de frecuencia de alimentos autocompletado; ambas se almacenaron electrónicamente en un cuestionario informatizado. De los datos disponibles se consideraron las siguientes variables:
- •
Información sobre la dieta: consumo de alcohol, de carnes rojas y procesadas, vegetales y energía total.
- •
Datos sociodemográficos: sexo, edad, nivel educativo (estudios inferiores a primarios, primarios, secundarios y universitarios) y área de residencia (León, Barcelona, Madrid, zona norte que comprende Asturias, Cantabria, Guipúzcoa y Navarra, y zona sur que incluye Granada, Huelva, Murcia y Valencia).
- •
Datos antropométricos: peso, altura e índice de masa corporal (IMC).
- •
Exposiciones medioambientales y estilos de vida: consumo de alcohol (basado en el consumo pasado entre los 30-40 años y categorizado como «no consumo/consumo moderado» menos de 12g/día o «abuso»>12g/día).
- •
Actividad física, teniendo en cuenta los últimos 10 años e incluyendo actividad física recreativa, evaluada con MET, unidad de medida del metabolismo, categorizada como sedentarismo si ≤8 MET/h a la semana o no sedentarismo si >8 MET/h a la semana.
La historia familiar de CCR incluyó padre, madre, hermano/a o hijo/a afectado/a. También se disponía de información de la edad en el momento del diagnóstico del familiar afectado. La localización del tumor se definió de acuerdo con su distribución anatómica: colon proximal (encima del nivel de la flexura esplénica o su inclusión), distal (descendente y sigmoide) y recto; había casos sin localización. Con el cuestionario de frecuencia de alimentos se evaluó la ingesta dietética durante el año anterior al reclutamiento, recogiendo información, entre otra, sobre consumo de vegetales (g/día), carnes rojas y procesadas (g/día), y energía consumida (kcal/día).
Análisis estadísticoPara caracterizar las variables cuantitativas se utilizaron medidas de centralización (media) y dispersión (desviación estándar), y para las cualitativas, frecuencias absolutas y relativas. Para el análisis univariante se utilizó la prueba de ji al cuadrado en el caso de las variables cualitativas, y para las cuantitativas, en función de la normalidad o no de su distribución, se realizaron las pruebas de ANOVA y Kruskal-Wallis, respectivamente. Las odds ratios (OR) de la exposición y sus intervalos de confianza del 95% (IC95%) se estimaron mediante modelos mixtos de regresión logística no condicional. Se utilizaron dos modelos: el básico (ORc), que incluye el sexo, la edad y el nivel educativo como variables de efectos fijos y el área de residencia como variable de efecto aleatorio, y el ajustado (ORa), que incluye, además de las variables del modelo básico, el IMC (<25: bajo peso o normopeso; 25-29: sobrepeso; ≥30: obesidad), el sedentarismo (sí/no), el consumo de alcohol (no o moderado/abuso), el consumo de carnes rojas y procesadas (g/día), el consumo de vegetales (g/día) y la energía consumida (kcal/día). Todos los análisis se realizaron con el software estadístico Stata v.15.118.
ÉticaEl protocolo de MCC-Spain fue aprobado por los comités de ética de las instituciones participantes, y la participación fue voluntaria, previa firma del consentimiento informado. Se garantizó la confidencialidad cumpliendo la Ley Orgánica 3/2018, de 5 de diciembre, de Protección de datos personales y garantía de los derechos digitales, y fueron dados de alta en la Agencia de Protección de Datos (Número 2102672171). Se encuentran más detalles sobre la organización del proyecto en http://www.mccspain.org.
ResultadosLas características de los casos y de los controles se muestran en la tabla 1. En los casos, la proporción de hombres fue mayor, presentaron una media de edad y un IMC más altos, eran más sedentarios y consumían más alcohol, con un mayor porcentaje de AF de primer grado y un nivel de estudios más bajo que los controles. Además, los casos presentaban un consumo medio menor de vegetales y mayor de carnes rojas y procesadas, y de energía. Las diferencias entre ellos fueron significativas (p <0,000).
Características de los casos y de los controles
| Variables | Controles | Casos | p | ||
|---|---|---|---|---|---|
| n | % | n | % | ||
| Sexo | |||||
| Mujer | 1345 | 47,08 | 466 | 34,26 | <0,000 |
| Hombre | 1512 | 52,92 | 894 | 47,08 | |
| Edad | |||||
| (media±DE) | 63,02 | 11,40 | 66,68 | 10,57 | <0,000 |
| Nivel educativo (estudios) | |||||
| Menos que primarios | 448 | 15,68 | 392 | 28,82 | <0,000 |
| Primarios | 927 | 32,45 | 523 | 38,46 | |
| Secundarios | 851 | 29,79 | 292 | 21,47 | |
| Universitarios | 631 | 22,09 | 153 | 11,25 | |
| Área de residencia | |||||
| León | 365 | 12,78 | 304 | 22,35 | <0,000 |
| Barcelona | 654 | 22,89 | 299 | 21,99 | |
| Madrid | 556 | 19,46 | 164 | 12,06 | |
| Zona Nortea | 346 | 12,11 | 230 | 16,91 | |
| Zona Surb | 936 | 32,76 | 363 | 26,69 | |
| IMC | |||||
| <25 | 1125 | 39,38 | 401 | 29,49 | <0,000 |
| 25-30 | 1162 | 40,67 | 604 | 44,41 | |
| ≥30 | 570 | 19,95 | 355 | 26,10 | |
| Sedentario | |||||
| Sí | 1027 | 35,95 | 600 | 44,12 | <0,000 |
| No | 1830 | 64,05 | 760 | 55,88 | |
| Consumo de alcohol | |||||
| No/moderado | 1739 | 60,87 | 665 | 48,90 | <0,000 |
| Abuso | 1118 | 39,13 | 695 | 51,10 | |
| AF primer grado | |||||
| No | 2582 | 90,37 | 1.108 | 81,47 | <0,000 |
| Sí | 275 | 9,63 | 252 | 18,53 | |
| Vegetales (g/día) (media±DE) | 189,63 | 122,75 | 172,16 | 111,37 | <0,000 |
| Carnes rojas y procesadas (g/día) (media±DE) | 62,91 | 39,76 | 74,08 | 49,54 | <0,000 |
| Energía (kcal/día) (media±DE) | 1913,07 | 644,80 | 2029,48 | 723,11 | <0,000 |
AF: antecedentes familiares; DE: desviación estándar; IMC: índice de masa corporal.
Se analizaron los factores de riesgo según la existencia o no de AF de primer grado para los controles (tabla 2). En el análisis ajustado, la edad y el consumo de carnes rojas y procesadas se asociaron con presentar AF, de manera que, a medida que aumentaba la edad, se elevaba la probabilidad de presentar algún AF de primer grado afectado, un 1% por año cumplido (ORa: 1,01; IC95%:1,00-1,02). Además, aquellos con algún AF de primer grado presentaron un menor consumo de vegetales (ORa: 0,89; IC95%: 0,81-0,89).
Características de los controles con y sin antecedentes familiares de primer grado
| Controles | |||||||
|---|---|---|---|---|---|---|---|
| AF primer grado | |||||||
| Variables | No | Sí | ORaa | p | |||
| n | % | n | % | OR | IC95% | ||
| Sexo | |||||||
| Mujer | 1215 | 47,06 | 130 | 47,27 | 1 | Ref. | 0,412 |
| Hombre | 1.367 | 52,94 | 145 | 52,73 | 1,10 | 0,87-1,40 | |
| Nivel educativo (estudios) | |||||||
| Menos que primarios | 407 | 15,76 | 41 | 14,91 | 1 | Ref. | 0,661 |
| Primarios | 850 | 32,92 | 77 | 28,00 | 1,06 | 0,81-1,39 | |
| Secundarios | 760 | 29,43 | 91 | 33,09 | 1,12 | 0,84-1,50 | 0,441 |
| Universitarios | 565 | 21,88 | 66 | 24,00 | 1,12 | 0,81-1,55 | 0,485 |
| IMC | |||||||
| <25 | 1017 | 39,39 | 108 | 39,27 | 1 | Ref. | 0,756 |
| 25-29 | 1057 | 40,94 | 105 | 38,18 | 1,04 | 0,83-1,29 | |
| ≥30 | 508 | 19,67 | 62 | 22,55 | 1,22 | 0,94-1,56 | 0,130 |
| Sedentario | |||||||
| Sí | 940 | 36,41 | 87 | 31,64 | 1 | Ref. | 0,687 |
| No | 1642 | 63,59 | 188 | 68,36 | 1,04 | 0,86-1,26 | |
| Consumo de alcohol | |||||||
| No/moderado | 1567 | 60,69 | 172 | 62,55 | 1 | Ref. | 0,992 |
| Abuso | 1015 | 39,31 | 103 | 37,45 | 1,00 | 0,80-1,25 | |
| Edad (media±DE) | 62,91 | 11,51 | 64,03 | 10,20 | 1,01 | 1,00-1,02 | 0,090 |
| Vegetales (100 g/día) (media±DE) | 1,91 | 1,25 | 1,8 | 0,98 | 0,89 | 0,81-0,97 | 0,011 |
| Carnes rojas y procesadas (100 g/día) (media±DE) | 0,63 | 0,39 | 0,65 | 0,43 | 1,10 | 0,86-1,41 | 0,437 |
| Energía (1000 kcal/día) (media±DE) | 1,92 | 0,65 | 1,87 | 0,58 | 1,11 | 0,94-1,30 | 0,220 |
AF: antecedentes familiares; DE: desviación estándar; IC95%: intervalo de confianza del 95%; IMC: índice de masa corporal; ORa: odds ratio ajustada; ORc: odds ratio cruda.
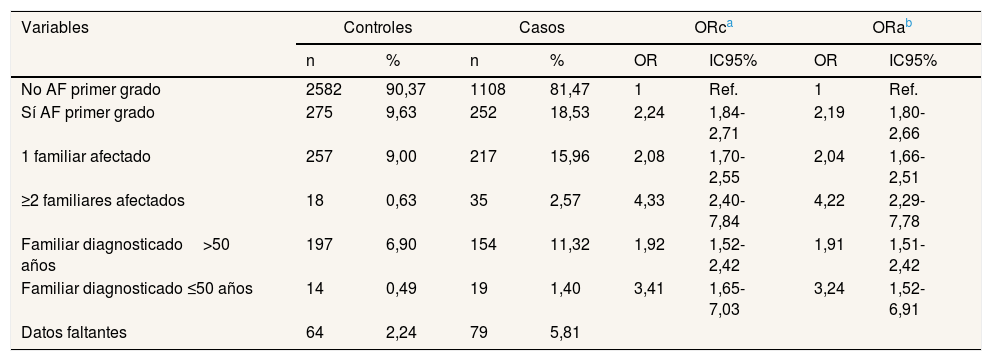
En la tabla 3 se observa que la prevalencia de AF de primer grado entre los casos fue superior que entre los controles (18,53 vs. 9,63%). En comparación con las personas que no tenían AF, presentarlos dobló la probabilidad de desarrollar CCR (ORa: 2,19; IC95%: 1,80-2,66), con dos o más AF de primer grado se incrementó hasta 4 veces (ORa: 4,22; IC95%: 2,29-7,78) y con un familiar diagnosticado antes de los 50 años hubo tres veces más probabilidades (ORa: 3,24; IC95%: 1,52-6,91).
Antecedentes familiares de primer grado en casos y controles
| Variables | Controles | Casos | ORca | ORab | ||||
|---|---|---|---|---|---|---|---|---|
| n | % | n | % | OR | IC95% | OR | IC95% | |
| No AF primer grado | 2582 | 90,37 | 1108 | 81,47 | 1 | Ref. | 1 | Ref. |
| Sí AF primer grado | 275 | 9,63 | 252 | 18,53 | 2,24 | 1,84-2,71 | 2,19 | 1,80-2,66 |
| 1 familiar afectado | 257 | 9,00 | 217 | 15,96 | 2,08 | 1,70-2,55 | 2,04 | 1,66-2,51 |
| ≥2 familiares afectados | 18 | 0,63 | 35 | 2,57 | 4,33 | 2,40-7,84 | 4,22 | 2,29-7,78 |
| Familiar diagnosticado>50 años | 197 | 6,90 | 154 | 11,32 | 1,92 | 1,52-2,42 | 1,91 | 1,51-2,42 |
| Familiar diagnosticado ≤50 años | 14 | 0,49 | 19 | 1,40 | 3,41 | 1,65-7,03 | 3,24 | 1,52-6,91 |
| Datos faltantes | 64 | 2,24 | 79 | 5,81 | ||||
AF: antecedentes familiares; IC95%: intervalo de confianza del 95%; OR: odds ratio; ORa: OR ajustada; ORc: OR cruda.
En la tabla 4 se relacionan los AF con la localización anatómica del tumor y con la edad en el momento del diagnóstico de los casos. La prevalencia de AF de primer grado en los diagnosticados de cáncer de colon y recto fue similar (18,24 vs. 19,13%). La influencia de los AF de primer grado en el tipo de CCR osciló entre una ORa de 1,82 (IC95%: 1,33-2,50) para colon proximal y una ORa de 2,42 (IC95%: 1,83-3,20) para colon distal (diferencias no significativas). En cuanto a la edad a la que se diagnosticó el tumor, los menores de 50 años presentaron hasta cuatro veces más probabilidades de tener AF que los controles (ORa: 4,79; IC95%: 2,65-8,65).
Antecedentes familiares de primer grado, localización tumoral y edad
| No AF primer grado | Sí AF primer grado | ORaa | ||||
|---|---|---|---|---|---|---|
| n | % | n | % | OR | IC95% | |
| Controles | 2582 | 90,37 | 275 | 9,63 | 1 | Ref. |
| Localizaciónb | ||||||
| Colon | 668 | 81,76 | 149 | 18,24 | 2,14 | 1,70-2,69 |
| Proximal | 324 | 83,94 | 62 | 16,06 | 1,82 | 1,33-2,50 |
| Distal | 344 | 79,81 | 87 | 20,19 | 2,42 | 1,83-3,20 |
| Recto | 427 | 80,87 | 101 | 19,13 | 2,29 | 1,76-2,99 |
| Edad de los casos | ||||||
| >50 años | 1,030 | 81,81 | 229 | 18,19 | 2,13 | 1,73-2,61 |
| ≤50 años | 78 | 77,23 | 23 | 22,77 | 4,79 | 2,65-8,65 |
AF: antecedentes familiares; IC95%: intervalo de confianza del 95%; OR: odds ratio; ORa: OR ajustada.
En este estudio, basado en población española, se refuerza la hipótesis de que los AF de primer grado de CCR son un importante factor de riesgo para el desarrollo de este cáncer. Los AF de CCR incrementaron hasta dos veces la probabilidad de presentarlo y hasta cuatro veces cuando se tenían dos o más familiares afectados. En cuanto a la edad del diagnóstico, la probabilidad de presentar CCR fue mayor cuando el AF fue diagnosticado antes de los 50 años. Además, cuando existían AF también se halló una mayor probabilidad de desarrollar este tumor antes de los 50 años. Al relacionar los AF con la localización del tumor no se encontraron diferencias significativas.
Los resultados obtenidos concuerdan con los informados en estudios previos, en los cuales los AF de primer grado se asociaron con un incremento de la probabilidad de desarrollo de CCR entre 1,41 y 2,817,8,19–23. Del mismo modo, el riesgo se incrementó con el aumento del número de familiares de primer grado afectados, con riesgos similares a los encontrados en el presente estudio: entre 1,41 y 2,25 en caso de un solo familiar20–23 y entre 3,95 y 4,25 en caso de dos o más familiares afectados20–23.
La razón de que los AF influyan en el desarrollo de CCR y de que el riesgo se incremente al aumentar el número de familiares afectados es, por un lado, la herencia debida a mutaciones en líneas germinales, que van a dar lugar a los diversos síndromes, pero estos solo representan una pequeña proporción del total (5-13%). Por otro lado, la agrupación familiar representa un 25-30% de los casos cuando se omiten los síndromes genéticos24, por lo que otros genes de baja penetrancia junto con el ambiente compartido en familia van a influir de manera importante.
El presente estudio halló una mayor probabilidad de desarrollar CCR cuando había un AF diagnosticado antes de los 50 años. Otros estudios indican riesgos muy similares en las personas con AF diagnosticadas antes de los 50 años (3,32-3,55)22, y de 2,18 si el AF fue diagnosticado con 50 o más años22. La explicación a este hallazgo sería que cabe esperar una mayor carga genética en aquellas personas diagnosticadas antes de los 50 años, mientras que en edades más avanzadas, al estar expuestos durante más tiempo a factores de riesgo, influirán más las mutaciones adquiridas.
Las causas de desarrollo de CCR se pueden desdoblar en la herencia genética, el ambiente único de cada individuo y el mencionado ambiente compartido en familia. En el presente estudio se encontraron diferencias entre los factores de riesgo de los controles que tenían o no AF de primer grado. En ciertos aspectos, como el consumo de vegetales, existía una influencia de este ambiente compartido. En un estudio realizado en gemelos25 se atribuyó al ambiente compartido un 16% para el cáncer de colon y un 10% para el de recto. En otro estudio realizado con familias adoptivas26, en las que la persona adoptada procedente de una familia biológica afectada se vería influida por la herencia biológica o genética, y la persona adoptada con familia adoptiva afectada se vería influida por la herencia ambiental, se encontró que en el primer supuesto existía mayor probabilidad de desarrollo de la enfermedad, mientras que en el segundo aumentaba el riesgo, pero no de manera significativa. Ibañez-Sanz et al.14 afirman que los AF son el factor de riesgo más fuerte para el desarrollo de CCR y que se asocia sobre todo a la genética, pero también la historia familiar podría contribuir debido al ambiente familiar compartido. No obstante, que el CCR sea un proceso multifactorial hace que estos tres aspectos no puedan considerase por separado, ya que es bien conocido que existen interacciones del ambiente y la genética27,28, de manera que, hipotéticamente, si intervenimos en uno de ellos conseguiremos modificaciones en el otro. Cho et al.26 sugieren que el riesgo genético puede ser atenuado por unos estilos de vida saludables. Además, en un gran estudio de casos y controles11 se identificó que una combinación de estilos de vida saludables (no fumar, consumo de alcohol recomendado, dieta saludable, práctica de actividad física recomendada y peso saludable o normopeso) parece reducir el riesgo de CCR independientemente del perfil genético del paciente.
Si bien en el presente trabajo no se hallaron diferencias significativas en cuanto a la localización del CCR, algunos autores indican que los AF tienen un mayor impacto en los tumores proximales29 y otros afirman que son más probables en el colon que en el recto15, en concreto en el colon distal7. Se cree que estos últimos son más inestables y pueden surgir por los mismos mecanismos que el CCR asociado a poliposis, mientras que los proximales representan una forma genéticamente más estable y pueden desarrollarse por los mismos mecanismos que el CCR hereditario no asociado a poliposis30,31. Un estudio12 relacionó la localización del tumor con diversas exposiciones ambientales, y encontró que las relaciones del CCR con la actividad física, las medidas antropométricas y el consumo de tabaco diferían según la región anatómica donde se desarrollaba el tumor. A pesar de que no analiza la historia familiar de CCR, apoya la hipótesis de que los tumores en diferentes regiones anatómicas pueden tener etiologías distintas, además de evidenciar una vez más la importancia de los factores ambientales en el desarrollo de CCR.
Por lo tanto, los factores ambientales en interacción con la genética tienen un papel relevante en el desarrollo de CCR. Dichos factores son potencialmente modificables y, por lo tanto, en aquellas personas con AF es posible llevar a cabo acciones encaminadas a disminuir el riesgo de desarrollo de este tumor. Las creencias y los comportamientos personales son un aspecto difícil de modificar; sin embargo, en diversas patologías se ha encontrado como factor motivacional para el cambio la percepción del riesgo de enfermedad. Esta percepción del riesgo es mayor en las personas que presentan AF, y a medida que se incrementa la percepción del riesgo aumenta la motivación para modificar los estilos de vida32,33. Por tanto, esto puede usarse como una herramienta de prevención personalizada (tanto para la modificación de hábitos como para la participación en cribados), lo cual está demostrado que tiene más efectividad que los mensajes generalizados34.
En el presente estudio solo se han analizado los AF de primer grado, pero estudios previos analizaron los AF de segundo y hasta tercer grado. Presentar AF de primer grado influye mucho más en el riesgo de CCR, e incluso, cuando se combinan, puede aumentar significativamente el riesgo15. Debido a que los AF de segundo o tercer grado se recuerdan peor que los de primer grado, solo se han analizado estos últimos, ya que podría suponer una limitación, pues se trata de un dato autorreportado.
Aparte de las limitaciones propias de los estudios de casos y controles35, deben considerarse otras limitaciones. Por un lado, los datos sobre alimentación se recogieron con un cuestionario y podrían estar sujetos a errores de medición, pero se utilizó el cuestionario de frecuencia de alimentos previamente validado para población española y los datos agregados de grupos de alimentos se corrigieron mediante preguntas cruzadas. El uso de datos autorreportados para variables como el IMC y la actividad física (1 o 2 años antes de la entrevista) también podría llevar a un sesgo de recuerdo, pero si existiera probablemente sería no diferencial, lo que implicaría una subestimación de los efectos estudiados. Para evitar el posible sesgo de selección de casos, se pretendió reclutar todos los casos con un primer diagnóstico de cáncer, asegurando pocos casos perdidos. Existe un sesgo de participación en los controles con mayor nivel educativo y también es posible que los controles con más AF de cáncer (no específicamente CCR) aceptaran participar en mayor medida, pero si así fuera solo infraestimaría las asociaciones. Finalmente, en los análisis se realizaron ajustes para las variables mencionadas con el fin de conseguir reducir ese factor de confusión.
En cuanto a los puntos fuertes del estudio, cabe mencionar el tamaño muestral, que los casos de CCR analizados son incidentes y que su diagnóstico fue confirmado histológicamente, proporcionando información específica sobre el subtipo de tumor. Esto permitió detectar asociaciones entre el subtipo de tumor y los AF. En cuanto a la selección de los controles, hacerlo a partir de las listas de médicos generales proporcionó una muestra de base poblacional, dada la cobertura pública universal del Sistema Nacional de Salud en España, lo cual es otra de las fortalezas del estudio.
También es una fortaleza que se trata de un estudio multicéntrico, realizado en numerosas regiones de España, incluyendo zonas urbanas y rurales, con una amplia variabilidad geográfica de los datos, especialmente de aquellos relativos a ingestas dietéticas.
ConclusionesLas personas con AF de primer grado presentan mayor riesgo de desarrollar CCR que aquellas sin AF, y este riesgo se incrementa a medida que aumenta el número de familiares de primer grado afectados y cuando estos fueron diagnosticados antes de los 50 años.
La historia familiar influye en el riesgo de cáncer colorrectal debido, por un lado, a mutaciones germinales (5-13%), pero cuando estas son omitidas, la agrupación familiar supone un 25-30% de los casos, y por tanto el ambiente compartido va a influir más que la herencia genética.
¿Qué añade el estudio realizado a la literatura?La herencia es un factor de riesgo para el cáncer colorrectal, englobando la genética y el ambiente, y se destaca la importancia de la influencia del ambiente compartido en familia en su desarrollo.
¿Cuáles son las implicaciones de los resultados obtenidos?En materia de prevención, la modificación de ciertos hábitos de vida en personas con antecedentes familiares puede ser una medida útil para disminuir el riesgo de desarrollar cáncer colorrectal.
Clara Bermúdez-Tamayo.
Declaración de transparenciaLa autora principal (garante responsable del manuscrito) afirma que este manuscrito es un reporte honesto, preciso y transparente del estudio que se remite a Gaceta Sanitaria, que no se han omitido aspectos importantes del estudio, y que las discrepancias del estudio según lo previsto (y, si son relevantes, registradas) se han explicado.
Contribuciones de autoríaConceptualización: M. Rubín-García, V. Martín y T. Fernández-Villa. Metodología: M. Rubín-García, V. Martín y Y. Benavente. Análisis formal: M. Rubín-García y V. Martín. Redacción y preparación del borrador: M. Rubín-García, V. Martín, F. Vitelli-Storelli, L. Álvarez-Álvarez, T. Fernández-Villa y Y. Benavente. Revisión y edición: M. Rubín-García, V. Martín, F. Vitelli-Storelli, V. Moreno, N. Aragonés, E. Adarnaz, J. Alonso-Molero, J.J. Jiménez-Moleón, P. Amiano, G. Fernández-Tardón, A. Molina-Barceló, J. Alguacil, M. Dolores-Chirlaque, L. Álvarez-Álvarez, B. Pérez-Gómez, T. Dierssen-Sotos, R. Olmedo-Requena, M. Guevara, T. Fernández-Villa, M. Pollán y Y. Benavente. Supervisión: V. Martín y T. Fernández-Villa. Administración del proyecto: N. Aragonés y M. Pollán. Adquisición de financiación: V. Martín, V. Moreno, N. Aragonés, E. Adarnaz, J.J. Jiménez-Moleón, P. Amiano, G. Fernández-Tardón, J. Alguacil, B. Pérez-Gómez, T. Dierssen-Sotos, M. Pollán y Y. Benavente. Todas las personas firmantes han leído y aceptado la versión final del manuscrito.
AgradecimientosA la Dra. Gemma Castaño Vinyals y al Dr. Manolis Kogevinas por su colaboración en el proyecto.
FinanciaciónEl estudio fue parcialmente financiado por la «Acción Transversal del Cáncer», aprobada por el Consejo del Ministerio de España el 11 de octubre de 2007, por el Instituto de Salud Carlos III-FEDER (PI08 / 1770, PI08 / 0533, PI08 / 1359, PS09 / 00773-Cantabria, PS09 / 01286-León, PS09 / 01903-Valencia, PS09 / 02078-Huelva, PS09 / 01662-Granada, PI11 / 01403, PI11 / 01889-FEDER, PI11 / 00226, PI11 / 01810, PI11 / 02213, PI12 / 00488, PI12 / 00265, PI12 / 01270, PI12 / 00715, PI12 / 00150, PI14 / 01219, PI14 / 0613, PI15 / 00069, PI15 / 00914, PI15 / 01032, PI17CIII / 00034), así como a través de CIBERESP CB06/02/0073, cofinanciado por el Fondo Europeo de Desarrollo Regional (FEDER). También cuenta con el apoyo de la Fundación Marqués de Valdecilla (API 10/09), el ICGC International Cancer Genome Consortium CLL (el proyecto ICGC CLL-Genome Project está financiado por el Ministerio de Economía y Competitividad español a través del Instituto de Salud Carlos III y la Red Temática de Investigación del Cáncer del Instituto de Salud Carlos III [RD12 / 0036/0036]), la Junta de Castilla y León (LE22A10-2), la Consejería de Salud de la Junta de Andalucía (PI-0571-2009, PI-0306-2011, salud201200057018tra), la Conselleria de Sanitat de la Generalitat Valenciana (AP_061/10), RecerCaixa (2010ACUP 00310), el Gobierno Regional del País Vasco, la Consejería de Sanidad de la Región de Murcia, la Comisión Europea de subvenciones FOOD-CT-2006-036224-HIWATE, la Fundación Científica de la Asociación Española Contra el Cáncer (AECC), la Generalitat de Catalunya - Agencia de Gestión Universitaria e Investigación Becas (AGAUR) y 2017SGR01085. Becas 2017SGR723 y 2014SGR850 de la Fundación Caja de Ahorros de Asturias y de la Universidad de Oviedo. ISGlobal agradece el apoyo del Ministerio de Ciencia e Innovación de España a través del Programa Centro de Excelencia Severo Ochoa 2019-2023 (CEX2018-000806-S), y el apoyo de la Generalitat de Catalunya a través del Programa CERCA. M. Rubín-García cuenta con el apoyo del Ministerio de Educación de España (FPU17/06488). Fundación Científica de la Asociación Española Contra el Cáncer (AECC), ayuda GCTRA18022MORE.
Conflicto de interesesNinguno.