Evaluar el acceso al mercado de los medicamentos huérfanos en España que a fecha de 31 de diciembre de 2017 tuvieran vigente su designación, y para aquellos comercializados en España estimar los tiempos entre la asignación de código nacional (CN) por parte de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) y la fecha de comercialización efectiva.
MétodoLa base de datos para identificar los medicamentos huérfanos autorizados por la Agencia Europea de Medicamentos (EMA), a fecha 31 de diciembre de 2017 (n = 142), es su Registro Comunitario publicado por la Comisión Europea. La EMA publica los medicamentos huérfanos que han perdido la designación. Las fechas de asignación de CN provienen de la AEMPS, y las de comercialización, de Bot PLUS. Se llevó a cabo un análisis descriptivo de las variables de estudio. Las variables cuantitativas se describieron utilizando la media y mediana, así como la desviación estándar y su rango. Las variables cualitativas se describieron según frecuencias absolutas y relativas. La comparación de resultados se realizó mediante contrastes paramétricos y no paramétricos en función de la aplicabilidad, con un nivel de significación del 5%.
ResultadosEntre 2002 y 2017, la EMA autorizó (con designación vigente a 31 de diciembre de 2017) 100 medicamentos huérfanos. De ellos, 86 tienen CN asignado, y de estos, 54 se han comercializado en España (54% de los medicamentos huérfanos vigentes y 63% de aquellos con CN). Para todos los medicamentos huérfanos con fecha de comercialización (53), el tiempo (mediana) desde la asignación del CN hasta su comercialización en España es de 13,4 meses (desviación estándar: 17,0; mínimo: 2,1; máximo: 91,7). La mediana para los comercializados en 2002-2013 y 2014-2017 es de 12,4 meses y 14,0 meses, respectivamente (p = 0,46). Esta diferencia no es estadísticamente significativa, lo que cabría esperar dado el número limitado de medicamentos huérfanos en nuestra «población».
ConclusiónNumerosos factores determinan el acceso a los medicamentos huérfanos. La autorización centralizada de comercialización en Europa es un éxito; su acceso es más limitado, dadas las complejidades de evaluación de la evidencia disponible en los procesos de financiación y precio. Es necesario implementar nuevas políticas que reduzcan las desigualdades en el acceso y permitan la sostenibilidad del sistema. Para conseguir estos objetivos, podrían contemplar un proceso acelerado en la decisión de financiación y precio, y el pago por resultados con incertidumbre alta.
To assess the access to orphan medicines in Spain, focusing on those with an active “orphan” designation, as of 31st December 2017; and for those orphan medicines in the Spanish market, estimate the time between being assigned a National Code (NC) by the Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) and being approved for launch.
MethodWe used the European Commission's Public Register of orphan medicines to identify the orphan medicines authorised by the European Medicines Agency (EMA), as of 31 December 2017, while we sourced expired orphan indications from the EMA's website. Dates when NCs were assigned were sourced from the AEMPS, and commercialisation dates from Bot PLUS. A descriptive analysis of the study variables was done. The quantitative variables were described using means and medians, as well as standard deviations and ranges. The qualitative variables were described according to absolute and relative frequencies. The comparison of results was performed by parametric and non-parametric contrasts according to the applicability, at a 5% significance level.
ResultsThe EMA has approved 100 orphan medicines (with designation as of 31/12/2017) between 2002-2017. Eighty-six have a NC assigned by the AEMPS. Fifty-four have been launched in Spain (representing 54% of the full sample; 63% with NC). For the 53 orphan drugs with launch date in Spain, the median time between receiving its NC and its launch is 13.4 months (standard deviation: 17.0; minimum: 2.1; maximum: 91,7). The median time is 12.4 months and 14.0 months for those medicines launched in Spain between 2002-2013 and 2014-2017 respectively (p = 0.46). This difference is not statistically significant, which is what could be expected given the low numbers of orphan medicines in the “population”.
ConclusionComplex factors determine the access to orphan drugs in Europe. The centralised procedure to obtain marketing authorisation at European level is a success. However, access is more limited, given the complexities of the evaluation of the available evidence for pricing and reimbursement decisions. It is therefore necessary to implement new policies that reduce inequalities in access and help achieve sustainable healthcare systems. To achieve this, they will need to offer the possibility of allowing earlier access, and using payment by results when there is high uncertainty.
Según la legislación europea1, un medicamento será declarado medicamento huérfano si su promotor puede demostrar que cumple alguno de los siguientes requisitos:
- a)
Se destina al diagnóstico, la prevención o el tratamiento de una afección que ponga en peligro la vida o conlleve una incapacidad crónica y que no afecte a más de cinco personas por cada 10.000 habitantes en la Unión Europea en el momento de presentar la solicitud (las llamadas «enfermedades raras»); oSe destina al diagnóstico, la prevención o el tratamiento, en la comunidad, de una afección que ponga en peligro la vida o conlleve grave incapacidad, o de una afección grave y crónica, y que resulte improbable que, sin incentivos, la comercialización de dicho medicamento en la comunidad genere suficientes beneficios para justificar la inversión necesaria, y
- b)
No existe ningún método satisfactorio autorizado en la comunidad, de diagnóstico, prevención o tratamiento de dicha afección, o que, de existir, el medicamento aportará un beneficio considerable a quienes padecen dicha afección.
En los Estados Unidos, las enfermedades raras son aquellas con una prevalencia menor de 200.000 personas2, y en Japón y Australia el criterio es más estricto: menos de 4 y 1,1 por 10.000 habitantes, respectivamente3. No existe una definición formal de «enfermedades ultrahuérfanas», pero en Inglaterra se usa este término para condiciones con una prevalencia de menos de un caso por 50.000 habitantes, o para una enfermedad con menos de 1000 casos en el Reino Unido, y en la mayoría, solo unos pocos cientos de enfermos4.
La obtención de esta designación, que es evaluada por el Committtee for Orphan Medicinal Products de la Agencia Europea de Medicamentos (EMA), es el primer paso que se obtiene en las fases tempranas de desarrollo del medicamento, ya que obtenerla no implica poder lanzar el producto al mercado. En un segundo paso hay que solicitar su autorización de comercialización a la EMA a través del procedimiento centralizado, donde serán evaluados por el Comité de Medicamentos para Uso Humano. Además, los laboratorios tendrán que demostrar que el medicamento sigue cumpliendo los criterios para mantener su designación de «huérfano» en paralelo con la evaluación de la solicitud de autorización.
La legislación europea contiene un paquete de incentivos5 tanto para ayudar a los laboratorios durante el proceso de designación hasta la solicitud de autorización (forma específica de consejo científico [protocol assistance], autorización centralizada por parte de la EMA, ayudas adicionales a la pequeña y mediana empresa, y tasas reducidas para actividades regulatorias), así como un incentivo si se obtiene la autorización (una exclusividad de mercado de 10 años, por la cual un medicamento similar para la misma indicación no puede entrar al mercado durante ese periodo). Sin embargo, esta exclusividad no impedirá la comercialización de un segundo medicamento cuando el titular de la autorización de comercialización de medicamentos huérfanos inicial dé su consentimiento al segundo solicitante, cuando no pueda suministrar suficiente cantidad de dicho medicamento o cuando el segundo medicamento sea más seguro, eficaz o clínicamente superior con respecto al que se beneficia de la exclusividad.
También es posible que los medicamentos huérfanos pierdan su designación, si dejan de cumplir los requisitos antes expuestos, y el laboratorio también puede solicitar la eliminación de la designación huérfana en cualquier momento. Hay medicamentos que han perdido la designación para la indicación solicitada inicialmente, pero siguen como huérfanos para otras indicaciones.
Atendiendo al número de medicamentos huérfanos autorizados (y designados, 1538 según la EMA), esta legislación se considera un éxito. Sin embargo, se ha estimado que para un gran número de enfermedades raras (alrededor de 7000) no existe tratamiento3, aunque hay medicamentos que no son «huérfanos», pero están indicados para tratarlas. Además, sin un acceso efectivo a los medicamentos huérfanos por parte de los pacientes en cada Estado miembro, el impacto de la legislación europea sería mínimo. Las políticas de financiación y precio de los medicamentos huérfanos (y de los no huérfanos) son competencia de cada país6–9, y dentro de la UE se dan situaciones dispares en el acceso (y en los precios).
El objetivo de este estudio es doble. En primer lugar, para el periodo 2002-2017, identificar los medicamentos autorizados por la EMA que, con designación de «medicamento huérfano» vigente a fecha 31 de diciembre de 2017, estén comercializados y financiados por el Sistema Nacional de Salud (SNS). En segundo lugar, para aquellos medicamentos huérfanos comercializados en España, calcular el tiempo que transcurre entre la asignación del código nacional (CN) por parte de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) y la fecha de comercialización efectiva. Se entiende por «comercialización efectiva» la de aquel medicamento que, tras tramitar la solicitud de financiación y precio al SNS, el Ministerio ha resuelto su inclusión en la prestación farmacéutica del SNS, o bien aquel medicamento que se dispensa en régimen de precio notificado (precio libre) fuera de la prestación farmacéutica del SNS (o sea, no financiado) tras haber comunicado su precio al Ministerio. Se entiende por «disponible» aquel medicamento incluido en la prestación farmacéutica del SNS o que se dispensa en régimen de precio notificado fuera del SNS. Además, para ofrecer una perspectiva europea, se analiza, en la medida de lo posible, si en España se comercializan y financian más o menos medicamentos huérfanos, y si hay más retraso en España que en el resto de Europa, así como las posibles causas).
MétodoSe han incluido todos los medicamentos huérfanos autorizados en la Unión Europea desde que se introdujo la legislación1 (año 2000) hasta el 31 de diciembre de 2017. Esta información procede de la página web de la EMA, en el Registro de medicamentos huérfanos10. Se excluyeron los medicamentos huérfanos que han perdido la designación de «huérfano» (a fecha 31 de diciembre de 2017), aunque siga vigente su autorización de comercialización11.
El tercer paso fue identificar dos fechas adicionales en España para los medicamentos huérfanos incluidos: la de asignación del CN (AEMPS) y la de comercialización efectiva (producto disponible en el mercado español).
En España, una vez autorizado el medicamento por la EMA, es necesario que la compañía solicite el CN para que el Ministerio de Sanidad, una vez asignado el CN, inicie el procedimiento para decidir sobre la inclusión del medicamento en la prestación farmacéutica del SNS, y en su caso, sobre las condiciones de financiación y precio. La duración de este procedimiento depende de varios factores, incluidos la gestión propia de la Administración y del propio laboratorio.
La fecha de asignación del CN procede del Centro de Información online de Medicamentos de la AEMPS12. La fecha de comercialización efectiva se ha extraído de la base de datos Bot PLUS13. Para tres medicamentos se comprobó la fecha de comercialización con el laboratorio, y para otros dos se recabó la información a través de noticias de prensa, ya que no se encuentra en Bot PLUS.
A continuación se calcularon el tiempo medio y la mediana desde la fecha de asignación del CN hasta la fecha de comercialización.
Por último, con la cautela que impone la comparación entre estudios que usan metodologías o bases de datos diferentes, se compararon los resultados obtenidos con los publicados en la literatura para otros países europeos.
Análisis estadísticoSe llevó a cabo un análisis descriptivo de las variables de estudio. Para las variables cuantitativas se utilizaron la media y la desviación estándar, así como las medianas y los rangos. Para las variables cualitativas se utilizaron las frecuencias absolutas y relativas.
La comparación de resultados se hizo mediante contrastes paramétricos (prueba de ji al cuadrado) y no paramétricos (prueba U de Mann-Whitney) en función de la aplicabilidad. Para todos los análisis se estableció un nivel de significación del 5%.
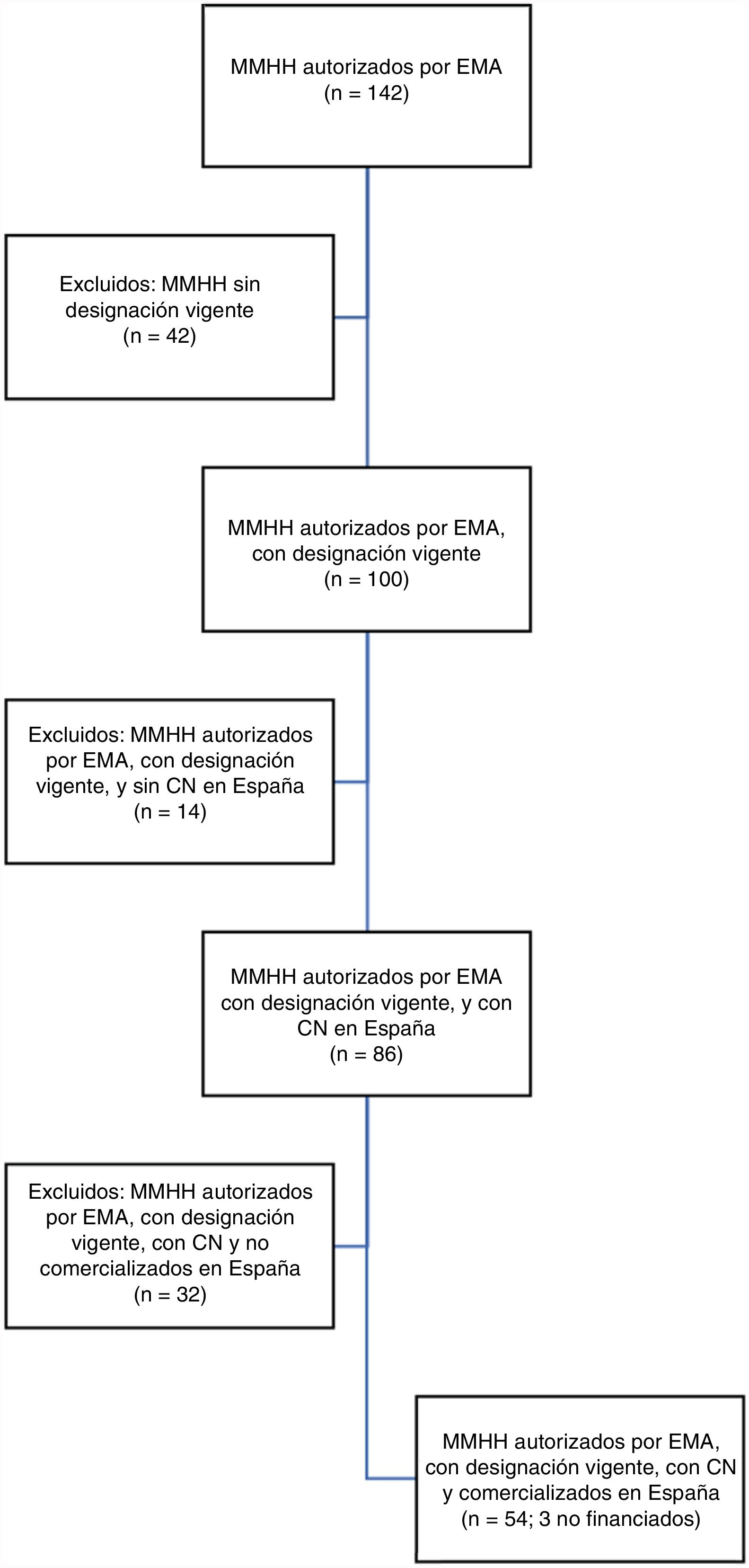
ResultadosLa figura 1 muestra el diagrama de flujo de los medicamentos huérfanos incluidos en esta revisión, e incluye una descripción detallada de las diversas categorizaciones posibles en función de los parámetros de interés.
Diagrama de flujo del número de medicamentos huérfanos (MMHH) encontrados (situación a 31 de diciembre de 2017). De los 54 medicamentos huérfanos autorizados por la Agencia Europea de Medicamentos (EMA), con designación vigente, con código nacional (CN) y comercializados en España, no se ha encontrado fecha de Bot PLUS para uno, que se incluyó como financiado, pero no se utilizó para el análisis de tiempos (por eso en la fig. 3 el análisis es para 53 medicamentos huérfanos). Treinta y dos medicamentos huérfanos están autorizados por la EMA, tienen designación vigente y CN, pero se excluyeron del análisis de tiempos por no estar comercializados en España. Estos medicamentos no están disponibles en el mercado porque no han obtenido aprobación de financiación y precio, porque han sido denegados o porque se encuentran todavía en proceso de decisión por parte del Ministerio de Sanidad. Tres medicamentos huérfanos están comercializados en España, pero no están financiados, es decir, que han pasado por el proceso de decisión de financiación y precio, pero se lo han denegado y la compañía ha decidido comercializar el fármaco sin financiación por parte del SNS, o sea, a precio libre, y sí se incluyeron en el análisis de tiempos (fig. 3). Fuente: análisis de los autores, basado en la información pública disponible sobre los medicamentos huérfanos autorizados por la EMA10, sobre los autorizados por la EMA con designación huérfana vigente11, sobre la fecha de asignación del CN12 y sobre la fecha de comercialización efectiva en España13.
Entre 2002 y 2017, la EMA autorizó 100 medicamentos huérfanos que mantienen su designación vigente a 31 de diciembre de 2017. De ellos, 86 tienen CN, y de estos, 54 se han comercializado en España (el 54% de todos los medicamentos huérfanos vigentes y el 63% de todos los medicamentos huérfanos con CN). Además, tres de estos 54 no están financiados por el SNS. No se encontró fecha de comercialización para un medicamento huérfano, que se incluyó como financiado, pero no se utilizó para el análisis de tiempos. La tabla I del Anexo online muestra la información detallada de los medicamentos de la muestra (usando la estructura de la fig. 1).
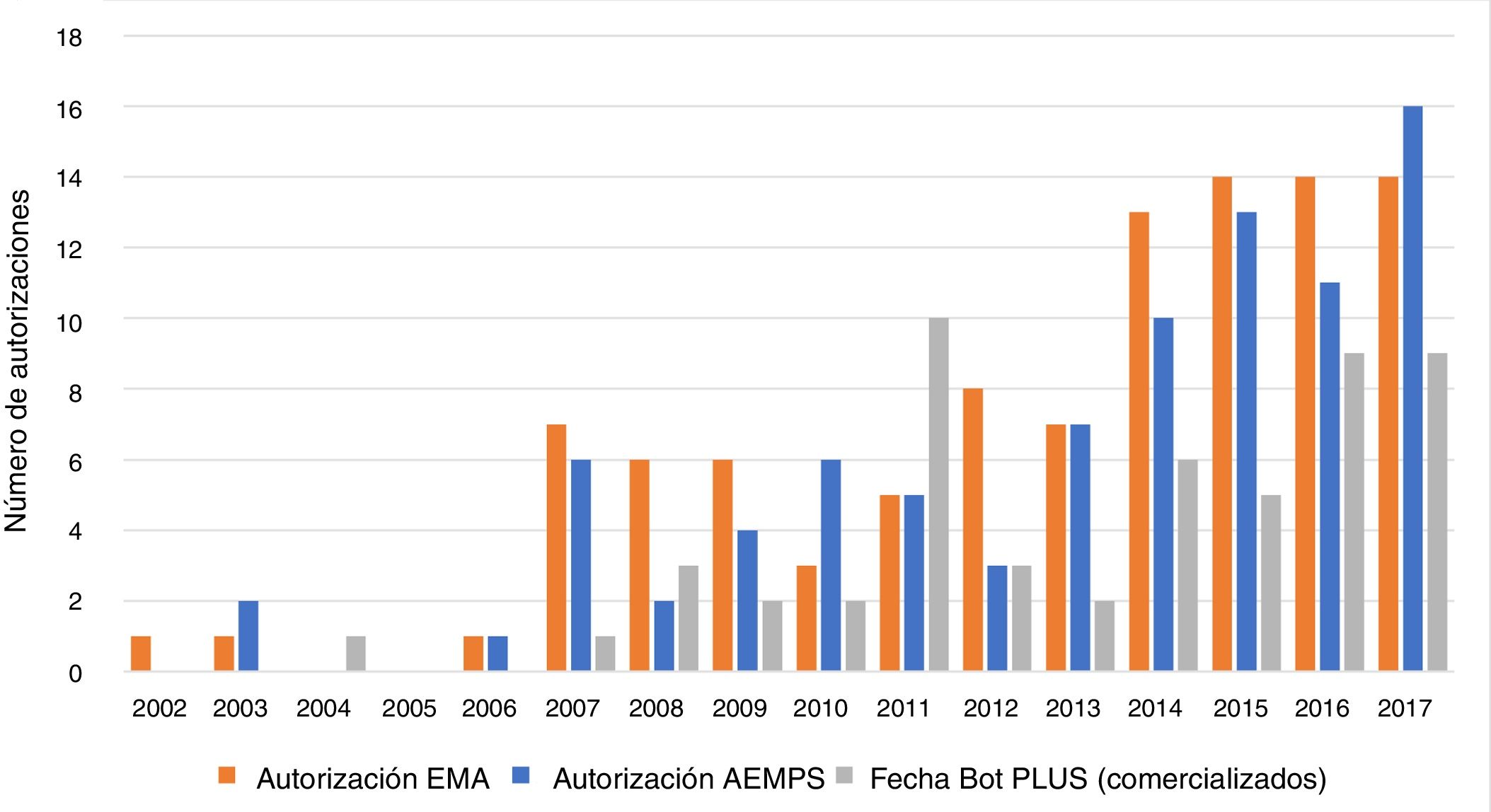
La figura 2 muestra la evolución, por año, del número de autorizaciones por la EMA y la AEMPS, y el número de medicamentos huérfanos comercializados en España.
Número de autorizaciones por la Agencia Europea de Medicamentos (EMA) (n = 100) y por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) (n = 86), e inclusión en Bot PLUS, por año (n = 53, + 1 sin fecha no incluido), para medicamentos huérfanos con designación vigente a 31 de diciembre de 2017. Fuente: análisis de los autores, basado en la información pública disponible sobre los medicamentos huérfanos autorizados por la EMA10, sobre los autorizados por la EMA con designación huérfana vigente11, sobre la fecha de asignación del CN12 y sobre la fecha de comercialización efectiva en España13.
De acuerdo con la figura 2, pueden hacerse cuatro observaciones:
- •
En general, las autorizaciones por la EMA y la AEMPS se comportan de manera similar, mientras que el número de medicamentos huérfanos comercializados en España parece tener dos etapas diferenciadas (antes y después de 2014), con un caso aislado (2011).
- •
Solo uno de los 53 medicamentos huérfanos con fecha de comercialización en España se financiaron antes de 2006. Los medicamentos huérfanos con más antigüedad han perdido la designación de huérfano y por lo tanto no están en nuestra muestra de interés. A fecha 31 de diciembre de 2017, la EMA había aprobado 144 medicamentos huérfanos (para 159 indicaciones), incluidos los que ya han perdido esta designación14, 44 más que nuestra muestra. De estos 44 medicamentos, 34 fueron autorizados por la EMA entre 2001 y 2007. Según datos de Orphanet14, el 57% de los medicamentos huérfanos que han perdido la designación ha sido por el fin de la exclusividad otorgada, el 43% fueron retirados por solicitud del laboratorio y en el 2% no fue posible determinar la razón.
- •
El número de medicamentos huérfanos comercializados en España suele ser inferior que el de los autorizados por la EMA y los que tienen CN, excepto en el año 2011, en el que se observa un pico importante en la comercialización de medicamentos huérfanos en España (n = 10). A partir de 2014 hay un incremento de los medicamentos huérfanos autorizados por la EMA que se mantiene en los posteriores años, siendo superior el número en la etapa posterior a 2014 (45 vs. 55 medicamentos huérfanos autorizados por la EMA antes y después de 2014, respectivamente). Este incremento también se observa para los medicamentos huérfanos comercializados en España (24 vs. 29 medicamentos huérfanos comercializados en España antes y después de 2014, respectivamente). No se observaron diferencias significativas en el número de medicamentos de las dos etapas (antes y después de 2014) entre los medicamentos huérfanos autorizados por la EMA y los comercializados en España (p = 0,97).
- •
Por último, durante 2016 y 2017 se comercializaron en España 18 medicamentos huérfanos (nueve por año), que es el número por año más alto después de 2011. Sin embargo, la diferencia entre los comercializados y los autorizados está aumentando, aunque no es estadísticamente significativa comparando los periodos 2002-2011 y 2012-2017 (p = 0,46). Durante 2002-2011, 26 de los 30 medicamentos huérfanos autorizados por la EMA tenían CN y 19 estaban comercializados (el 73% de los medicamentos huérfanos con CN). Durante 2012-2017, este porcentaje fue del 57% (70 medicamentos huérfanos autorizados por la EMA, 60 con CN y 34 comercializados). El periodo más reciente tendrá asociado un menor número de comercializaciones, dado el tiempo transcurrido entre la autorización por la EMA y la decisión de financiación y precio.
De los 32 medicamentos huérfanos no comercializados en España (pero con CN) a fecha 31 de diciembre de 2017 (no incluidos en la fig. 2), 16 tienen fecha de asignación de CN de la AEMPS en 2017, tres en 2016, seis en 2015, cuatro en 2014, dos en 2013 y uno en 2012; sin embargo, 10 de estos 32 medicamentos huérfanos han sido comercializados en España entre enero y agosto de 2018.
La figura 1 también muestra 14 medicamentos huérfanos autorizados por la EMA y con designación vigente, pero sin CN (entendemos que la razón es que los laboratorios no han pedido CN); cinco tienen fecha de autorización de la EMA en 2017, tres en 2016, tres en 2015, uno en 2014 y dos en 2013.
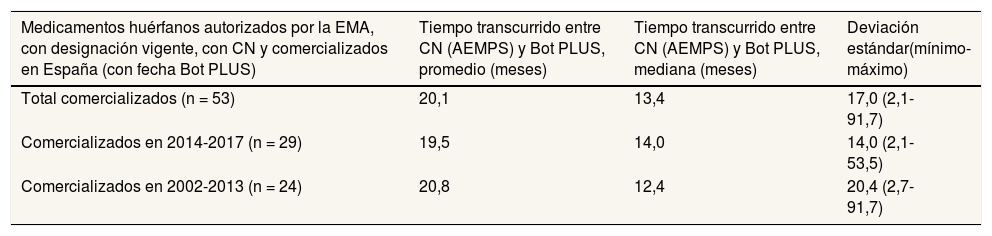
Análisis de tiemposPara los medicamentos comercializados en España se ha analizado el tiempo medio y la mediana desde la asignación del CN por la AEMPS hasta su comercialización en España. La tabla 1 (primera fila) muestra por columnas, en el siguiente orden, el número de medicamentos huérfanos comercializados por periodos de tiempo, las medias y las medianas del tiempo transcurrido hasta su comercialización, y la desviación estándar de la submuestra analizada. En la primera fila se encuentra la información para los 53 medicamentos huérfanos comercializados, y en las filas segunda y tercera se encuentra la misma información para las dos submuestras en función de la fecha de comercialización (2002-2013 y 2014-2017, respectivamente). Así, para toda la muestra, el tiempo medio transcurrido fue de 20,1 meses, con una mediana de 13,4 meses. La desviación estándar es considerable, y el intervalo de tiempo está entre 2 y 91 meses. La mediana para los medicamentos huérfanos comercializados entre 2002-2013 es de 12,4 meses, y aumenta a 14,0 meses para el segundo grupo, aunque no se hallaron diferencias significativas entre ambos periodos (p = 0,46).
Tiempo medio y mediana desde la asignación de código nacional por la Agencia Española de Medicamentos y Productos Sanitarios para un medicamento huérfano hasta su comercialización en España (Bot PLUS)
| Medicamentos huérfanos autorizados por la EMA, con designación vigente, con CN y comercializados en España (con fecha Bot PLUS) | Tiempo transcurrido entre CN (AEMPS) y Bot PLUS, promedio (meses) | Tiempo transcurrido entre CN (AEMPS) y Bot PLUS, mediana (meses) | Deviación estándar(mínimo-máximo) |
|---|---|---|---|
| Total comercializados (n = 53) | 20,1 | 13,4 | 17,0 (2,1-91,7) |
| Comercializados en 2014-2017 (n = 29) | 19,5 | 14,0 | 14,0 (2,1-53,5) |
| Comercializados en 2002-2013 (n = 24) | 20,8 | 12,4 | 20,4 (2,7-91,7) |
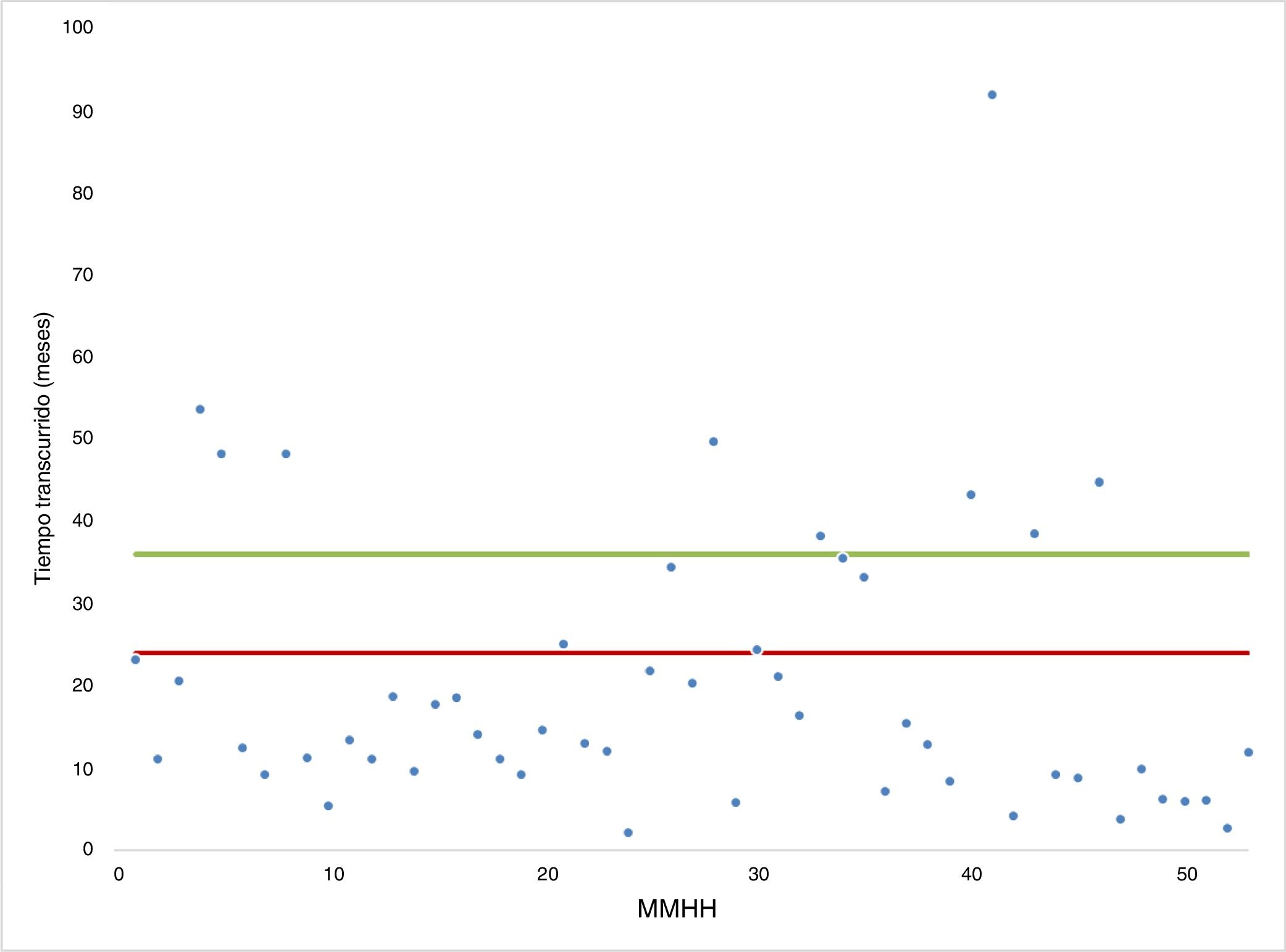
La figura 3 muestra el tiempo transcurrido para cada uno de los medicamentos huérfanos con fecha de comercialización en España (n = 53), marcando los 2 y 3 años con una línea horizontal como referencia para identificar aquellos productos con tiempos más largos (14 y 9 medicamentos huérfanos, respectivamente). Aun sin poder realizar un estudio pormenorizado, medicamento a medicamento, y las razones específicas por los tiempos transcurridos, da la sensación de que la mayoría de los medicamentos huérfanos pasan a ser accesibles en un periodo ≤2 años tras obtener el CN. Sin embargo, una vez superado el umbral de los 2 años, parece que la mayoría están por encima de los 3 años; así, de los 14 medicamentos huérfanos con tiempos superiores a 2 años, para 9 (64%) el retraso es superior a 3 años.
Tiempo transcurrido (meses) desde la asignación del código nacional por la Agencia Española de Medicamentos y Productos Sanitarios hasta su comercialización en España, para medicamentos huérfanos (MMHH) con fecha de comercialización en España (n = 53). Cada punto (azul) muestra el tiempo transcurrido entre la fecha de asignación del código nacional y la fecha de comercialización efectiva, en meses, para cada uno de los 53 medicamentos huérfanos incluidos en la muestra. La serie está ordenada por fecha de Bot PLUS, siendo el primer punto el último medicamento de nuestra muestra comercializado en España. La primera línea horizontal (roja) indica 24 meses y la segunda línea horizontal (verde) indica 36 meses. Así, tenemos cinco medicamentos huérfanos con tiempos entre 24 y 36 meses, y nueve con un tiempo superior a los 36 meses. Fuente: análisis de los autores, basado en la información pública disponible sobre la fecha de asignación del CN12 y sobre la fecha de comercialización efectiva en España13.
Este estudio muestra que una proporción significativa de medicamentos huérfanos (en vigencia) son financiados por la sanidad pública española, aunque nuestro análisis indica que la diferencia entre los medicamentos huérfanos autorizados por la EMA y los comercializados en España ha ido aumentando durante los últimos años, aunque sin alcanzar diferencias estadísticamente significativas entre los periodos 2002-2011 y 2012-2017 (p = 0,46). Esto puede deberse en gran parte al reducido número de medicamentos huérfanos; es decir, durante el periodo de estudio (y para España en concreto) no existen más medicamentos huérfanos que pudieran ser incluidos en la muestra, y por lo tanto sería importante ir actualizando el análisis de manera regular para incrementar la muestra y evaluar si las diferencias se convierten en estadísticamente significativas o no. Otra manera de paliar el problema del tamaño de la muestra sería estudiando este tema en otros países y, por ejemplo, plantear un metaanálisis con los datos de varios de ellos.
También se observa una tendencia creciente en el número de medicamentos huérfanos autorizados por la EMA después de 2014; aunque es difícil identificar todas las razones que explican este resultado, creemos que en parte viene dado por el Programa Marco de la Unión Europea (denominado Horizonte 2020) para el periodo 2014-2020, en el que se está intentando promover, entre otras cosas, el liderazgo industrial en Europa y reforzar la excelencia de su base científica, así como la creación en el año 2011 del Consorcio Internacional para la Investigación en Enfermedades Raras. Este Consorcio tenía como objetivo disponer de 200 medicamentos huérfanos autorizados en 2020; como este objetivo está cerca de ser cumplido, el nuevo objetivo es, desde 2017, alcanzar los 1000 nuevos tratamientos para 202715. Este objetivo también tendrá como efecto un incremento en nuevos medicamentos huérfanos en el futuro. Desconocemos la razón del pico encontrado en 2011 para los medicamentos huérfanos comercializados en España.
Para España en concreto, el tiempo medio transcurrido entre la asignación del CN y la comercialización efectiva, para toda la muestra, es claramente mayor que la mediana. La mediana es más representativa que la media aritmética cuando la población es bastante heterogénea o el conjunto de números tiene valores atípicos. La mediana se comporta de forma más consistente cuando se incluyen o excluyen los valores extremos, por lo que creemos que el valor de la mediana es el que debería analizarse como reflejo de la situación real del acceso a los medicamentos huérfanos en España y su evolución. Así, como resultado ilustrativo, si excluimos los medicamentos huérfanos con periodos de más de 2 años, la media desciende a 11,7 meses (para 39 medicamentos huérfanos; mediana = 11,1), y si excluimos los de más de 3 años (n = 44) es de 13,8 meses (mediana = 12,0).
Los casos extremos observados en algunos de los tiempos transcurridos hasta la comercialización son independientes del propio proceso de financiación y podrían deberse a varias causas. Más adelante comentamos la complejidad de los factores que determinan el acceso a los medicamentos huérfanos en España, pero los resultados podrían interpretarse como que un retraso de 2 años es el máximo aceptable en circunstancias normales, y que todos los medicamentos huérfanos que se retrasan más de 2 años lo hacen debido a problemas en la negociación del precio o la financiación, decisiones estratégicas de los desarrolladores u otros factores.
Un estudio ha analizado la situación de los 57 medicamentos huérfanos autorizados por la EMA entre 2012 y 2016 en España; de ellos, 40 tenían CN y 17 estaban financiados en España (el 30% de todos los autorizados y el 43% de aquellos con CN)16. Este estudio estima unos tiempos similares a los encontrados por nosotros en un periodo similar.
Otro estudio analiza y compara la disponibilidad y el acceso a medicamentos huérfanos en el Reino Unido, Francia, Alemania, Italia y España17. Sus autores consideran todos los medicamentos huérfanos autorizados por la EMA, independientemente de su designación, a fecha 31 de mayo de 2016 (143 medicamentos/indicaciones). Un medicamento huérfano se define como «disponible» si puede prescribirse, y se tiene «acceso» si está financiado (al menos parcialmente) por el sistema público. El 52% (75) estaban comercializados y financiados en España, cifras parecidas a las nuestras. En comparación con otros países, según un estudio similar más antiguo18, España ya no estaría a la cola en términos de proporción de medicamentos huérfanos que son financiados respecto a todos los autorizados, en parte porque la proporción financiada en otros países también ha ido disminuyendo. Sin embargo, el acceso sigue siendo menor que en Alemania, Francia e Italia.
En otro estudio19 se comparó el acceso a los medicamentos huérfanos (y no huérfanos) en 22 países europeos (incluyendo España) entre 2005 y 2014, y sus resultados son parecidos a los nuestros. Además, muestra que España no está entre los países con mayor acceso a los medicamentos huérfanos, que son Alemania, Francia, los países escandinavos, el Reino Unido y Suiza.
Los tiempos transcurridos entre la autorización por parte de la EMA y su financiación también han sido analizados en otros estudios, aunque no diferencian entre las dos etapas que nosotros distinguimos17. Para España, este tiempo, de media, es de 23,0 meses; para los siete países incluidos en el estudio, fue de 20 meses. Los tiempos más cortos son para Alemania (disponibilidad inmediata), Italia y Francia (18,6 y 19,5 meses, respectivamente), y los más largos son para Inglaterra y Gales (27,6 y 29,3 meses, respectivamente). Los tiempos en Escocia (22,6 meses) son parecidos a los de España. Este estudio, sin embargo, no reporta información de variabilidad, por lo que solo podemos comparar nuestros resultados con la media reportada.
Desde nuestra perspectiva, la autorización de comercialización centralizada para los medicamentos huérfanos (y no huérfanos) por la EMA tiene como objetivo asegurar una uniformidad en Europa. Sin embargo, los procesos de financiación y precios para todos los medicamentos son competencia nacional, por lo que esta uniformidad no se ve reflejada en el acceso a los medicamentos huérfanos17–20. Incluso se ha argumentado21 que las políticas actuales dirigidas a los medicamentos huérfanos son insatisfactorias, ya que, entre otras cosas, se está restringiendo el acceso a ellos.
El análisis detallado de los factores que determinan el acceso efectivo a los medicamentos huérfanos queda fuera del alcance de este artículo; sin embargo, ofrecemos una visión de alto nivel sobre estos factores, para poder ofrecer así algunas recomendaciones. Existen diversos estudios que analizan estas razones, que podemos agrupar en tres: el alto coste del tratamiento anual o del precio de los medicamentos huérfanos por paciente y el impacto presupuestario esperado6,19,20,22–24, los sistemas de financiación, precios y evaluación (económica)7,19,25–30, y los nuevos modelos de pago o esquemas alternativos de financiación9,31–33.
Para la primera cuestión, se ha comparado el coste del tratamiento anual con medicamentos huérfanos por paciente, y su precio, entre diferentes países europeos, y se ha observado que los precios pueden diferir mucho entre medicamentos, aunque de media las diferencias son pequeñas, por lo que es difícil predecir en qué país los precios serán mayores o menores6. En términos de impacto presupuestario, se han encontrado diferencias entre las estimaciones no solo entre países, sino también dentro de un mismo país22. Los medicamentos huérfanos representarían un 2,7% del gasto farmacéutico total (de media), con un rango entre el 0,7% y el 7,8%. Además, dos estudios estiman que, para 2020, el gasto en medicamentos huérfanos llegará a un máximo del 4-5% del gasto farmacéutico total, y que después su crecimiento no será mayor que el del gasto farmacéutico total23,24. Una de las razones de este efecto se debe a la expiración de la exclusividad de mercado para muchos medicamentos huérfanos, pues se asume que, una vez expirada la propiedad intelectual, habrá una reducción de precios23,24.
Para la segunda cuestión, las diversas políticas de precio, reembolso y evaluación tendrán un impacto sobre el acceso a estos medicamentos. En cuanto a la regulación de precios, el sistema de precios de referencia internacionales puede hacer que los laboratorios elijan estratégicamente la secuencia de acceso a los diferentes países que maximice sus intereses comerciales, lo que provocaría mayores retrasos en el acceso a los medicamentos huérfanos en aquellos países donde la financiación es concedida con mayor retardo o pueden influenciar los precios negociados en el resto de forma negativa34,35.
Sobre modelos de evaluación, según las recomendaciones de cuatro agencias de evaluación (España no incluida) para 10 medicamentos huérfanos, se argumenta que las razones que pueden explicar las diferentes decisiones sobre financiación (con su consiguiente impacto negativo en el acceso si no se financian) para un mismo medicamento incluyen heterogeneidad en la evidencia evaluada, en la interpretación de la misma evidencia y en las diferentes maneras de tratar la misma incertidumbre26. Podría argumentarse que, desde el punto de vista de la evaluación económica, existen dos líneas de pensamiento. Por una parte, hay estudios que concluyen que los medicamentos huérfanos (y sobre todo los ultrahuérfanos) nunca podrían ser considerados coste-efectivos (p. ej., el National Insitute for Health and Care Excellence [NICE] en Inglaterra permite un umbral de coste-efectividad más alto36, aunque esto se aplicaría solo a los medicamentos ultrahuérfanos, las llamadas highly specialised technologies) y que existen grandes desafíos para utilizar el criterio de coste-efectividad y por lo tanto para el desarrollo de nuevos mecanismos de financiación para medicamentos huérfanos25,27,28. Parte de estos desafíos vienen dados por las escasas evidencias sobre su eficacia y efectividad, que suelen asociarse a una elevada incertidumbre y el desconocimiento de sus resultados, en especial a largo plazo7,25. Por otra parte, algunos autores argumentan que los medicamentos huérfanos no deberían tratarse de distinta forma, y que pueden (o deben) ser coste-efectivos con la metodología tradicional de evaluación económica29–33.
Algunos modelos de evaluación permiten la inclusión de otros criterios adicionales a la efectividad y el coste-efectividad para determinar la financiación o reembolso de los medicamentos huérfanos; son los denominados criterios humanísticos, que incluyen justicia, equidad en el acceso, regla de rescate y rareza9,20. Su uso en la toma de decisiones podría facilitar el acceso a los medicamentos huérfanos, ya que podrían verse favorecidos usando estas variables en la evaluación. En el Reino Unido, por ejemplo, el NICE utiliza juicios sociales de valor (social value judgements) para tomar decisiones37. Basándose en el análisis de los criterios utilizados en varios países, se argumenta que en la mayor parte de los países desarrollados (incluido España) la financiación y el reembolso público de los medicamentos huérfanos se realiza con los mismos criterios que para el resto de los medicamentos, al menos formalmente, aunque en la práctica se les pueden aplicar ciertas excepciones9. En España en concreto, las decisiones (centrales y autonómicas) de precio, financiación y acceso se toman basándose en más de un criterio; el problema, desde nuestra perspectiva, es que no hemos podido obtener información sobre los criterios que se utilizan en la práctica. Además, mientras que la eficiencia/evaluación económica debería ser uno de los criterios, y su uso en España está regulado en la Ley de Garantías y Uso Racional de los Medicamentos y Productos Sanitarios, su uso «efectivo» es desconocido. Como se ha argumentado, en el caso de España, la ausencia de unas directrices metodológicas únicas y oficiales, así como la inexistencia de un umbral explícito, hacen difícil definir cuándo es o no eficiente una intervención sanitaria38, y es necesario aumentar la transparencia del sistema de fijación de precios y reembolso.
Por último, se ha planteado financiar medicamentos huérfanos con distintos esquemas de financiación que faciliten el acceso de los pacientes al tratamiento, manejen la falta de evidencia científica sobre el fármaco y contengan su impacto presupuestario9,32,33. Uno de estos esquemas son los acuerdos de riesgo compartido, en los que se permite al financiador público compartir con la industria farmacéutica los riesgos asociados a los resultados (en salud o en gasto) del medicamento, y así recoger información sobre su efectividad en la práctica clínica. El concepto de «pago por resultados» se extiende a los medicamentos no huérfanos, ya que uno de los criterios principales para determinar su uso es la existencia de incertidumbre sobre el efecto o el coste/impacto presupuestario39. Esta incertidumbre suele ser más importante, si cabe, para los medicamentos huérfanos, y por ello el uso de estas formas de pago podría ser eficiente para determinar su financiación (sin olvidar que hay obstáculos en su diseño, implantación y seguimiento que deben gestionarse rigurosamente)32,33. Sin embargo, la experiencia en Italia, uno de los países referentes en el uso de este tipo de esquemas40, muestra que puede ser una fórmula para disminuir la incertidumbre sobre su coste/efectividad, así como un modo de contener el gasto en los medicamentos financiados con estos mecanismos y asegurar que los precios reflejan su valor41.
Como limitación de este estudio es importante recalcar que puede existir un sesgo en el análisis debido a la falta de información de las fechas en Bot PLUS. Nuestra experiencia con esta base de datos indica que puede darse el caso de que las fechas sobre comercialización, autorización y notificación de precios, entre otras, sean erróneas o no estén incluidas, lo que podría alterar el análisis. El proceso de recolección e información y transparencia de estas fechas es muy importante, por lo que se estima que una mejora en la transparencia y la accesibilidad de esta información (p. ej., en la página web del Ministerio de Sanidad y la AEMPS) contribuiría a mejorar los futuros análisis y sus conclusiones, aplicables para el diseño de futuras políticas. Otra limitación, como ya se ha comentado, es el tamaño de la muestra, por lo que se recomienda realizar más estudios y no solo para España, sino de ámbito europeo, lo que daría la posibilidad de hacer un análisis estadístico más detallado y robusto.
Como conclusión, muchos y complejos factores determinan el acceso a los medicamentos huérfanos en los países europeos. Mientras la autorización centralizada de comercialización en Europa puede considerarse un éxito, el acceso de los pacientes es más limitado, dadas las complejidades de evaluación de la evidencia disponible en los procesos de financiación y precio para los medicamentos huérfanos. Asimismo, se ha recomendado una mayor coordinación en la evaluación de medicamentos huérfanos en toda Europa31. En España, alrededor del 50% de los medicamentos huérfanos autorizados por la EMA están comercializados (y financiados), pero parece que la distancia entre las autorizaciones y las comercializaciones está aumentando. Además, el número de medicamentos huérfanos comercializados y financiados en España es inferior al de otros países europeos (Alemania, Francia e Italia). Los tiempos (mediana) entre la asignación del CN y la comercialización en España están alrededor de 13 meses, aunque el incremento en los últimos años no es estadísticamente significativo.
Dada la complejidad de los medicamentos huérfanos, es necesario implementar nuevas políticas que tengan como objetivos reducir las desigualdades al acceso y permitir la sostenibilidad del sistema sanitario. Estas políticas estarían representadas en la posibilidad de un proceso acelerado en la decisión de financiación y precio, y el pago por resultados cuando la incertidumbre es alta. Creemos que son necesarias políticas que reduzcan las desigualdades en el acceso, convergiendo a mayores números de medicamentos huérfanos comercializados, que ayuden a obtener tiempos de comercialización más homogéneos entre países europeos (con las medianas del país que las tenga más bajas), que ayuden a la sostenibilidad de los sistemas sanitarios al relacionar precios (y gasto) con resultados, así como que sigan incentivando la investigación y el desarrollo en enfermedades raras. Y todo esto debería establecerse en un marco transparente en el que la información esté disponible para poder evaluar el acceso a los medicamentos huérfanos en España (por desgracia, en la actualidad no toda esta información está disponible públicamente).
Editor responsable del artículoDavid Epstein.
Declaración de transparenciaEl autor principal (garante responsable del manuscrito) afirma que este manuscrito es un reporte honesto, preciso y transparente del estudio que se remite a Gaceta Sanitaria, que no se han omitido aspectos importantes del estudio, y que las discrepancias del estudio según lo previsto (y, si son relevantes, registradas) se han explicado.
Muchos y complejos factores determinan el acceso a los medicamentos huérfanos en los países europeos. Se estima que alrededor del 50% de los autorizados por la Agencia Europea del Medicamento están comercializados en España.
¿Qué añade el estudio realizado a la literatura?Los tiempos (mediana) entre la fecha de asignación del código nacional y la fecha de comercialización para medicamentos huérfanos en España han aumentado de 12,4 a 14,0 meses entre 2002-2013 y 2014-2017. Esta diferencia no es estadísticamente significativa, posiblemente en parte por el limitado número de medicamentos huérfanos que pueden incluirse en el análisis. Es necesario implementar nuevas políticas que reduzcan las desigualdades en el acceso y que permitan la sostenibilidad del sistema, ofreciendo la posibilidad de un proceso acelerado en la decisión de financiación y precio, y el pago por resultados con incertidumbre alta.
M. Iniesta y J. Mestre-Ferrándiz concibieron y diseñaron el trabajo, y realizaron la recogida de datos, su análisis e interpretación. Todas las personas firmantes participaron en la escritura del artículo o en su revisión crítica con importantes contribuciones intelectuales, y aprobaron la versión final para su publicación.
FinanciaciónEste estudio ha sido financiado por la Asociación Española de Laboratorios de Medicamentos Huérfanos y Ultrahuérfanos (AELMHU).
Conflictos de interesesM. Iniesta es Directora Ejecutiva de AELMHU. Todas las demás personas firmantes no declaran ningún conflicto de intereses relevante.